疫苗免疫是动物疫病防控的重要手段之一,科学、合理使用疫苗保障了国家疫病防控政策的有效实施.常规疫苗在当前的动物疫苗市场仍然占主导地位,在动物传染病的防控过程中发挥了重要作用.目前我国常规疫苗种类繁杂、生产厂家众多,疫苗质量没保障,良莠不齐.主要问题有:疫苗有效抗原成分低(杂质多、未纯化)、疫苗产品缺少质控标准(生产和检验工艺难以标准化)、疫苗使用成本较高(需低温贮藏和运输)、用传统工艺生产的灭活疫苗和减毒活疫苗存在生物安全风险(灭活不彻底、毒株返强或重组)等突出问题[1-2].为此,革命性升级疫苗产品,研制安全、高效、微量、精准的新型疫苗,实现疫苗的更新换代,是动物疫病防控的有效措施,是畜牧业高效发展的保障.
1 疫苗研究发展历程疫苗(Vaccines)的概念最早来源于英国医生爱德华·琴纳(Edward Jenner),他发明了牛痘接种预防天花,被称为“疫苗之父”;另一位疫苗学先驱是法国的路易斯·巴斯德(Louis Pasteur),他创建了炭疽减毒活疫苗和狂犬病活病毒疫苗,其后霍乱和伤寒灭活菌苗以及类毒素(白喉和破伤风)亚单位疫苗得以发展,形成以减毒活疫苗和灭活疫苗为主的常规疫苗[3].减毒活疫苗经历了从使用动物病毒到物理致弱、动物或鸡胚传代和细胞培养传代致弱的发展过程,灭活疫苗则从全菌或病毒灭活向类毒素、菌体提取物、纯化多糖和蛋白质发展[4].随着分子生物学、生物化学、生物信息学和结构生物学的发展,新型疫苗研究已由传统的常规疫苗和基因工程疫苗向结构疫苗和靶向疫苗发展.人们根据疫苗发展进程将疫苗学分为3个阶段:一是传统疫苗学(conventional vaccinology),包括常规疫苗和基因工程疫苗,即利用微生物培养技术生产常规疫苗和利用基因工程技术生产基因工程疫苗,该技术已成功应用于多种疫苗研发,但对难以培养或缺乏优势保护性抗原的微生物疫苗尚无有效解决方案;二是反向疫苗学(reverse vaccinology),即利用基因组学和泛基因组学技术更高效地选择候选疫苗,该技术最早应用基于对B型脑膜炎球菌的基因组学分析,随后泛基因组学、比较基因组学和消减基因组学与蛋白质组学、分子流行病学和结构生物学结合应用于疫苗靶抗原的精确选择,并且鉴定了脑膜炎球菌H因子结合蛋白等新的毒力因子;三是结构疫苗学(structural vaccinology),将组学技术与结构生物学有机结合,利用高解析度的结构信息,对保护性抗原进行重新设计和优化,去除无关成分而保留保护性表位,进而研制更高效、广谱、安全、稳定的新型疫苗,深入了解抗原免疫原性和免疫优势的结构基础有助提高疫苗免疫效率和范围[5-8].在结构疫苗研究方面,Jardine等根据人免疫缺陷病毒(HIV)广谱中和抗体(bNAbs)VRC01与gp120的晶体结构设计了靶向种系抗体的eOD-GT6抗原,其具有与多重VRC01抗体及其种系前体的结合构象,将eOD-GT6免疫原与自组装蛋白连接形成病毒样颗粒,可激活种系和成熟B细胞产生中和性抗体[9-11].Nuccitelli等将不同菌株B型链球菌BP-2a蛋白D3结构域串联形成嵌合免疫原,诱导产生针对6个菌株的广谱免疫保护[11].Kanekiyo等将流感病毒HA蛋白与幽门螺杆菌铁蛋白融合,形成自组装纳米疫苗,诱导产生H1N1的广谱中和性抗体[12].Correia等证明利用计算机设计的呼吸道合胞病毒中和表位多肽可以维持天然蛋白的表位空间构象,并诱导产生强的中和性抗体,其与天然蛋白的结合构象与原始单抗极为相似[13].Liu等设计合成靶向淋巴结的CpG-DNA/多肽分子疫苗,疫苗可在淋巴结富集并能激活T细胞反应,增强抗肿瘤效应[14].图 1是当前主要疫苗研发技术从科学发现到技术转化和产品研发所需要的发展进程,分别表示相关技术从科学发现到研发技术成熟和尚待发展的时间[15],提示疫苗研究进入新的发展阶段,同时也面临巨大挑战.
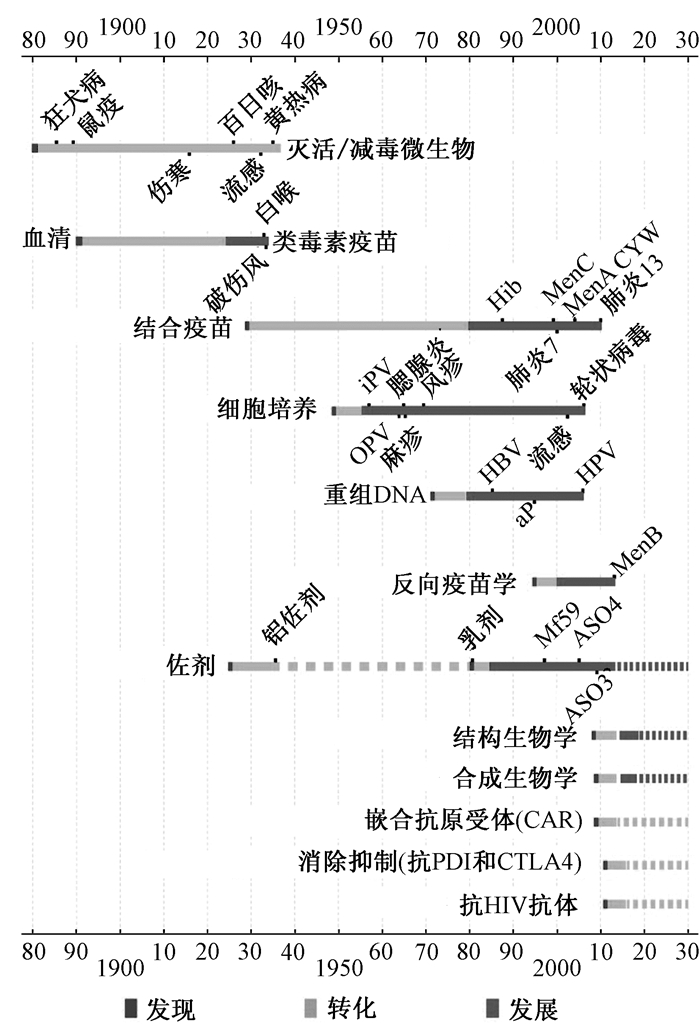
|
图 1 主要疫苗研发技术发展进程[15] Figure 1 Development of major vaccine research and preparation technologies[15] |
当前动物疫苗种类繁多,而且动物免疫次数多、免疫剂量大,使动物机体免疫系统承受压力过大,从而导致免疫保护效果欠佳.针对这一突出问题,我们提出“动物免疫潜力”的新概念:认为动物拥有巨大的免疫潜力,同时这种免疫潜力又是有限的[2].在正常情况下,动物机体生理能力是用于生产的,若过多用于免疫,就会影响生产,所以使用疫苗的种类和次数不能超出动物的免疫潜力.假如一个动物的免疫潜力是1 000点,在正常情况下,预防一种传染病只需50~100点,理论上推算至少可以预防100种这个动物的传染病,其免疫潜力很大,足以满足动物疫病防控的需要.但由于传统工艺生产的疫苗过于混乱、与免疫无关的杂质太多,导致理论上用100点的免疫潜力就可以预防的一种动物传染病,在实际中却要消耗3 000点免疫潜力才可以达到免疫保护的目的,从而导致该动物10 000点的免疫能力并不能预防100种传染病,而是只能预防3种,这不是疫苗免疫本身有问题,而是加载的无效疫苗成分太多,无谓地消耗了大量的动物免疫潜力.因此,在生产实践中常出现因免疫过度而导致免疫效果差的现象,就会出现类似1+2=3,而3+2 < 3的结果.
3 新概念疫苗研究在我国现有的动物饲养管理条件下,在养殖过程中实现完全的疫病净化非常困难,用疫苗防控动物疫病仍是必需的手段,但当前的动物疫苗产品中存在过多的无效成分,极大浪费了动物的生理能力和免疫能力,致使疫苗免疫效果差、疫病防控不力.因此,应针对这一问题,开展全新的新概念疫苗研究,来实现节省动物的免疫能力,同时提高免疫保护效果的目的,让3+2=5而不是3+2=0.
人们常说的新概念疫苗多以新技术命名,如基因工程疫苗、基因疫苗、亚单位疫苗、病毒空壳疫苗等.我们根据“动物免疫潜力”新概念建立了以动物实际需求进行分子疫苗设计的“新概念疫苗”理论,其基本原则是精确、微量、纯化、安全、高效,不浪费动物免疫力.具体内容为:(1) 精确:包括抗原位点、表位结构和免疫启动的精确设计和激活;(2) 微量:要求抗原量在微克级即可产生有效保护;(3) 纯化:高纯度,杂质极少;(4) 安全:实现真正的生物安全(不含基因),无病原扩散;(5) 高效:多种疫苗联合使用,占用动物极少的免疫潜力但能实现有效保护.实现了疫苗真正意义的高效(联合使用),其核心就是不浪费动物免疫能力.理想的新概念疫苗应该具备6个特点:(1) T、B淋巴细胞协调工作;(2) 高度安全;(3) 真正高效;(4) 容易保存;(5) 精确、微量、纯化、不浪费免疫能力;(6) 低成本工厂化合成生产.
我们研究团队致力于动物病毒新概念疫苗研究,系统开展了动物病毒的免疫识别研究,发现了鸡传染性法氏囊病病毒、鸡新城疫病毒、禽流感病毒和猪瘟病毒等主要动物病毒蛋白的系列B细胞抗原表位,并在GenBank注册B细胞抗原表位序列12个,绘制了主要动物病毒蛋白的B细胞表位图谱;同时也开展了动物MHCI与CTL表位、动物MHCII与Th表位研究,并分析其免疫识别规律和免疫保护效力,为新概念疫苗研究奠定了基础[16-21].
新概念疫苗的研究策略见图 2,包括疫苗的分子设计、疫苗抗原的重组表达、结构化疫苗装配和通用佐剂等.新概念疫苗设计要从B细胞的识别与抗体反应、T细胞的识别与CTL反应、中和抗体与非中和抗体反应,以及免疫佐剂(Th反应的通用性和Toll样受体的作用)等因素综合考虑.根据动物病毒抗原表位的结构和识别规律,设计系列T/B细胞疫苗和免疫佐剂,并利用多种表达系统对设计抗原进行高效表达和鉴定.我们利用大肠杆菌表达系统,表达了鸡传染性法氏囊病毒(IBDV)和猪圆环病毒2型(PCV2) 的结构抗原,并制备了病毒样颗粒,取得良好免疫效果[22].同时,与西北农林科技大学合作开展结构抗原的乳腺生物反应器研究,相关抗原基因完成核移植,并获得妊娠母羊;与武汉大学合作开展结构抗原的转基因水稻表达研究,构建了鸡新城疫病毒(NDV)、禽流感病毒(AIV)、CSFV和FMDV等病毒结构抗原的植物表达质粒,通过农杆菌介导的遗传转化,阳性转化植株通过筛选和分化,培育成转基因水稻植株,并纯化了水稻表达蛋白.在获得重组蛋白单体的基础上,探索开展结构化疫苗的研制,包括嵌合VLP、多聚蛋白体和纳米疫苗等,通过自组装、分子识别或化学连接制备嵌合VLP,在VLP表面展示多价抗原;利用氨基、羧基、巯基等不同的功能基团通过同源或异源蛋白交联或定点、定向连接形成特定结构的多聚蛋白体;将靶抗原与各种纳米颗粒偶联制备多价纳米疫苗,以期研制“精确、微量、纯化、安全、高效”的新概念疫苗,建立新概念疫苗免疫评价技术体系,实现动物疫苗的更新换代,构建新型疫苗防控技术体系,为我国动物疫病防控提供新的技术支撑.
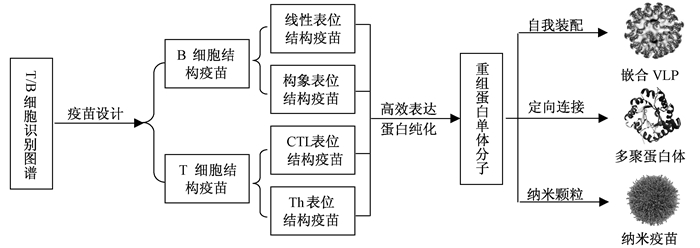
|
图 2 新概念疫苗研制策略 Figure 2 New concept of vaccine development strategy |
| [1] |
张改平. 新概念疫苗研究[C]//中国畜牧兽医学会学术年会. 广州, 2014: 5.
(  0) 0) |
| [2] |
张改平. 我国动物疫病防控的问题与新概念疫苗研究[C]//第三届中国兽医临床大会. 兰州, 2012: 3-6.
(  0) 0) |
| [3] |
LEVINE M M, LAGOS R, ESPARZA J. New generation vaccines[M]. 4th ed. Boca Raton: CRC press, 2010.
(  0) 0) |
| [4] |
PLOTKIN S A. Vaccines: the fourth century[J]. Clinical & Vaccine Immunology Cvi, 2009, 16(16): 1709-1719. (  0) 0) |
| [5] |
SERRUTO D, RAPPUOLI R. Post-genomic vaccine development[J]. FEBS Lett, 2006, 580(12): 2985-2992. DOI:10.1016/j.febslet.2006.04.084 (  0) 0) |
| [6] |
KANAMPALLIWAR A, SONI R, GIRDHER A, et al. Reverse vaccinology: basics and applications[J]. Open vaccine journal, 2013, 4(6): 1-5. (  0) 0) |
| [7] |
SEIB K L, ZHAO X, RAPPUOLI R. Developing vaccines in the era of genomics: a decade of reverse vaccinology[J]. Clinical microbiology & infection the official publication of the European society of clinical microbiology & infectious diseases, 2012, 18(s5): 109-116. (  0) 0) |
| [8] |
DORMITZER P R, ULMER J B, RAPPUOLI R. Structure-based antigen design: a strategy for next generation vaccines[J]. Trends in biotechnology, 2008, 26(12): 659-667. DOI:10.1016/j.tibtech.2008.08.002 (  0) 0) |
| [9] |
JARDINE J, JULIEN J P, MENIS S, et al. Rational HIV immunogen design to target specific germline B cell receptors[J]. Science, 2013, 340(6133): 711-716. DOI:10.1126/science.1234150 (  0) 0) |
| [10] |
MCGUIRE A T, DREYER A M, CARBONETTI S, et al. Antigen modification regulates competition of broad and narrow neutralizing HIV antibodies[J]. Science, 2014, 346(6215): 1380-1383. DOI:10.1126/science.1259206 (  0) 0) |
| [11] |
NUCCITELLI A, COZZI R, GOURLAY L J, et al. Structure-based approach to rationally design a chimeric protein for an effective vaccine against group B Streptococcus infections[J]. Proceedings of the national academy of sciences of the United States of America, 2011, 108(25): 10278-10283. DOI:10.1073/pnas.1106590108 (  0) 0) |
| [12] |
KANEKIYO M, WEI C J, YASSINE H M, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1N1 antibodies[J]. Nature, 2013, 499(7456): 102-106. DOI:10.1038/nature12202 (  0) 0) |
| [13] |
CORREIA B E, BATES J T, LOOMIS R J, et al. Proof of principle for epitope-focused vaccine design[J]. Nature, 2014, 507(7491): 201-206. DOI:10.1038/nature12966 (  0) 0) |
| [14] |
LIU H, MOYNIHAN K D, ZHENG Y, et al. Structure-based programming of lymph-node targeting in molecular vaccines[J]. Nature, 2014, 507(7493): 519-522. DOI:10.1038/nature12978 (  0) 0) |
| [15] |
RAPPUOLI R, PIZZA M, DEL G G, et al. Vaccines, new opportunities for a new society[J]. Proceedings of the national academy of sciences of the United States of America, 2014, 111(34): 12288-12293. DOI:10.1073/pnas.1402981111 (  0) 0) |
| [16] |
WANG X N, ZHANG G P, ZHOU J Y, et al. Identification of neutralizing epitopes on the VP2 protein of infectious bursal disease virus by phage-displayed heptapeptide library screening and synthetic peptide mapping[J]. Viral immunology, 2005, 18(3): 549-557. DOI:10.1089/vim.2005.18.549 (  0) 0) |
| [17] |
宋幸辉, 王睿, 王选年, 等. 传染性法氏囊病毒VP2蛋白抗原表位多肽P22的免疫原性及生物学功能鉴定[J]. 畜牧兽医学报, 2011, 42(5): 692-697. (  0) 0) |
| [18] |
张改平, 王选年, 赵东, 等. 鸡IBDV VP3蛋白B细胞抗原表位Ⅱ: CN, ZL200510017450. 2[P]. 2007-10-10.
(  0) 0) |
| [19] |
王选年, 张改平, 李培庆, 等. 鸡IBDV VP2蛋白中和性B细胞抗原表位Ⅱ及其应用: CN, ZL200510017453. 6[P]. 2007-5-9.
(  0) 0) |
| [20] |
王选年, 张改平, 王三虎, 等. 鸡IBDV VP3蛋白B细胞抗原表位Ⅰ: CN, ZL200510017452. 1[P]. 2008-11-12.
(  0) 0) |
| [21] |
王选年, 张改平, 李培庆, 等. 鸡IBDV VP2蛋白中和性B细胞抗原表位Ⅲ及其应用: CN, ZL200710096250. X[P]. 2010-8-25.
(  0) 0) |
| [22] |
JIANG D, LIU Y, WANG A, et al. High level soluble expression and one-step purification of IBDV VP2 protein in Escherichia coli[J]. Biotechnology letters, 2016, 38(6): 901-908. DOI:10.1007/s10529-016-2073-8 (  0) 0) |
 2017, Vol. 49
2017, Vol. 49

