2. 青海省青藏高原药用动植物资源重点实验室 青海 西宁 810016
2. The Key Laboratory of Medicinal Plant and Animal Resources of Qinghai-Tibetan Plateau in Qinghai Province, Xining 810016, China
陈皮是芸香科植物橘及栽培变种柑橘的干燥成熟果皮,在我国作为主要功能药用类和其他功能食品类药材同源配伍应用的药物,临床可用于治疗胸腹胀满、痰多、咳嗽、恶心厌食等症状[1-3]。研究表明,陈皮中含有多种天然活性化学成分,主要有黄酮类化合物、挥发油、多糖、生物碱和多种人体必需的微量元素等[4-6]。陈皮中的黄酮类化合物主要有橙皮苷、橘皮素、新橙皮苷以及川陈皮素等。药理学最新研究表明陈皮中的黄酮类化合物既有增强抗血管脆性、抗病毒、预防心血管疾病的作用,也是天然陈皮的主要生物学活性成分来源[7-10],因此对陈皮中黄酮类有效成分的提取工艺进行优化可为陈皮进一步开发利用提供有效的理论依据。
目前陈皮黄酮类化合物的提取工艺主要有溶剂回流提取[11]、超声波提取[12]、微波辅助提取等[13]。虽然超声波、微波萃取技术具有时间短、节省试剂和污染小等优点,但因为操作不便、实验成本高、不能用于大规模提取,因而应用不广泛,所以溶剂回流提取仍是目前最广泛有效的方法,它利用相似相溶原理,选用一种能够对所提取的有效成分溶解最大的溶剂,并同时尽可能减少其他杂质成分的溶出。本文采用索氏提取法提取陈皮中的黄酮类有效成分,探讨其粉碎粒度、液料比、提取时间和乙醇体积分数等单因素实验,运用响应面设计优化实验,选择陈皮有效成分的最佳提取工艺,并用气相色谱-质谱联用技术[14]测定分析最优条件下得到的陈皮浸膏乙醚萃取物的化学成分。
1 实验部分 1.1 材料与试剂陈皮购于甘肃陇塬峰药业有限公司,芦丁(批号:DST181110,纯度≥98%)购于成都德思特生物科技公司,氢氧化钠、硝酸铝、亚硝酸钠、无水乙醇均为分析纯,购于天津市科密欧化学试剂公司。
1.2 仪器与设备本文仪器与设备使用TU-1950型双光束紫外可见分光光度计(北京普析通用仪器公司),TSQ 8000 Evo型三重四极杆气质联用仪(赛默飞世尔科技公司),BZ24/29型索氏提取器(天津市玻璃仪器厂),SHB-Ⅲ型循环水式多用真空泵(山东东易日盛仪器厂),ME20型电子天平(梅特勒-托利多仪器公司)。
1.3 实验方法 1.3.1 陈皮提取液的制备首先在60 ℃恒温干燥箱中恒温干燥陈皮,粉碎之后过100目筛,然后将称取的陈皮粉末用滤纸分装,放入索氏提取器中,按液料比20∶1(mL/g)的比例加入35%乙醇回流提取,提取结束后过滤分离,即得陈皮提取液。
1.3.2 陈皮总黄酮提取率的测定准确称取干燥至恒重的芦丁标准品10 mg,置于50 mL容量瓶中,加入60%的乙醇溶解稀释并定容,得到0.2 mg/mL浓度的芦丁标准储备液。分别精密移取0、1.00、2.00、3.00、4.00和5.00 mL的芦丁储备液于25 mL容量瓶中,采用硝酸铝显色法测定,以不加芦丁的空白溶液做对照,在508 nm波长处测定吸光度,以芦丁浓度c为横坐标,吸光度值A为纵坐标进行线性回归,得回归方程为A=0.001 2c+0.011 3,所用的线性相关系数为R2=0.999 2。每组进行三次平行对照试验,然后求平均值,将其代入线性回归方程,并计算陈皮样品中总黄酮提取率。
1.3.3 单因素实验以陈皮总黄酮吸光度为评价指标,探讨不同因素对陈皮总黄酮提取结果的影响。考察液料比分别为15∶1、20∶1、25∶1、30∶1、35∶1(g/mL)、粉碎粒度分别为40、60、80、100、120目,乙醇体积分数分别为10%、20%、30%、40%、50%,提取时间分别为1.0、1.5、2.0、2.5、3.0 h的单因素实验,每组实验重复三次,考察各因素对陈皮中总黄酮提取结果的影响,得到最佳单因素水平。
1.3.4 响应面优化实验以总黄酮提取率为响应值,在单因素实验基础上通过Box-Behnken模型的中心组和实验优化提取工艺,选取乙醇体积分数(A)、提取时间(B)、液料比(C)、粉碎粒度(D)四个因素,设定-1(低)、0(中)、1(高)三个水平,响应面优化试验设计方案见表 1。
|
|
表 1 响应面实验因素水平表 Tab. 1 Response surface test factor level table |
本文使用的毛细管色谱柱为TG-5MS(30×0.25 mm, 0.25 μm),载气(高纯氦气)为1 (mL/min)流量。280 ℃为进样口温度,升温过程中,60 ℃为初始温度,保持1 min,以10(℃/min)的速度升到180 ℃,保持20 min,再以20 (℃/min)的速度升到300 ℃,保持2 min。进样量为1 μL,分流进样,分流比为50∶1。质谱条件设置为:250 ℃为离子源温度,5 min为溶剂延迟时间,285 ℃为传输线温度,质谱扫描范围(m/z)为40~500。
1.4.2 定性分析方法将陈皮提取浸出液过滤后浓缩,合并浓缩液蒸干称重,得到陈皮提取浸膏,再将浸膏加水混悬后用乙醚萃取,制得乙醚萃取物,利用本文的GC-MS条件对乙醚萃取物的化学成分进行研究,通过峰面积归一化法计算各成分的相对含量。
2 结果与讨论 2.1 单因素试验结果不同液料比、乙醇体积分数、提取时间及粉碎粒度对陈皮总黄酮提取结果的影响见图 1。

|
图 1 单因素实验结果图 Fig. 1 Diagram of single-factor experimental results |
从图 1看出,当液料比为20∶1(mL/g)时,提取液吸光度值达到最高,选择液料比为20∶1(mL/g)为宜。当乙醇体积分数为30%时,吸光度值最高,表明选择乙醇体积分数30%最为合理。提取时间在1.0、1.5、2.0和2.5 h的范围内,溶液吸光度值逐渐呈上升趋势,在2.5 h达到最大值。所以最佳提取时间选择2.5 h。当陈皮粉碎粒度为100目时,吸光度值达到最大值,因此选择粉碎粒度100目为宜。
2.2 响应面优化实验及方差分析在单因素试验基础上,以乙醇体积分数(A),提取时间(B),液料比(C)和粉碎粒度(D)四个因素为变量,陈皮总黄酮提取率Y为响应值,设计一组共计29次的BBD响应面分析,试验结果如表 2所示,方差分析结果如表 3所示。
|
|
表 2 响应面实验设计及结果 Tab. 2 Response surface experimental design and results |
|
|
表 3 回归模型的方差分析结果 Tab. 3 Regression model analysis of variance results |
从表 3得出,该回归模型整体达到极显著水平(P<0.000 1<0.01),模型相关系数R2=0.983 6,说明本文拟合程度较好,同时也说明响应值和自变量之间的关系显著。模型失拟项P>0.05,不显著,表明实验提取率的实测值与预测值接近,两者之间不存在显著失拟,模型调整复相关系数Radj2=0.967 1,说明96.71%响应值变化能够被该模型解释。变异系数(C.V.%)为4.06,说明模型精密度高,实验可靠性好。分析结果显示,A、C、AC、BC、CD、A2、B2、C2、D2项极显著,AB、BD项较显著,说明料液比和乙醇体积分数及二者之间的交互影响显著(P<0.01)。由表 2可知各因素对陈皮总黄酮提取率的影响程度大小次序为C>A>D>B,即液料比>乙醇体积分数>粉碎粒度>提取时间。采用Design Expert 8.0进行二次回归分析,得到陈皮总黄酮提取率Y的二次多项回归方程为
| $ \begin{aligned} & Y=17.19+8.95 \times 10^{-3} A+0.13 B+0.46 C+0.07 D+ \\ & 2.17 \times 10^{-4} A B+5.5 \times 10^{-3} A C+5.0 \times 10^{-4} A D-7.83 \times \\ & 10^{-4} B C+1.21 \times 10^{-4} B D-1.33 \times 10^{-3} \mathrm{CD}-2.15 \times 10^{-3} A^2- \\ & 4.05 \times 10^{-4} B^2-8.6 \times 10^{-3} C^2-4.06 \times 10^{-4} D^2 。\end{aligned} $ |
对表 3数据应用Design-Expert 8.0进行二次回归拟合,可得到变量之间相互作用的三维等高线响应曲面图,如图 2所示。
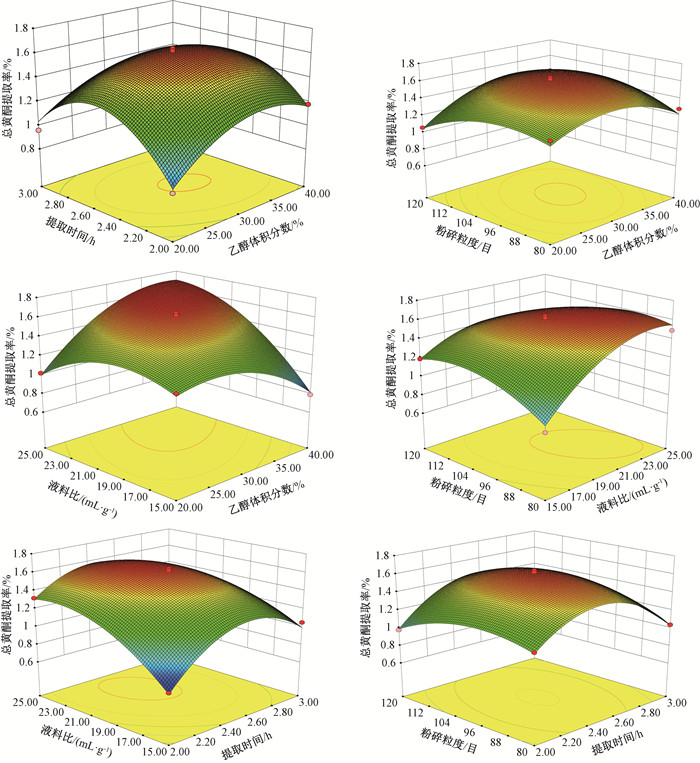
|
图 2 各因素交互作用的响应曲面图 Fig. 2 Response surface plot of interaction of various factor |
从图 2看出,当液料比固定在20 (mL/g),粉碎粒度固定在100目时,乙醇体积分数和提取时间的交互作用响应曲面弯曲度大,等高线为椭圆,说明交互影响作用显著,与方差分析结果吻合。当乙醇体积分数固定在30%,提取时间固定在2.5 h时,液料比和粉碎粒度的交互作用响应曲面弯曲度较大,等高线呈椭圆,两者交互作用较显著,符合方差分析结果。当提取时间在2.0~2.5 h,粉碎粒度的范围在80~100目时,观察到总黄酮提取率显著降低,粉碎粒度与提取时间的交互作用响应曲面弯曲度不大,等高线为圆形,表明交互作用不显著,与方差分析结果一致。
2.4 回归模型验证采用Design-Expert 8.0软件的岭脊分析对提取工艺条件进行优化,得到陈皮总黄酮的最佳提取条件:乙醇体积分数为33.94%,提取时间为2.37 h,液料比为21.97∶1 (mL/g),粉碎粒度为96.63目,陈皮总黄酮的提取率为1.68%。为方便实际操作,调整提取工艺中乙醇体积分数为35%,提取时间为2.5 h,液料比为20∶1 (mL/g),粉碎粒度为100目。采用上述调整过的最佳工艺条件提取三次,测得平均实际提取率为1.65%,与预测值1.68%接近,相对误差为1.82%,拟合率为99%,说明此提取工艺可行。
2.5 陈皮乙醚萃取物的GC-MS分析提取陈皮中的黄酮类有效成分三次,合并三次提取液,减压浓缩得到浸膏,浸膏干燥后最终得干物质20.10 g,将所得浸膏加适量水成混悬液,用乙醚萃取,即得乙醚萃取物。取乙醚萃取液0.1 μL进样,并用GC-MS分离鉴定其化学组成,如图 3所示,得到陈皮乙醚萃取物的总离子流色谱图(见图 3),对各峰进行色谱扫描后得到质谱图,通过质谱图库和Xcalibur工作站对分离出的化合物进行质谱分析并确定化合物的结构,再通过峰面积归一化法计算各成分的相对含量,结果如表 4所示。

|
图 3 陈皮乙醚萃取物的总离子流色谱图 Fig. 3 Total ion flow chromatogram of ether extract of tangerine peel |
|
|
表 4 萃取物挥发性成分分析及其相对百分含量 Tab. 4 Analysis of volatile components and relative percentage of ether extract from tangerine peel |
响应面设计对实验的各个水平可以进行连续分析,并通过中心组实验研究几种实验间的交互作用,从而获得高精密度的回归方程。比传统的正交实验设计次数少、但精度高,得到的回归方程可确定在实验范围内的任何试验点的预测值,是用于优化工艺条件的首选方法。本研究在优化得到的陈皮乙醚萃取物经GC-MS分析后,鉴定出多甲氧基黄酮类化合物是含量最多的组成成分。多甲氧基黄酮化合物因具有良好的开发天然抗癌药物或功能食品的价值,在人类抗炎剂、抗诱变剂和抗氧化剂等方面有很好的市场前景,可开发成食品添加剂、药品和保健品等。本研究可为提取中草药得到食品添加剂提供参考。
| [1] |
李柯柯, 任顺成. 陈皮中黄酮类化合物的研究进展[J]. 食品研究与开发, 2017, 38(17): 221-224. LI K K, REN S C. The development of flavonoids in dried orange peel[J]. Food research and development, 2017, 38(17): 221-224. DOI:10.3969/j.issn.1005-6521.2017.17.050 (  0) 0) |
| [2] |
LIU M, XIAO W Z, ZHANG H, et al. Quality control strategies of medicine food homology materials based on fingerprint profiling and chemometrics: citri reticulata pericarpium as an example[J]. Spectrochimica acta part A, molecular and biomolecular spectroscopy, 2023, 286: 121968. DOI:10.1016/j.saa.2022.121968 (  0) 0) |
| [3] |
FU M Q, XU Y J, CHEN Y L, et al. Evaluation of bioactive flavonoids and antioxidant activity in pericarpium citri reticulatae (Citrus reticulata 'Chachi') during storage[J]. Food chemistry, 2017, 230: 649-656. DOI:10.1016/j.foodchem.2017.03.098 (  0) 0) |
| [4] |
高蓓. 广陈皮黄酮类化合物和挥发油成分及其活性研究[D]. 武汉: 华中农业大学, 2011. GAO B. Studies on flavoids and essential oils and biological activities of flavoids and essential oils in PCR[D]. Wuhan: Huazhong Agricultural University, 2011. (  0) 0) |
| [5] |
ZHANG R J, CHEN J, MAO L Z, et al. Nobiletin triggers reactive oxygen species-mediated pyroptosis through regulating autophagy in ovarian cancer cells[J]. Journal of agricultural and food chemistry, 2020, 68(5): 1326-1336. DOI:10.1021/acs.jafc.9b07908 (  0) 0) |
| [6] |
SU D X, LIU H S, QI X Y, et al. Citrus peel flavonoids improve lipid metabolism by inhibiting miR-33 and miR-122 expression in HepG2 cells[J]. Bioscience, biotechnology, and biochemistry, 2019, 83(9): 1747-1755. DOI:10.1080/09168451.2019.1608807 (  0) 0) |
| [7] |
GOYAL L, KAUSHAL S. Evaluation of chemical composition and antioxidant potential of essential oil from Citrus reticulata fruit peels[J]. Advances in research, 2018, 15(2): 1-9. (  0) 0) |
| [8] |
MA W Z, FENG S L, YAO X J, et al. Nobiletin enhances the efficacy of chemotherapeutic agents in ABCB1 overexpression cancer cells[J]. Scientific reports, 2015, 5: 18789. DOI:10.1038/srep18789 (  0) 0) |
| [9] |
ZOU J M, WANG J J, YE W L, et al. Citri Reticulatae Pericarpium (Chenpi): a multi-efficacy pericarp in treating cardiovascular diseases[J]. Biomedicine & pharmacotherapy, 2022, 154: 113626. (  0) 0) |
| [10] |
罗琥捷, 杨宜婷, 黄寿根, 等. 超声提取法与索氏提取法提取陈皮黄酮类有效成分的分析比较[J]. 中药材, 2016, 39(2): 371-374. LUO H J, YANG Y T, HUANG S G, et al. Analysis and comparison of effective flavonoids from pericarpium citri Tangerinae by ultrasonic extraction and soxhlet extraction[J]. Journal of Chinese medicinal materials, 2016, 39(2): 371-374. (  0) 0) |
| [11] |
周兴鹏, 张敬铖, 樊龙星, 等. 超声提取陈皮功效成分的工艺研究[J]. 中国调味品, 2019, 44(1): 1-4. ZHOU X P, ZHANG J C, FAN L X, et al. Study on the technology of ultrasonic extraction of the functional components of tangerine peel[J]. China condiment, 2019, 44(1): 1-4. (  0) 0) |
| [12] |
张婷婷, 梁燕, 彭灿. 不同方法提取陈皮中黄酮类有效成分含量比较[J]. 中国药业, 2021, 30(13): 40-43. ZHANG T T, LIANG Y, PENG C. Comparison of flavonoids content in pericarpium citri reticulatae extracted by different methods[J]. China pharmaceuticals, 2021, 30(13): 40-43. (  0) 0) |
| [13] |
许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析[J]. 中草药, 2018, 49(1): 35-44. XU S S, XU J, ZHANG X M, et al. Research progress on citri reticulatae pericarpium, aurantii fructus immaturus, and aurantii fructus and Q-marker predictive analysis[J]. Chinese traditional and herbal drugs, 2018, 49(1): 35-44. (  0) 0) |
| [14] |
王少敏, 牛颖, 代敏, 等. 顶空-气相色谱-质谱法同时测定7种甲磺酸酯类杂质[J]. 郑州大学学报(理学版), 2019, 51(3): 104-108. WANG S M, NIU Y, DAI M, et al. Simultaneous determination of seven methanesulfonate impurities by headspace-GC-MS[J]. Journal of Zhengzhou university (natural science edition), 2019, 51(3): 104-108. (  0) 0) |
 2024, Vol. 56
2024, Vol. 56

