CD47,又名整合素相关蛋白(integrin associated protein,IAP),是一种广泛表达的抗原.CD47为跨膜糖蛋白, 几乎在所有组织不同细胞表面表达,属于免疫球蛋白超家族成员.在不同物种间,CD47相当保守,大鼠、小鼠、牛和人的CD47蛋白中60%~70%的氨基酸序列都是相同的[1].目前研究CD47的免疫调控机制及其在肿瘤的免疫监视中的功能多采用CD47单克隆抗体,用CD47抗体来抑制或阻断细胞表面CD47抗原与其配体的结合,从而阐明CD47在病理和生理中的作用机理[2].为了进一步探索研究CD47信号通路在免疫调控及肿瘤免疫监视中的分子机制,有必要表达纯化CD47,通过CD47融合蛋白发挥“占位”作用,深入探索CD47的分子机制.我们构建了一个带有CD47-Fc基因的真核表达载体pcDNA3.1 (-)-CD47-Fc,它可以在293T细胞中表达CD47-Fc融合蛋白,纯化后的CD47-Fc可以结合SIRPα,为进一步研究CD47体内外分子机制以及肿瘤、自身性免疫疾病等相关疾病的治疗奠定了基础.
1 材料和方法 1.1 材料 1.1.1 质粒、菌株和细胞质粒pcDNA3.1(-)由本实验室保存;大肠杆菌(E.coli)DH5α购自康为生物(北京)公司;293T细胞株为本室液氮保存.
1.1.2 实验动物选择野生型BALB/c纯系小鼠5只,雌性,6~8周龄,体重18~20 g,购于河南省实验动物中心,饲养于本实验室SPF级动物室.
1.1.3 主要试剂Pfu酶、限制性内切酶BamHⅠ、XhoⅠ、EcoR1和T4 DNA连接酶购自NEB(北京);DNA回收试剂盒和质粒提取试剂盒购自生工生物(上海)公司;DNA、蛋白Marker、琼脂糖等常用分子生物学试剂购自康为生物(北京)公司;辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔IgG抗体、兔IgG1抗体购自博士德生物(武汉)公司;ECL化学发光检测试剂盒购自Sigma(美国);血清及培养基购自生工生物(上海)公司;引物或基因由金维智生物(北京)公司合成.亲和层析柱料购自GE Healthcare(美国).
1.2 方法 1.2.1 表达载体pcDNA3.1(-)-CD47-Fc的构建及鉴定从NCBI数据库中查到家兔IgG1重链基因序列(登陆号:K00752.1),委托金维智生物(北京)公司合成兔IgG1重链基因部分序列(编码氨基酸175~402).以合成DNA序列为模板,序列Fc-For:TTTGGATCCGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGTG GCGGATCC;Fc-Rev:AACTAAGCTTTCATTTACCCGGAGAGCG为引物,通过PCR扩增目的基因;然后分别用BamH1和Hind Ⅲ对PCR产物和载体pcDNA3.1(-)进行双酶切,用T4连接酶连接产物;转化至大肠杆菌DH5α菌株,涂平板、筛选阳性克隆;随后提质粒、BamH1和Hind Ⅲ双酶切验证,阳性质粒测序,保存测序正确的pcDNA3.1(-)-Fc质粒和菌种.提取BALB/c小鼠脾脏RNA,经逆转录得到cDNA文库,使用引物CD47-For和CD47-Rev.
CD47-For:ATCTCTCGAGATGTGGCCCTTGGCGGCG,CD47-Rev:AATCTGGATCCCGTGCGGTTTTTCAGCTC.
通过PCR扩增CD47基因.以pcDNA3.1(-)-Fc为载体构建质粒pcDNA3.1(-)-CD47-Fc,构建方法同上.保存测序正确的质粒和菌种.上述所有引物中下划线序列皆为酶切位点.
1.2.2 CD47-Fc融合蛋白的表达和纯化用含90%DMEM、双抗和10%FBS的完全培养基,在5%CO2的37 ℃温箱中培养293T细胞.待细胞铺满培养皿约60%~70%的时候,将阳性pcDNA3.1(-)-CD47-Fc质粒通过磷酸钙法转染293T细胞.磷酸钙转染48小时后,每隔一天收集培养基一次,共计收集4次.然后离心,收集上清用0.22 μm膜过滤,使用HiTrap Protein A HP纯化柱纯化目标蛋白(纯化步骤按说明书进行),通过SDS-PAGE和Western Blotting检测蛋白纯化结果.
1.2.3 细胞黏附分析纯化的CD47-Fc(终浓度5 μg/mL)或BSA(5%)使用HBSS稀释,通过4 ℃过夜孵育固定在96孔ELISA板上.用含10%正常马血清的HBSS溶液室温孵育1小时封闭非特应性结合位点,然后每孔加入1×106个BALB/c小鼠腹腔巨噬细胞(腹腔巨噬细胞分离方法参见文献[3])室温孵育30 min.孵育结束后,每孔用HBSS轻轻洗3次,除去未结合的细胞.然后在显微镜下分析巨噬细胞与CD47-Fc或BSA结合状况.
1.2.4 细胞标记、荧光显微镜及流式分析小鼠腹腔巨噬细胞用含5%正常山羊血清的HBSS溶液冰浴封闭1小时,然后用纯化的CD47-Fc(终浓度5 mg/mL)冰浴孵育30 min并标记细胞表面的SIRPα蛋白.孵育结束后用4 ℃预冷的HBSS溶液轻轻润洗3次,用FITC标记的羊抗兔二抗冰浴孵育30 min,标记CD47-Fc融合蛋白.孵育结束后用4 ℃预冷的HBSS溶液轻轻润洗3次,然后通过荧光显微镜或流式细胞仪分析标记结果.使用兔IgG1抗体作为阴性对照.
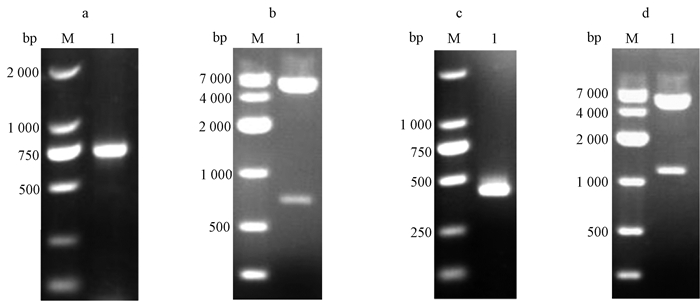
2 结果与分析 2.1 鼠CD47真核表达载体pcDNA3.1(-)-CD47-Fc构建与鉴定从NCBI数据库下载委托公司化学合成家兔IgG1编码氨基酸175~402的部分Fc DNA序列.为了构建pcDNA3.1(-)-Fc重组质粒,首先通过PCR扩增Fc DNA序列.PCR反应产物经琼脂糖凝胶电泳分析后,结果显示扩增条带大小为750 bp左右,与预期理论值相符(图 1).质粒pcDNA3.1(-)、切胶回收纯化的Fc DNA经BamH1和Hind Ⅱ酶切、T4连接酶处理后形成重组载体pcDNA3.1(-)-Fc,反应混合物转化感受态细胞DH5α,氨苄青霉素抗性筛选后挑取阳性单克隆,扩大培养后提取质粒进行酶切,电泳结果显示酶切产物大小与理论值相符(图 1).测序鉴定酶切阳性质粒,序列比对结果显示与数据库一致,说明质粒pcDNA3.1(-)-Fc正确构建.接下来PCR扩增CD47 DNA序列,PCR产物电泳分析,显示条带大小为470 bp左右,与理论值相符(图 1).质粒pcDNA3.1(-)-Fc、纯化PCR产物经酶切、T4连接酶处理后形成pcDNA3.1(-)-CD47-Fc重组载体,载体转化感受态细胞DH5α,氨苄青霉素抗性筛选后挑取阳性单克隆,提取质粒进行酶切,电泳结果显示酶切产物大小与理论值相符(图 1).测序鉴定酶切阳性质粒,序列比对显示结果与数据库一致,确定质粒pcDNA3.1(-)-CD47-Fc构建正确.
|
图 1 构建质粒pcDNA3.1(-)-CD47-Fc Figure 1 Construction of plasmid pcDNA3.1(-)-CD47-Fc a)兔IgG1 Fc基因的PCR扩增;M:DNA marker,1:PCR扩增兔IgG1 Fc基因b)质粒pcDNA3.1(-)-Fc经BamH1、Hind Ⅲ双酶切电泳图;M:DNA marker,1:质粒双酶切c) PCR扩增兔小鼠CD47基因;M:DNA marker,1:PCR扩增小鼠CD47基因d)质粒pcDNA3.1(-)-CD47-Fc经XhoⅠ、Hind Ⅲ双酶切电泳图;M:DNA marker,1:质粒双酶切 |
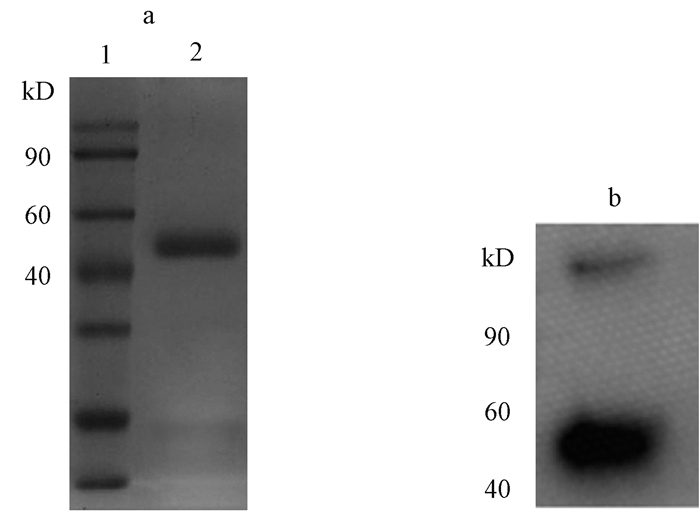
培养293T细胞,待细胞铺满培养皿约60%~70%的时候,将阳性pcDNA3.1(-)-CD47-Fc质粒通过磷酸钙法转染293T细胞.质粒转染48 h后,每隔一天收集培养基一次,共计收集4次.然后离心收集上清用0.22 μm膜过滤,使用HiTrap Protein A HP亲和层析柱纯化目标蛋白,通过SDS-PAGE检测融合蛋白纯化结果,结果显示融合蛋白分子量为45 kD,与预期值相符(见图 2).同时通过Western Blotting鉴定兔Fc,结果证实鼠CD47-Fc融合蛋白成功表达(见图 2).
|
图 2 分析检测纯化的CD47-Fc蛋白 Figure 2 Analysis and detection of purified CD47-Fc protein a) SDS-PAGE检测纯化的CD47-Fc蛋白b) Western Blotting检测CD47-Fc蛋白 |
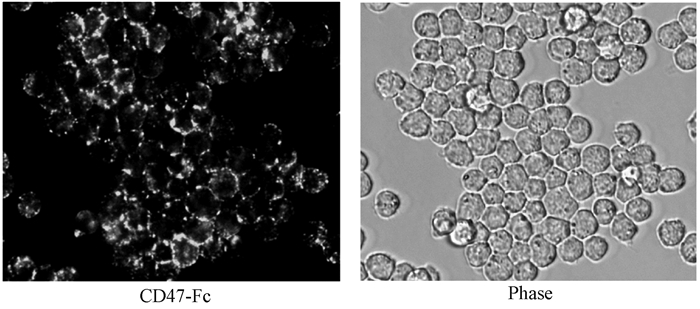
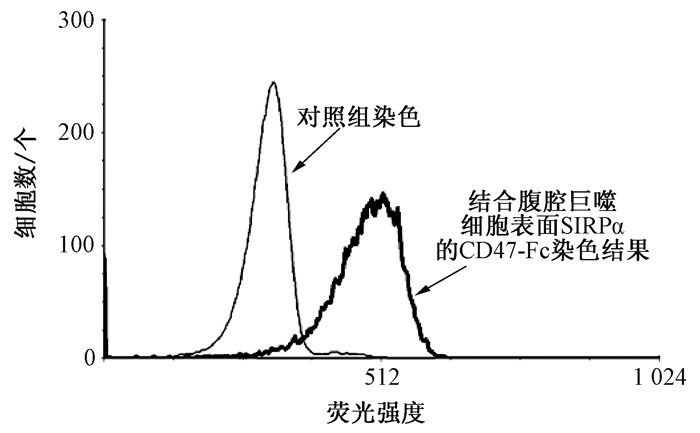
大量研究已证实CD47蛋白的配体为SIRPα,而巨噬细胞高表达SIRPα蛋白.要想分析纯化的CD47融合蛋白活性,可通过CD47与巨噬细胞表面表达的SIRPα是否相互作用来检测.分离的小鼠腹腔巨噬细胞用5%血清冰浴封闭,然后用纯化的CD47-Fc(终浓度5 mg/mL)融合蛋白冰育标记细胞表面的SIRPα蛋白.随后用PBS润洗除去未结合的CD47-Fc,用FITC标记的羊抗兔二抗冰育标记CD47-Fc.孵育结束后轻轻润洗除去未结合的荧光二抗,然后通过荧光显微镜或流式细胞仪分析标记结果.使用兔IgG1抗体作为一抗标记的腹腔巨噬细胞做阴性对照.荧光显微镜和流式细胞仪都显示:CD47-Fc可以标记腹腔巨噬细胞(见图 3、图 4),而作为对照的兔IgG1蛋白则不结合腹腔巨噬细胞.这些结果说明纯化的CD47-Fc活性较高.
|
图 3 标记腹腔巨噬细胞表面SIRPα用CD47-Fc融合蛋白 Figure 3 Label SIRPα of peritoneal macrophage cells by CD47-Fc fusion protein |
|
图 4 用CD47-Fc标记腹腔巨噬细胞SIRPα的流式分析结果 Figure 4 Flow cytometry analysis of SIRPα on the surface of peritoneal macrophages by CD47-Fc fusion protein |
纯化的CD47-Fc用HBSS稀释至终浓度5 μg/mL,通过4 ℃过夜孵育固定在96孔ELISA板上.用含10%正常马血清HBSS溶液室温孵育1小时,封闭ELISA板上非特应性位点,然后每孔加入1×106个纯化的小鼠腹腔巨噬细胞,室温孵育30分钟.孵育结束后,每孔用HBSS轻轻洗3次除去未结合的细胞.用固定的兔IgG1抗体作为阴性对照.然后在显微镜下分析腹腔巨噬细胞与CD47-Fc或兔IgG1结合状况.镜下观察,显示大量腹腔巨噬细胞与固定的CD47-Fc蛋白相结合,而作为对照的兔IgG1蛋白则几乎没有腹腔巨噬细胞与之结合.已证实腹腔巨噬细胞高表达CD47蛋白的配体SIRPα.大量腹腔巨噬细胞与固相CD47-Fc蛋白相结合,不结合兔IgG1蛋白进一步说明纯化的CD47-Fc活性较高.
3 讨论近年来CD47作为自体识别作用中的关键分子——“细胞免死”标志而引起重视.研究还证实CD47蛋白涉及多种临床疾病.在多种恶性肿瘤中,CD47蛋白皆呈现高表达与SIRPα结合,产生抑制信号使肿瘤细胞逃避免疫细胞吞噬杀伤.研究还发现肿瘤细胞表面CD47蛋白表达水平与疾病预后成负相关.因此,CD47成为肿瘤靶向治疗的一个新靶点[4].已有报道以CD47作为靶点,通过制备CD47的单克隆抗体来阻断或抑制CD47与SIRPα相互作用,可以治疗肿瘤[5-6].但人源化抗体制备耗时较长,成本较高.本文尝试表达CD47融合蛋白, 为进一步研究移植、自身免疫性疾病治和肿瘤等相关疾病奠定基础.因CD47胞外区IgV结构域含有二硫键,在大肠杆菌系统中表达CD47易形成包涵体发生降解.通过与Trx标签融合,Lin等在大肠杆菌中成功表达出CD47融合蛋白[7].但大肠杆菌表达融合蛋白常含有内毒素,限制了CD47的应用.因此,大多数研究采用真核细胞表达CD47,并用Fc作为融合标签,不仅方便纯化,而且有利于提高CD47-Fc融合蛋白在体内的半衰期.经研究,本文采用真核表达系统HEK293T细胞表达鼠CD47胞外区.HEK293T细胞转染效率非常高,可通过瞬转质粒,实现外源蛋白的高表达,不需要筛选稳定表达细胞株,节约了时间.HEK293T细胞表达鼠CD47-Fc后,通过亲和层析纯化得到了纯度较高的CD47-Fc融合蛋白.进一步通过免疫荧光染色、流式细胞技术和细胞黏附实验,检测融合蛋白CD47-Fc的生物学活性.结果显示,所制备的融合蛋白CD47-Fc具有较高的生物学活性,可与SIRPα很好地相互作用,为进一步研究CD47的生物学功能以及肿瘤等相关疾病奠定了基础.
| [1] |
BROWN E J, FRAZIER W A. Integrin-associated protein (CD47) and its ligands[J]. Trends Cell Biol, 2001, 11(3): 130-135. DOI:10.1016/S0962-8924(00)01906-1 (  0) 0) |
| [2] |
MURATA Y, KOTANI T, OHNISHI H, et al. The CD47-SIRPalpha signalling system: its physiological roles and therapeutic application[J]. J Biochem, 2014, 155(6): 335-344. DOI:10.1093/jb/mvu017 (  0) 0) |
| [3] |
范仕郡, 刘鑫, 黄敏, 等. 小鼠腹腔巨噬细胞的快速提取及培养[J]. 局解手术学杂志, 2015, 24(2): 130-131. DOI:10.11659/jjssx.11E014005 (  0) 0) |
| [4] |
SOTO-PANTOJA D R, STEIN E V, ROGERS N M, et al. Therapeutic opportunities for targeting the ubiquitous cell surface receptor CD47[J]. Expert Opin Ther Targets, 2013, 17(1): 89-103. DOI:10.1517/14728222.2013.733699 (  0) 0) |
| [5] |
WEISKOPF K. Cancer immunotherapy targeting the CD47/SIRPalpha axis[J]. European journal of cancer, 2017, 76: 100-109. DOI:10.1016/j.ejca.2017.02.013 (  0) 0) |
| [6] |
BRIGHTWELL R M, GRZANKOWSKI K S, LELE S, et al. The CD47 "don't eat me signal" is highly expressed in human ovarian cancer[J]. Gynecologic oncology, 2016, 143(2): 393-397. DOI:10.1016/j.ygyno.2016.08.325 (  0) 0) |
| [7] |
LIN Y, YAN X Q, YANG F, et al. Soluble extracellular domains of human SIRPα and CD47 expressed in Escherichia coli enhances the phagocytosis of leukemia cells by macrophages in vitro[J]. Protein expression and purification, 2012, 85(1): 109-116. (  0) 0) |
 2018, Vol. 50
2018, Vol. 50


