2. 北京大学 人民医院 北京 100045;
3. 郑州大学 物理工程学院 河南 郑州 450001
2. People's Hospital, Peking University, Beijing 100045, China;
3. School of Physical Engineering, Zhengzhou University, Zhengzhou 450001, China
表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)表征的是分子振动的信息,是以金属粗糙表面或金属纳米粒子作为基底对分子进行检测的一种光谱测量技术,在生物体系测量中能反映核酸、蛋白质、脂类等生物大分子的结构信息.SERS技术能使拉曼信号增强若干个数量级,并能在一定程度上减弱荧光背景, 所以非常适合对荧光背景很强的生物体系的检测.近几年SERS技术在检测肿瘤血清方面得到初步发展,利用SERS技术能够检测肿瘤血清中分子结构、构象的微小变化.因此,根据血清拉曼光谱的改变可以对恶性肿瘤进行早期筛查.
在血清SERS研究中,要获得高信噪比的SERS信号,对活性基底的研究至关重要.增强基底不同,对相同样品的SERS增强效果不同.基底的表面形貌、血清分子与纳米粒子的结合方式都会影响基底的活性[1-3].在所有的SERS活性基底中,金属溶胶制备简便、稳定性高,具有很高的SERS增强因子.因此,本文以金纳米溶胶、银纳米溶胶和金-银合金纳米溶胶作为血清SERS的增强基底,研究了不同金属纳米溶胶对血清SERS的增强效应,以期寻找到适合血清SERS检测的高活性增强基底,研究结果将对利用血清SERS早期诊断恶性肿瘤具有重要的意义.
1 实验部分 1.1 试剂和仪器实验所用氯金酸、硝酸银、枸橼酸钠均为分析纯,购于上海化学试剂有限公司.实验用水均为三次去离子水.硝酸银溶液置于暗处,氯金酸溶液置于冰箱冷藏.
紫外分光光度计(Hitachi UV-3900);透射电子显微镜(Hitachi H-600);拉曼共焦显微拉曼仪(法国HORIBA Jobin Yvon,LabRAM HR Evolution), 激发光源为氦-氖离子激光器,激发光波长为632.8 nm, 光谱分辨率≤0.4 cm-1,到达样品表面功率约为2 mW;电磁加热搅拌器(上海司乐仪器有限公司,B11-2);电子天平(艾德姆衡器有限公司,PGC753e).
1.2 实验方法 1.2.1 金属纳米溶胶的制备银纳米溶胶的制备采用文献[4]的方法,用枸橼酸钠还原硝酸银溶液得到.具体步骤如下:将装有200 mL质量浓度为1×10-4 g/mL的硝酸银溶液的烧杯放置到微波炉中加热至沸腾, 取出后缓慢滴入4 mL质量分数为1%的枸橼酸钠溶液, 并伴随剧烈地磁力搅拌,加热搅拌60 min后,停止加热,搅拌冷却至室温,得到银纳米溶胶.
金纳米溶胶的制备采用文献[5]的方法,用枸橼酸钠还原氯金酸溶液得到.具体步骤如下:将装有100 mL质量浓度为5×10-4 g/mL的氯金酸溶液的烧杯放置到微波炉中加热至沸腾,将2 mL质量分数为1%的枸橼酸钠溶液缓慢加入到沸腾的氯金酸溶液中,然后放在磁力搅拌器上继续加热搅拌40 min后,停止加热,使其自然冷却至室温,得到金纳米溶胶,放入4 ℃的冰箱里备用.
金-银合金纳米溶胶的制备采用文献[6]的方法,以枸橼酸钠为还原剂,将氯金酸和硝酸银的混合溶液与枸橼酸钠反应制成金-银合金纳米溶胶.具体步骤如下:将总浓度为0.5 mmol/L的硝酸银和氯金酸混合溶液100 mL(通过改变加入硝酸银和氯金酸溶液的体积比控制金的摩尔分数分别为0.5和0.7)在微波炉中加热至沸腾, 然后加入2 mL质量分数为1%的枸橼酸钠溶液,放在磁力搅拌器上保持沸腾60 min后搅拌至室温,得到的金-银合金纳米溶胶.
1.2.2 小鼠血清的制备在麻醉状态下抽取活体小鼠血液,不加抗凝剂,静置1 h后,以转速3 000 r/min离心10 min去除红细胞,取淡黄色上清液得到小鼠血清.
1.2.3 拉曼光谱的测量将制备的金属溶胶与样品血清按体积比1:1等量混合后放在样品池中, 激发光源为氦-氖激光器,波长为632.8 nm, 曝光时间10 s, 累加次数3次,采用180°背散射接收方式,400~1 800 cm-1范围内扫描.
2 结果与讨论 2.1 金属纳米溶胶的表征SERS是基于金属纳米粒子的表面等离子体共振现象, 在纳米级尺度上粒子粗糙表面的电磁场会得到极大增强.在SERS中,纳米粒子的形貌、尺寸大小和组成决定着纳米粒子的光学特性和SERS增强效应.
2.1.1 紫外光谱表征图 1为金属纳米溶胶的紫外-可见吸收光谱.根据紫外-可见吸收光谱的表面等离子体吸收峰(SPR)的位置和形状,可以判断纳米粒子的形状和粒径分布[7].从图 1中可以看出,银纳米溶胶的吸收峰在390 nm,吸收峰向长波方向展宽,表明银纳米粒子尺寸分布较宽,溶液中有不规则的粒子存在.金纳米溶胶紫外吸收光谱在520 nm处有1个吸收峰, 峰的宽度较宽,表明制得的金纳米颗粒的粒径不均匀.金-银合金纳米溶胶的紫外吸收光谱只有1个吸收峰,位于金纳米溶胶和银纳米溶胶的最大吸收峰之间,2种由不同金银比例制备的合金纳米粒子的SPR分别在480、502 nm处,表明合金纳米粒子的SPR具有可调性,随着金所占比例的增加,金-银合金纳米溶胶的离子共振吸收峰发生红移.因为合金纳米粒子的SPR具有可调性,所以可以通过调整金含量的比例改变SPR的频率,实现与不同频率激发光的耦合.
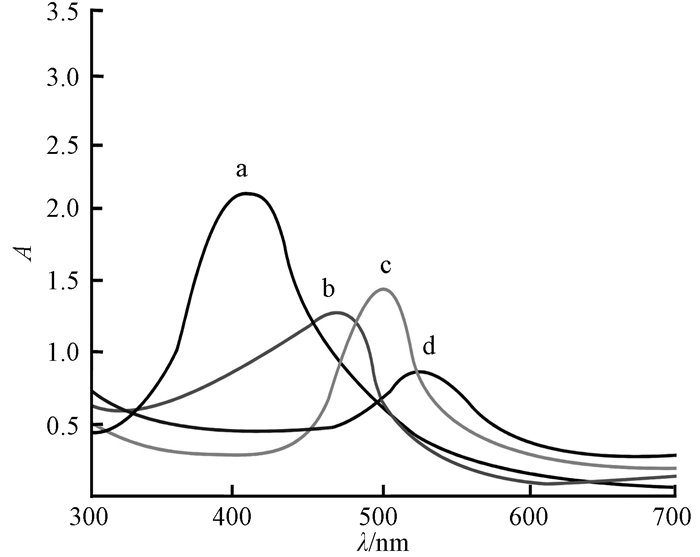
|
图 1 金属纳米溶胶的紫外-可见吸收光谱 Figure 1 UV-Vis absorption spectra of metal nano sols a:银纳米溶胶;b:金-银合金(金0.5)纳米溶胶;c:金-银合金(金0.7)纳米溶胶;d:金纳米溶胶 |
图 2为金属纳米溶胶的透射电镜(TEM)图.TEM结果显示,银纳米粒子(图 2a)的形状基本呈球形,有少量的棒状颗粒,粒径相差较大,出现直径为20~60 nm的不同粒径大小的颗粒.金-银合金纳米粒子(图 2b和图 2c)基本是球形结构,粒径约为40 nm,粒子大小比较均匀、分散性好,粒子之间存在着能增强SERS效应的“热点”.金纳米粒子(图 2d)呈球形,粒径20 nm左右,粒子大小不均匀、分散性不好,出现团聚现象,并且粒子之间缺少能提高SERS强度的“热点”,影响其SERS的增强效应.

|
图 2 金属纳米溶胶的透射电镜图 Figure 2 TEM images of metal nano sols a:银纳米溶胶;b:金-银合金(金0.5)纳米溶胶;c:金-银合金(金0.7)纳米溶胶;d:金纳米溶胶 |
所用的3种金属溶胶中,金纳米溶胶具有很好的生物兼容性,银纳米溶胶具有很高的稳定性,两种溶胶是SERS中常见的基底.金-银合金纳米溶胶的SPR有可调性,具有独特的光学性质,是近些年备受关注的基底.因为小鼠与人类有很多相近的基因,本实验采用正常小鼠的血清作为生物样品, 以金纳米胶、银纳米胶和金-银合金(金0.5)纳米溶胶为基底,测得小鼠血清的SERS,比较3种金属纳米溶胶对血清SERS的增强效果.图 3为小鼠血清的普通拉曼光谱和3种金属溶胶基底血清的SERS.
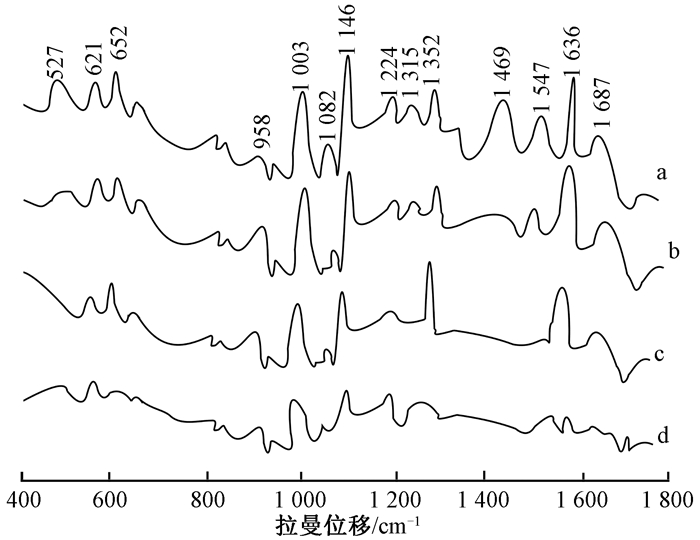
|
图 3 小鼠血清的普通拉曼光谱和表面增强拉曼光谱 Figure 3 Normal Raman spectra and surface-enhanced Raman spectra of mice serum a:金-银合金(金0.5)纳米溶胶;b:银纳米溶胶;c:金纳米溶胶;d:无基底 |
小鼠血清的SERS是由白蛋白和各类球蛋白质分子中肽键引起不同类型的特征振动、主链骨架C—C和C—N振动和侧链构象的振动,以及蛋白质空间二级结构中的α螺旋、β折叠和酰胺Ⅰ-Ⅶ等组成[8].从谱峰指认可知,621、1 015、1 146 cm-1是蛋白质结构主链骨架的振动峰.1 224、1 315、1 687 cm-1归属于血清蛋白酰胺键,属于蛋白质二级结构.1 003、1 636 cm-1是蛋白质的侧链苯丙氨酸的单基取代苯基环的贡献,在光谱中属于强峰.652、958、1 352、1 547 cm-1是酪氨酸和色氨酸的特征峰.在小鼠血清SERS中还包括少量糖类和脂类,其中527 cm-1是碳水化合物D-甘露醇的特征峰,1 469 cm-1属于脂类特征峰.
从图 3可以看出,以金-银合金纳米溶胶(图 3a)为基底的SERS谱峰在527、958、1 003、1 146、1 352、1 469 cm-1处信号增强明显,表明以金-银合金纳米溶胶为基底测得的血清SERS,不仅能够较准确地反映血清中蛋白质的结构,还能够获得血清中含量非常低的糖和脂类的信息.以银纳米溶胶(图 3b)为基底的SERS谱峰也有一定的增强,958、1 003、1 146、1 352、1 636 cm-1谱峰较强,但是在527 cm-1处只有一小峰,未见1 469 cm-1峰,说明以银纳米溶胶为基底的SERS可以用于血清蛋白质结构的主链、侧链和二级结构的测定,但是对脂类和糖的测定效果较差.以金纳米溶胶(图 3c)为基底的SERS谱峰也得到增强,但增强幅度较小.在1 003、1 146、1 352、1 636 cm-1处信号得到加强,但在1 224、1 315、1 687 cm-1处峰强较弱,527、1 469、1 547 cm-1峰消失,表明金纳米溶胶的SERS活性比银纳米溶胶差,可能是银纳米溶胶在可见光范围表面增强因子好于金纳米溶胶的缘故.
图 3显示所有金属纳米溶胶对血清SERS均有增强,但增强效果不同.金纳米溶胶对血清SERS的增强效果较弱,这是由于金纳米颗粒粒径较小,无法吸附血清分子而形成良好的单分子吸附层,所以产生的表面等离子体共振效应也较弱[1],此外,可能是由于金纳米粒子不均匀,出现团聚现象,影响SERS增强效果.银纳米溶胶对血清的增强效果比金纳米溶胶强,可能是由于激发光波长对银纳米溶胶比金纳米溶胶灵敏[2].金-银合金纳米溶胶对血清SERS的增强效果好于银纳米溶胶,主要峰都得到增强,这是因为金-银合金纳米溶胶粒径适中,血清分子吸附在其上能够形成较好的单分子吸附层,从而形成强烈的表面等离子共振.而银纳米颗粒粒径较大,虽然理论上能够吸附更多的血清分子,但同时粒子间斥力也会增大[3],所以表面等离子体共振效应比金-银合金纳米溶胶弱.金-银合金纳米溶胶既有金纳米溶胶生物兼容性好的特点,又有银纳米溶胶高稳定性的特点,从而使SERS得到最大的增强.因此,金-银合金纳米溶胶是检测小鼠血清比较理想的基底.
3 结论比较了金纳米溶胶、银纳米溶胶和金-银合金纳米溶胶对小鼠血清SERS的活性,结果表明,3种金属溶胶都具有一定的SERS增强效应.从透射电镜图可以看出,金-银合金纳米溶胶为球形结构,粒径约为40 nm,粒子大小均匀,存在能提高SERS强度的“热点”,极大地增强了合金纳米粒子的局域电磁场强度,SERS强度得到提高.银纳米溶胶的粒子大小约为50 nm,粒径分布不是很理想,纳米粒子之间的距离大于2 nm,所以能增强SERS光谱的“热点”不多.金纳米溶胶粒径在20 nm左右,有团聚现象出现,影响其SERS增强效应.以金-银纳米溶胶为基底测得的血清SERS,能够较准确地反映血清分子的微观结构.以银纳米溶胶为基底的血清SERS光谱可以用于血清蛋白质结构的主链、侧链和二级结构的测定,但是对脂类和糖的测定效果较差.以金纳米溶胶为基底的血清SERS峰强相对较弱,而且没有检测到脂类和糖.实验结果表明,金-银合金纳米溶胶的SERS活性最强,银纳米溶胶其次,金纳米溶胶最差.
| [1] |
BRUST M, WALKER M, BETHELL D, et al. Synthesis of thiol-derivatised gold nanoparticles in a two-phase liquid-liquid system[J]. J Chem Soc Chem Commun, 1994(7): 801-802. (  0) 0) |
| [2] |
高宇, 崔颜, 向娟, 等. 脱金属硫蛋白吸附在粗糙金表面的表面增强拉曼光谱[J]. 光散射学报, 2008, 20(2): 173-177. (  0) 0) |
| [3] |
WILIETS K A. Surface-enhanced Raman scattering (SERS) for probing internal cellular structure and dynamics[J]. Anal Bioanal Chem, 2009, 394(1): 85-94. DOI:10.1007/s00216-009-2682-3 (  0) 0) |
| [4] |
FLEISCHMANN M, HENDRA P J, MCQUILLAN A J. Raman spectra of pyridine adsorbed at a silver electrode[J]. Chem Phys Lett, 1974, 26(2): 163-166. DOI:10.1016/0009-2614(74)85388-1 (  0) 0) |
| [5] |
LEE P C, MEISEL D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J]. J Phys Chem, 1982, 86(17): 3391-3395. DOI:10.1021/j100214a025 (  0) 0) |
| [6] |
JANA N R, GEARHEART L, MURPHY C J, et al. Wet chemical synthesis of high aspect ratio cylindrical gold nanorods[J]. Phys Chem B, 2001, 105(19): 4065-4067. DOI:10.1021/jp0107964 (  0) 0) |
| [7] |
金毅亮, 秦维, 蒋芸, 等. 金银合金纳米粒子表面处理及其表面增强拉曼光谱研究[J]. 化学学报, 2008, 66(22): 2494-2498. DOI:10.3321/j.issn:0567-7351.2008.22.009 (  0) 0) |
| [8] |
MALLIN M P, MURPHY C J. Solution-phase synthesis of sub-10 nm Au-Ag alloy nanoparticles[J]. Nano Lett, 2002, 2(11): 1235-1237. DOI:10.1021/nl025774n (  0) 0) |
 2017, Vol. 49
2017, Vol. 49

