2. 新药创制与药物安全性评价河南省协同创新中心 河南 郑州 450001
2. School of Collaborative Innovation Center of New Drug Research and Safety Evaluation of Henan Province, Zhengzhou 450001, China
赖氨酸特异性去甲基化酶1 (lysine-specific demethylase 1,LSD1)是第一个被发现的组蛋白去甲基化酶,通过黄素腺嘌呤二核苷酸依赖型机制(FAD-dependent mechanism)对组蛋白和非组蛋白中单甲基化和二甲基化赖氨酸去甲基化,属于胺氧化酶家族[1-2]。LSD1在基因表达和转录调节中起着重要作用,其过表达和调节紊乱与各种癌症、病毒感染和中枢神经系统病变等疾病的发生和发展相关[3-5]。近来LSD1作为治疗癌症等疾病的潜在靶点,一直受到广泛关注。由于LSD1和单胺氧化酶(monoamine oxidases,MAOs) A和B在结构和序列上有一定相似性,因此在早期研究LSD1生物化学性质时,MAOs抑制剂被用来筛选抑制LSD1活性,例如用于治疗抑郁症的药物(图 1)。其中,化合物1,(1R, 2S)-苯基环丙胺(tranylcypromine, TCP), 在三者中活性最好[6]。
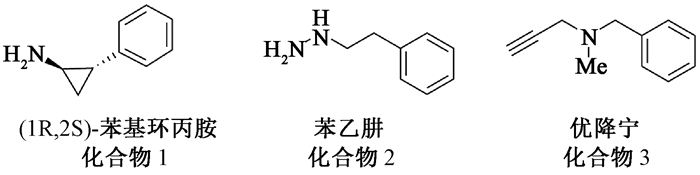
|
图 1 具有抑制LSD1活性的MAOs抑制剂 Fig. 1 Structures of MAOs inhibitors that inhibit LSD1 |
由于TCP对LSD1抑制效果较差且选择性不高,因此通过对TCP的苯基环丙胺结构进行修饰和衍生,以获得低毒性、优良活性的LSD1抑制剂。迄今为止,已报道了大量基于TCP结构的LSD1抑制剂,按TCP被修饰的区域分为两类:第一类是在环丙基上修饰的TCP衍生物,如化合物4~6 (图 2);第二类是在苯环或氨基上修饰的TCP衍生物,如化合物7~10 (图 2);基于TCP结构的LSD1抑制剂,TCP作为关键药效基团,和辅因子FAD形成不可逆共价五元环加成物,从而抑制LSD1活性[7]。
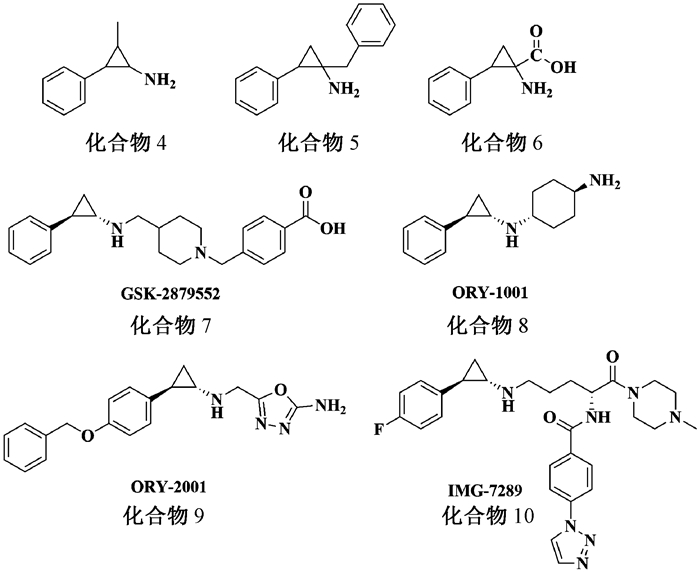
|
图 2 具有LSD1抑制活性的TCP衍生物 Fig. 2 Structures of TCP derivatives that inhibit LSD1 |
苗头化合物的发现是整个药物设计过程的起点,对新药研发至关重要。苗头化合物可通过虚拟筛选、理性药物分子设计、天然活性物质的筛选和化合物库随机筛选等途径获得。我们通过对化合物库筛选,发现含有靛红结构的N-取代TCP衍生物(图 3)对LSD1有较好抑制活性(IC50=2.16 μmol/L)。并且发现该化合物在10 μmol/L浓度下,对MAO A的抑制率为65%,对MAO B的抑制率为25%,表明靛红-TCP化合物对MAO B具有一定选择性。我们在靛红-TCP化合物苯环上分别引入吸电子基团和给电子基团,测试化合物的LSD1和MAOs抑制活性。为了展开初步构效关系(SAR)研究,我们用环烷基代替靛红,在TCP的氮原子上引入环戊基、环己基,得到环烷基-TCP衍生物,该类化合物虽然已有文献报道,但是LSD1相关活性的研究还未见发表。另外,嘌呤具有抑菌、抗肿瘤、消炎等多种生物活性,在临床与药物化学领域应用广泛[8-9]。因此,我们在TCP的氮原子上引入药效基团嘌呤,合成嘌呤-TCP衍生物,以期发现高效的新型LSD1抑制剂(图 3)。
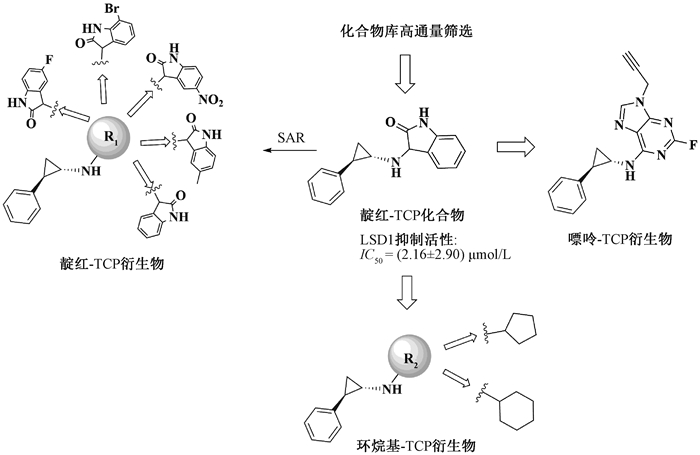
|
图 3 TCP类化合物的设计思路 Fig. 3 Design of TCP derivatives |
熔点测定采用北京科仪电光仪器厂的XT5显微熔点测定仪,温度未校正;高分辨质谱为Waters Micromass公司Q-Tof MicroTM高分辨质谱仪;核磁共振(nuclear magnetic resonance, NMR)采用瑞士Bruker DPX-600型超导核磁共振仪,内标四甲基硅烷(tetramethylsilane, TMS);反应检测用GF254薄层板。所用试剂均为分析纯。
1.2 目标化合物的表征 1.2.1 3-(((1R, 2S)-2-苯基环丙基)胺)吲哚-2-酮(化合物13a)TCP 0.665 g (5 mmol),扁桃酸0.760 g (5 mmol),加入无水甲醇25 mL,室温搅拌1 h,于冰浴条件下,加入靛红0.735 g (5 mmol),乙酸857 μL (15 mmol),室温搅拌3 h。冰浴条件下,加入氰基硼氢化钠0.630 g (10 mmol),室温反应24 h。反应结束,抽滤,用少量无水甲醇洗涤,得到白色固体(化合物13a) 0.884 g,收率67%,熔点149.6 ℃~150.8 ℃。1H-NMR (DMSO-d6, 600 MHz) δ 0.98~0.92 (m, 2H), 1.69 (s, 1H), 2.20 (s, 1H), 3.58 (s, 1H), 4.31 (s, 1H), 6.63 (d, J=7.1 Hz, 2H), 6.75 (d, J=7.6 Hz, 1H), 7.04~6.98 (m, 2H), 7.10~7.08 (m, 2H), 7.19 (t, J =7.3 Hz, 1H), 7.31 (d, J=6.9 Hz, 1H), 10.23 (s, 1H); 13C-NMR (DMSO-d6, 150 MHz) δ 15.6, 25.8, 39.1, 60.5, 109.9, 121.7, 125.4, 125.6, 126.0, 128.3, 128.7, 129.1, 142.2, 143.0, 178.6。HRMS:计算值C17H16N2O [M+H]+ 265.133 5;测量值265.133 8。
1.2.2 5-甲基-3-(((1R, 2S)-2-苯基环丙基)胺)吲哚-2-酮(化合物13b)合成方法与化合物13a相同。棕色固体,收率65%,熔点143.5 ℃~144.6 ℃。1H-NMR (DMSO-d6, 600 MHz) δ 0.94~0.90 (m, 1H), 1.00~0.96 (m, 1H), 1.74~1.70 (m, 1H), 2.23~2.20 (m, 1H), 2.27 (s, 3H), 3.52 (s, 1H), 4.26 (s, 1H), 6.63~6.62 (m, 1H), 6.68~6.67 (m, 2H), 7.00~6.95 (m, 1H), 7.05~7.01 (m, 1H), 7.13~7.08 (m, 3H), 10.13 (s, 1H); 13C-NMR (DMSO-d6, 150 MHz) δ 15.8, 21.2, 25.9, 39.3, 60.5, 109.6, 125.6, 126.0, 126.1, 128.3, 128.8, 129.1, 130.5, 140.5, 142.3, 178.7。HRMS:计算值C18H18N2O [M+H]+ 279.149 2;测量值279.149 0。
1.2.3 5-硝基-3-(((1R, 2S)-2-苯基环丙基)胺)吲哚-2-酮(化合物13c)合成方法与化合物13a相同。棕色固体,收率62%,熔点158.1 ℃~159.3 ℃。1H-NMR (DMSO-d6, 600 MHz) δ 0.94~0.88 (m, 1H), 1.05~0.97 (m, 1H), 1.95~1.70 (m, 1H), 2.38~2.24 (m, 1H), 3.86~3.77 (m, 1H), 4.50~4.46 (m 1H), 6.70~6.68 (m, 1H), 6.93~6.91 (m, 1H), 6.97~6.94 (m, 1H), 7.12~7.02 (m, 2H), 7.19~7.15 (m, 1H), 8.16~8.13 (m, 2H), 10.95 (s, 1H); 13C-NMR (DMSO-d6, 150 MHz) δ 17.0~16.2 (m), 26.0~25.0 (m), 39.2~39.0 (m), 60.3, 109.9~109.8 (m), 120.9~120.7 (m), 125.7 (m), 126.1, 126.2, 128.4~128.4 (m), 130.5~130.2 (m), 142.4~142.1 (m), 142.5~142.4 (m), 149.5 (m), 179.3~179.1 (m)。HRMS:计算值C17H15N3O3 [M+H]+ 310.118 6;测量值: 310.118 5。
1.2.4 7-溴-3-(((1R, 2S)-2-苯基环丙基)胺)吲哚-2-酮(化合物13d)合成方法与化合物13a相同。白色固体,收率60%,熔点132.4 ℃~133.6 ℃。1H-NMR (DMSO-d6, 600 MHz) δ 0.98~0.91 (m, 2H), 1.92~1.66 (m, 1H), 2.38~2.21 (m, 1H), 3.74~3.61 (m, 1H), 4.47~4.44 (m, 1H), 6.71~6.56 (m, 2H), 7.19~6.95 (m, 4H), 7.43~7.31 (m, 2H), 10.51 (s, 1H); 13C-NMR (DMSO-d6, 150 MHz, ) δ 17.0~15.5 (m), 25.8~24.9 (m), 39.1~39.0 (m), 61.4 (m), 102.5, 123.5~123.4 (m), 124.5~124.3 (m), 125.7, 125.9, 126.2, 128.5~128.4 (m), 131.5~131.4 (m), 142.1, 142.4, 178.4。HRMS:计算值C17H15BrN2O [M+H]+ 343.044 1;测量值343.044 0。
1.2.5 5-氟-3-(((1R, 2S)-2-苯基环丙基)胺)吲哚-2-酮(化合物13e)合成方法与化合物13a相同。白色固体,收率60%,熔点138.4 ℃~139.5 ℃。1H-NMR (600 MHz, DMSO-d6) δ 1.03~0.92 (m, 2H), 1.94~1.73 (m, 1H), 2.39~2.21 (m, 1H), 3.68~3.66 (m, 1H), 4.38~4.35 (m, 1H), 6.76~6.67 (m, 3H), 7.19~6.99 (m, 5H), 10.30~10.26 (m, 1H); 13C-NMR (150 MHz, DMSO-d6) δ 17.1~15.8 (m), 25.9~25.0 (m), 39.1, 60.9, 110.5, 113.2~113.0 (m), 115.0~114.9 (m), 125.7, 125.9 (m), 126.2, 128.5~128.4 (m), 131.1, 142.2~139.2 (m), 159.3~157.7 (m), 178.6~178.5 (m)。HRMS:计算值C17H15FN2O [M+H]+ 283.124 1;测量值283.124 2。
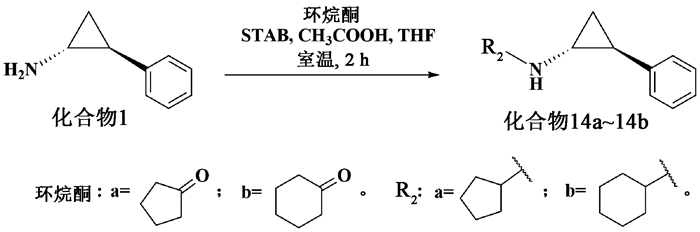
1.2.6 ((1R, 2S)-2-苯基环丙基)环戊基胺(化合物14a)环戊酮0.35 mL (4 mmol),加入10 mL无水四氢呋喃,三乙酰氧基硼氢化钠636 mg (3 mmol),冰醋酸0.11 mL (2 mmol),室温搅拌2 h。反应结束,用水(50 mL)和乙酸乙酯(50 mL×3)萃取,合并有机相,用无水硫酸钠干燥,减压浓缩,柱层析分离得白色液体(化合物14a) 0.542 mg,收率63%。1H-NMR (600 MHz, CDCl3) δ 0.99~1.96 (m, 1H), 1.08~1.05 (m, 1H), 1.40~1.33 (m, 2H), 1.54~1.52 (m, 2H), 1.70~1.64 (m, 2H), 1.73 (s, 1H), 1.86~1.83 (m, 2H), 1.89~1.88 (m, 1H), 2.33~2.30 (m, 1H), 3.24~3.19 (m, 1H), 7.04 (d, J=7.7 Hz, 1H), 7.14 (t, J=7.3 Hz, 1H), 7.24 (t, J=7.6 Hz, 2H); 13C-NMR (150 MHz, CDCl3) δ 16.8, 23.8, 23.9, 25.3, 33.2, 33.3, 41.0, 60.1, 125.4, 125.8, 128.2, 142.5。HRMS:计算值C14H19N [M+H]+ 202.159 0;测量值202.159 1。
1.2.7 ((1R, 2S)-2-苯基环丙基)环己基胺(化合物14b)合成方法与化合物14a相同。白色液体,收率60%。1H-NMR (600 MHz, CDCl3) δ 0.99~0.96 (m, 1H), 1.06~1.03 (m, 1H), 1.18~1.07 (m, 3H), 1.30~1.20 (m, 2H), 1.62~1.58 (m, 1H), 1.65 (s, 1H), 1.73~1.70 (m, 2H), 1.88~1.85 (m, 1H), 1.96~1.89 (m, 2H), 2.34~2.31 (m, 1H), 2.62~2.57 (m, 1H), 7.02 (d, J=7.2 Hz, 2H), 7.14 (t, J=7.4 Hz, 1H), 7.25~7.23 (m, 2H); 13C-NMR (150 MHz, CDCl3) δ 17.1, 25.1, 25.7, 26.3, 33.9, 39.8, 57.2, 125.4, 125.8, 128.3, 142.6。HRMS:计算值C15H21N [M+H]+ 216.174 7;测量值216.174 5。
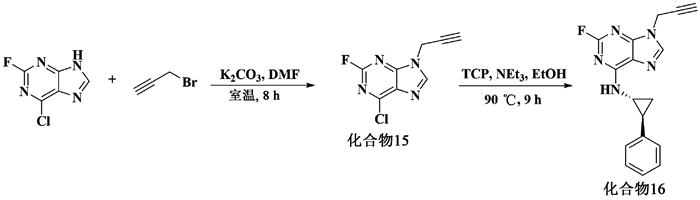
1.2.8 2-氟-6-(N-2-苯基环丙基胺)-9-炔丙基嘌呤(化合物16)取化合物2-氟-6-氯嘌呤4.50 g (26 mmol),加入N, N-二甲基甲酰胺100 mL,碳酸钾5.52 g (40 mmol),溴丙炔3.77 g (31.7 mmol),室温搅拌8 h,反应结束,用水(70 mL)和乙酸乙酯(70 mL×3)萃取,合并有机相,用无水硫酸钠干燥,减压浓缩,柱层析分离得白色固体(化合物15) 3.26 g,收率68%。1H-NMR (400 MHz, CDCl3) δ 2.62 (t, J=2.8 Hz, 1H), 5.03 (d, J=2.6 Hz, 2H), 8.33 (s, 1H); 13C-NMR (100 MHz, CDCl3) δ 33.9, 74.5, 76.3, 130.3 (d, JFC=5 Hz), 144.9 (d, JFC=3 Hz), 153.0 (d, JFC=18 Hz), 153.11 (d, JFC=17 Hz), 157.4 (d, JFC=220 Hz)。
取化合物2-氟6-氯-9-炔丙基嘌呤(化合物15) 1.1 g (5.2 mmol)和TCP游离态(化合物1) 0.69 mg (5.2 mmol),加15 mL无水乙醇,1.08 mL三乙胺,90 ℃加热回流9 h,反应结束,用水(70 mL)和二氯甲烷(70 mL×3)萃取,合并有机相,用无水硫酸钠干燥,减压浓缩,柱层析分离得白色固体(化合物16) 0.99 g,收率62%。1H-NMR (600 MHz, CDCl3) δ 1.32~1.28 (m, 1H), 1.45~1.42 (m, 1H), 2.22~2.20 (m, 1H), 2.51~2.50 (m, 1H), 3.18 (s, 1H), 4.88 (s, 2H), 6.69 (s, 1H), 7.21 (t, J=7.3 Hz, 1H), 7.25 (d, J=7.4 Hz, 2H), 7.31 (t, J=7.5 Hz, 2H), 7.92 (s, 1H); 13C-NMR (150 MHz, CDCl3) δ 16.5, 25.3, 32.8, 33.2, 75.3, 75.6, 118.1, 126.3, 126.8, 128.5, 139.4, 140.1 (d, JFC=2.3 Hz), 157.2 (d, JFC=19.5 Hz), 159.6 (d, JFC=210.0 Hz)。
1.3 生物活性评价实验仪器和试剂声波移液系统购自美国Labcyte公司,离心机和移液器购自德国艾本德公司,酶标仪购自珀金埃尔默企业管理(上海)有限公司,LSD1、MAO A、MAO B购自上海艾跃生物科技有限公司,所用试剂均为分析纯,水为超纯水。
1.4 生物活性评价实验方法体外LSD1抑制活性检测,以ORY-1001为对照化合物,将制备的化合物用二甲基亚砜配制成10 μmol/L浓度溶液,依次3倍稀释,共10个浓度,复孔测试。
体外MAO A、MAO B抑制活性检测,以Clorgyline为对照化合物,将制备的化合物配制成10 μmol/L浓度溶液,依次3倍稀释,共10个浓度,复孔测试。
2 结果与讨论 2.1 合成通过前期化合物库高通量筛选,发现化合物13a对LSD1有较好抑制活性,IC50值为2.16 μmol/L。在10 μmol/L浓度下,化合物13a对MAO A和MAO B的抑制率分别为65%和25%,在LSD1和MAO B之间表现出一定选择性。为了进行初步构效关系研究,我们在化合物13a苯环上分别引入给电子基团5-甲基(化合物13b)和吸电子基团5-硝基(化合物13c)、7-溴(化合物13 d)和5-氟(化合物13e) (图 4)。在这5个化合物中,化合物13d为首次报道,化合物13a、13b、13c和13e尽管在SciFinder数据库中可查到结构式,但是相关合成方法、表征和活性都没有文献报道。因此,我们对这4个化合物也进行了合成。
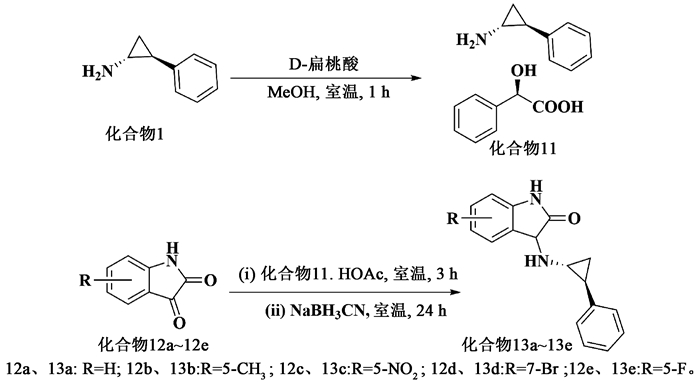
|
图 4 靛红-TCP类化合物的合成 Fig. 4 Synthesis of isatin-TCP derivatives |
化合物13的合成路线如图 4所示,参照文献方法,以TCP为起始原料,首先和扁桃酸合成盐,然后分别与相应取代的靛红经还原胺化反应得目标化合物13a~13e。
用环烷基代替靛红骨架,考察环烷基-TCP化合物对LSD1抑制活性的影响。环烷基-TCP衍生物由TCP和环戊酮(或环己酮)反应,以三乙酰氧基硼氢化钠为还原剂,发生还原胺化反应,得到环烷基-TCP衍生物(图 5),虽然该类化合物已经有文献报道,但是没有涉及LSD1活性。
|
图 5 环烷基-TCP类化合物的合成 Fig. 5 Synthesis of cycloalkyl-TCP derivatives |
同时,在TCP的氮原子上引入嘌呤骨架,检测嘌呤-TCP化合物对LSD1抑制活性的影响(图 6)。
|
图 6 嘌呤-TCP类化合物的合成 Fig. 6 Synthesis of purine-TCP derivatives |
嘌呤-TCP衍生物的合成路线如图 6所示。以2-氟-6-氯嘌呤为原料,在碱性条件下,通过亲核取代反应,在嘌呤的N-9位引入炔丙基,生成2-氟-6-氯-9-炔丙基嘌呤(化合物15)。然后与TCP发生经典的亲核取代反应,得到目标化合物(化合物16)。
2.2 体外LSD1、MAO A/B抑制活性评估LSD1和MAOs是同源蛋白,二者的催化机制都是以FAD为辅因子,裂解底物的C—N键,生成胺和醛。许多对LSD1有抑制活性的化合物,尤其是含有苯基环丙胺结构的化合物,对MAOs也有作用。因此,我们采用HTRF和MAO-Glo测试法,分别评价目标化合物体外抑制LSD1和MAOs活性,阳性对照为ORY-1001,其抑制LSD1的IC50值为0.23×10-3 μmol/L,抑制MAO A和MAO B的IC50值分别为2.0 nmol/L和63 nmol/L。目标化合物体外LSD1、MAO A/B抑制活性如表 1所示。
|
|
表 1 化合物13a~13e、14a~14b、化合物16体外LSD1、MAO A/B抑制活性 Tab. 1 LSD1 and MAO A/B inhibitory activities of compounds 13a~13e, 14a~14b and 16 in vitro |
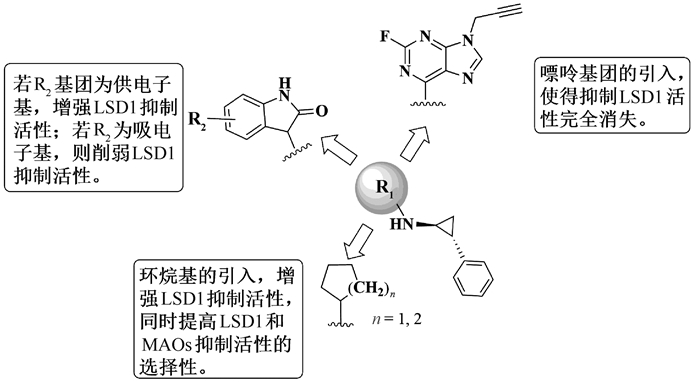
由表 1可得,靛红-TCP衍生物及化合物13a~13e对LSD1有中等至良好的抑制活性,其中化合物13b的抑制活性最好,IC50值为1.41 μmol/L,化合物13e的抑制活性最差,IC50值为21.15 μmol/L。在10 μmol/L浓度时,化合物13a~13e对MAO A均有抑制作用,抑制率在65%~95%之间。化合物13d对MAO B抑制活性最高,抑制率为92%。化合物13a对MAO B抑制活性最差,抑制率为25%,表明该化合物对LSD1和MAO B表现出一定选择性。在靛红的苯环上引入供电子基甲基,化合物抑制LSD1的活性加强(IC50=1.41 μmol/L);引入吸电子基,比如溴原子、硝基和氟原子,削弱了化合物对LSD1的抑制活性。对于环烷基-TCP衍生物,化合物14a和14b的LSD1抑制活性高于所有的靛红-TCP衍生物,IC50值分别为0.84 μmol/L和0.42 μmol/L,这说明环烷基的引入增强了LSD1的抑制活性;在10 μmol/L浓度下,化合物14a、14b对MAO A和MAO B均没有抑制作用,表明环烷基的引入增强了化合物对LSD1、MAOs抑制活性的选择性。此外,在TCP的氮原子上引入嘌呤骨架,对LSD1和MAOs都没有抑制作用,这表明在TCP的氮原子上引入芳香基团,可能会严重削弱对LSD1的抑制作用(图 7)。
|
图 7 N-取代TCP衍生物构效关系 Fig. 7 Structure-activity relationship of N-substituted tranylcypromine derivatives |
我们通过还原胺化反应合成一系列靛红-TCP类化合物和环烷基-TCP衍生物,此外,还通过亲核取代反应合成嘌呤-TCP衍生物,并测试其体外抑制LSD1、MAOs活性。在所合成的化合物中,环己基-TCP衍生物14b对LSD1抑制活性最高,IC50值为0.42 μmol/L。在靛红-TCP化合物苯环上引入供电子基团,LSD1抑制活性增大,引入吸电子基团,LSD1抑制活性减小;环烷基的引入有利于增强化合物的LSD1抑制活性,并且增强了化合物对LSD1与MAOs抑制活性的选择性;嘌呤骨架的引入,急剧降低了化合物对LSD1的抑制活性。综上所述,在TCP的氮原子上引入环烷基,对LSD1的抑制活性更强,对LSD1和MAOs的选择性更高。此类化合物的进一步研究正在进行中。本次研究结果丰富了LSD1抑制剂的化学结构类型,对N-取代TCP衍生物结构修饰提供有益思路,对研发更高效、更强选择性的LSD1抑制剂具有积极意义。
| [1] |
SHI Y J, LAN F, MATSON C, et al. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J]. Cell, 2004, 119(7): 941-953. DOI:10.1016/j.cell.2004.12.012 (  0) 0) |
| [2] |
SHI Y J, MATSON C, LAN F, et al. Regulation of LSD1 histone demethylase activity by its associated factors[J]. Molecular cell, 2005, 19(6): 857-864. DOI:10.1016/j.molcel.2005.08.027 (  0) 0) |
| [3] |
CAO J, YAN Q. Cancer epigenetics, tumor immunity, and immunotherapy[J]. Trends in cancer, 2020, 6(7): 580-592. DOI:10.1016/j.trecan.2020.02.003 (  0) 0) |
| [4] |
KNIPE D M. Nuclear sensing of viral DNA, epigenetic regulation of herpes simplex virus infection, and innate immunity[J]. Virology, 2015, 479/480: 153-159. DOI:10.1016/j.virol.2015.02.009 (  0) 0) |
| [5] |
LAKSTYGAL A M, DE ABREU M S, KALUEFF A V. Zebrafish models of epigenetic regulation of CNS functions[J]. Brain research bulletin, 2018, 142: 344-351. DOI:10.1016/j.brainresbull.2018.08.022 (  0) 0) |
| [6] |
LEE M G, WYNDER C, SCHMIDT D M, et al. Histone H3 lysine 4 demethylation is a target of nonselective antidepressive medications[J]. Chemistry & biology, 2006, 13(6): 563-567. (  0) 0) |
| [7] |
KANISKAN H V, MARTINI M L, JIN J. Inhibitors of protein methyltransferases and demethylases[J]. Chemical reviews, 2018, 118(3): 989-1068. DOI:10.1021/acs.chemrev.6b00801 (  0) 0) |
| [8] |
LEGRAVEREND M, GRIERSON D S. The purines: potent and versatile small molecule inhibitors and modulators of key biological targets[J]. Bioorganic & medicinal chemistry, 2006, 14(12): 3987-4006. (  0) 0) |
| [9] |
李澜, 张爱华, 张灿云. 鸟嘌呤与nH2O(n=1、2)的水化去氨基反应机理的理论研究[J]. 信阳师范学院学报(自然科学版), 2016, 29(2): 189-192. LI L, ZHANG A H, ZHANG C Y. Theoretical study on the hydrolytic deamination reaction mechanism of guanine and nH2O(n=1, 2)[J]. Journal of Xinyang normal university(natural science edition), 2016, 29(2): 189-192. DOI:10.3969/j.issn.1003-0972.2016.02.008 (  0) 0) |
 2021, Vol. 53
2021, Vol. 53

