2. 材料物理教育部重点实验室 河南 郑州 450001
2. Key Laboratory of Material Physics of Ministry of Education, Zhengzhou 450001, China
DNA是生物遗传信息的载体,而腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)四种DNA碱基则是DNA的基本组成部分,在基因的表达和复制过程中扮演着重要角色.由于DNA碱基分子溶解度很低且散射截面较小,因此采用常规拉曼散射方法很难对其进行高灵敏度检测、分析和研究.表面增强拉曼散射(SERS)技术为低浓度生物分子的检测开辟了一个新的方向.在过去十余年中,有关生物分子SERS探测的研究被广泛报道,涉及的生物分子探测种类已经包括核苷酸分子、蛋白质、酶、DNA或RNA碱基等.通过对生物分子的SERS光谱进行分析,可以获得目标探测分子的大量信息,如分子的吸附取向、原子或功能基团的吸附行为、分子吸附于金属表面时的结构变化以及不同分子的共吸附状态等.SERS检测具有非常高的灵敏度,可实现对低浓度DNA碱基的有效探测,甚至可实现单分子检测.因此,通过对DNA碱基的检测和吸附行为的研究,有可能进一步实现对DNA分子的直接检测,并有望在未来用于对DNA的快速测序,因而具有重要的基础研究价值和应用前景.
在SERS探测中,目前最常用的活性基底是Ag的胶体和粗糙电极,二者通常采用化学液相法或电化学方法进行制备.由于胶体粒子易于团聚,而粗糙电极难于实现表面形貌和微观结构的大面积均匀性.因此,以其作为活性基底进行SERS探测时,测量的稳定性和重复性均不够理想.为改变这一状况,人们往往通过优化制备工艺或采用模板法制备颗粒均匀的金属纳米体系加以补偿.文献[1-2]采用水热腐蚀技术制备了一种硅的层次结构,即硅纳米孔柱阵列(Si-NPA).以Si-NPA作为衬底,采用简单的浸渍还原技术,在Si-NPA上制备了图案化的Ag纳米结构阵列.在此基础上,文献[3-4]以Ag/Si-NPA为活性基底,对低浓度的DNA碱基腺嘌呤和荧光生物指示剂罗丹明6G(R6G)进行了SERS检测.结果表明,Ag/Si-NPA是一种性能优异的SERS活性基底,具有灵敏度高、稳定性和可重复性好等优点.
本文以Ag/Si-NPA为活性基底,对腺嘌呤之外的其他三种DNA碱基(鸟嘌呤、胞嘧啶和胸腺嘧啶)在活性基底上的吸附行为和SERS增强效应进行研究.结果表明,Ag/Si-NPA能够对DNA碱基实现低浓度检测,对低浓度生物分子进行高灵敏度SERS检测具有很好的潜力.
1 实验方法Si-NPA采用水热腐蚀法制备,其具体制备过程和结构表征见文献[1-2].制备完成后,将Si-NPA置于空气中20 h,通过自然氧化过程以改变Si-NPA的表面钝化状态,进而控制Ag纳米颗粒的沉积量和平均尺寸.随后,将经过自然氧化的Si-NPA在提前配制的浓度为0.01 mol/L的AgNO3溶液中浸渍沉积3 min,用去离子水充分清洗后在空气中自然晾干,得到Ag/Si-NPA活性基底[3].
配制具有不同浓度的鸟嘌呤、胞嘧啶和胸腺嘧啶的水溶液用于SERS检测.首先,将Ag/Si-NPA活性基底在0.1 mol/L的KCl溶液中预处理20 min,以去除Ag/Si-NPA表面可能吸附的杂质,而后用去离子水充分清洗干净.用微量进样器取4 μL配制好的碱基溶液滴于半干的Ag/Si-NPA表面,室温下自然干燥后进行SERS探测.
Ag/Si-NPA的结构、成分和表面形貌分别通过X射线衍射仪(Rigaku D/MAX-3B)和场发射扫描电子显微镜(JEOL JSM-6700F)进行表征.SERS光谱由显微拉曼光谱仪(Renishaw,RM2000)测得,激发波长为633 nm,光斑直径为1 μm,样品表面照射功率为0.3 mW,设备波数分辨率为1.5 cm-1,光谱收集时间均设定为10 s.
2 结果与讨论 2.1 Ag/Si-NPA的结构成分与形貌表征图 1给出了Ag/Si-NPA的X射线衍射图.图中观察到5个衍射峰,分别位于38.10°、44.30°、64.40°、77.40°和81.60°.通过与Ag的标准XRD图谱进行比对可以确定,5个衍射峰分别对应于来自面心立方结构Ag晶体不同晶面族的衍射,表明通过浸渍沉积法成功实现了金属Ag在Si-NPA上的沉积生长.
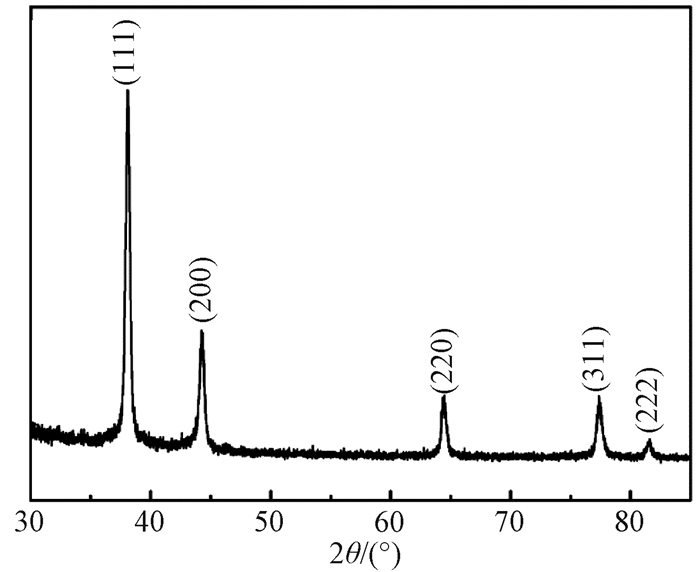
|
图 1 Ag/Si-NPA的X射线衍射图 Fig. 1 The XRD pattern of Ag/Si-NPA |
通过扫描电镜得到Si-NPA和Ag/Si-NPA的表面形貌如图 2所示.图 2(a)给出了Si-NPA的表面形貌,可以观察到由近似等同、分离完好且垂直于样品表面规则排列的火山口状结构组成的阵列.根据文献[5]的研究结果,所观察到的火山口状结构为微米尺度的、高度多孔化的硅柱,孔的平均直径约为40 nm,孔壁由包裹二氧化硅的硅纳米晶粒组成,平均粒径约为3.4 nm.图 2(b)为Ag/Si-NPA的表面形貌.可以看出,通过浸渍沉积在Si-NPA表面形成了两种Ag的结构:一种是连续覆盖于Si-NPA表面的Ag纳米晶粒;另一种则是亚微米量级较大的Ag颗粒.后者存在于硅柱之间的谷底,相互连接形成一种手链结构.根据文献[4]的表征结果,Ag纳米晶粒和较大颗粒的平均尺寸分别约为47.9 nm和587 nm,对于DNA碱基的SERS探测具有较好的效果.

|
图 2 Si-NPA和Ag/Si-NPA的表面形貌 Fig. 2 Surface morphologies of Si-NPA and Ag/Si-NPA |
鸟嘌呤为嘌呤类的有机化合物,其分子结构为由碳原子和氮原子组成的具有特征性的双环结构,在C2位带有一个氨基,C6位与氧原子形成羰基.胞嘧啶则是一种嘧啶碱基,与鸟嘌呤的双环结构不同,其分子仅由一个六元环组成,在C4位带有一个氨基,C3位与氧原子形成羰基.胸腺嘧啶为组成DNA的另一种嘧啶碱基,和胞嘧啶的结构相似,也是仅由一个六元环构成,在C5位带有一个甲基,C2和C4位与氧原子形成羰基.
2.2.2 鸟嘌呤的SERS探测图 3为不同浓度鸟嘌呤溶液吸附于Ag/Si-NPA的SERS光谱.图 3(a)给出了鸟嘌呤固体粉末的常规拉曼光谱作为参比,图 3(b)和图 3(c)分别为浓度为10-5 mol/L、10-6 mol/L的鸟嘌呤溶液吸附于Ag/Si-NPA的SERS光谱.可以看出,所测得的SERS光谱与常规拉曼光谱的谱结构基本一致,表明采用SERS光谱技术可以对低浓度鸟嘌呤溶液进行有效探测.
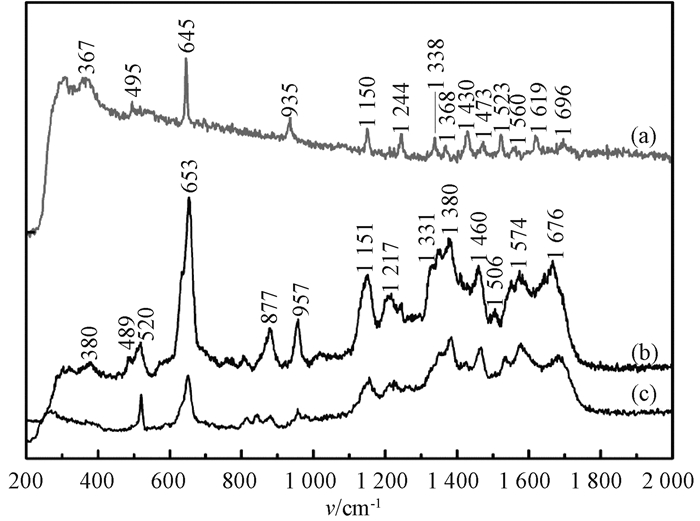
|
图 3 不同浓度鸟嘌呤溶液吸附于Ag/Si-NPA的SERS光谱 Fig. 3 The SERS spectra of guanine solutions with different concentrations adsorbed on Ag/Si-NPA (a)鸟嘌呤固体粉末; (b) 10-5 mol/L鸟嘌呤溶液; (c) 10-6 mol/L鸟嘌呤溶液 |
需要指出的是,相对于鸟嘌呤固体粉末的常规拉曼光谱,低浓度鸟嘌呤溶液吸附的SERS峰位出现了一定的移动.为此,通过与已经报道的密度泛函理论计算结果[6]进行比对,对所测SERS光谱中出现的主要拉曼峰进行了指认.结果表明,图 3(b)中位于653 cm-1处最强的拉曼峰,对应于固体粉末常规拉曼光谱位于645 cm-1的拉曼峰,来自于鸟嘌呤分子中六元环的环呼吸振动;固体粉末常规拉曼谱中位于935 cm-1处的拉曼峰也得到明显增强,它对应于五元环的形变振动,在SERS光谱中出现在957 cm-1处,这两个峰都与环的面内振动模式有关.此外,得到显著增强的特征峰还有位于1 151、1 380、1 460、1 676 cm-1处的振动峰,分别对应于N1—C6伸缩振动峰和NH2摇摆振动峰,C5—N7、C5—C6、C6=O伸缩振动峰和C8—H、N9—H弯曲振动峰,N7—C8、N3—C4、N1—C2伸缩振动峰和C8—H、N1—H弯曲振动峰,以及C6=O、C5—C6伸缩振动峰,而所有这些振动峰均源于碳环的面内振动.
根据SERS表面选择定则[7],垂直于金属表面的拉曼振动模式将会得到显著增强,而平行于金属表面的拉曼振动模式则增强效果较弱.在SERS光谱中观察到强度明显增加的、对应于面内振动模式的拉曼峰,说明鸟嘌呤分子吸附取向应为垂直于Ag颗粒表面;而位于380 cm-1的拉曼峰经比对,指认为来自于C2N3C4C5和N7C8N9C4的环面扭转振动,表明鸟嘌呤分子并非完全地垂直吸附于基底表面,而是略有倾斜.
此外,位于1 217 cm-1(N7—C8、N1—C6伸缩振动,N1—H、C8—H弯曲振动)、1 380 cm-1(C5—N7、C5—C6、C6=O伸缩振动,C8—H、N9—H弯曲振动)和1 460 cm-1(N7—C8、N3—C4、N1—C2伸缩振动,C8—H、N1—H弯曲振动)的拉曼峰均显著增强,它们均涉及与N7相关的振动,且与常规拉曼光谱相比,这些峰位均有较大的频移.相比之下,在常规拉曼光谱中位于1 338 cm-1(C2—N10伸缩振动,N1—H弯曲振动)、1 430 cm-1(N1—C2、C4—N9伸缩振动,N1—H弯曲振动,NH2摇摆振动)、1 523 cm-1(C4—C5、C4—C9伸缩振动)、1 619 cm-1(C2—N10、C2—N3伸缩振动,NH2剪切振动)的拉曼峰则在SERS光谱中未被增强甚至是消失,这些拉曼峰涉及与N1、C2和NH2相关的振动.
由于电磁相互作用是一种长程作用,电场强度随着与金属表面距离的增加呈指数下降.因此,分子中靠近基底表面的原子振动光谱会比其他部分产生更加显著的增强.由此可以推断出鸟嘌呤分子是通过N7吸附于金属表面,而N1、C2和NH2则是远离基底表面.另外,常规拉曼光谱中位于1 696 cm-1的拉曼峰,归属于C6=O伸缩振动,在SERS光谱中出现在1 676 cm-1处且被显著增强,同样涉及C6=O伸缩振动且位于1 380 cm-1的拉曼峰也有所增强,这表明羰基位于金属表面附近.基于以上分析可以推断出,鸟嘌呤分子是通过N7和羰基垂直且略有倾斜地吸附于Ag/Si-NPA表面.
图 4(c)为鸟嘌呤溶液浓度降低至10-6 mol/L时的SERS光谱.可以看出,随着鸟嘌呤溶液浓度的降低,SERS光谱的强度降低,但其峰形和峰位未发生明显变化.值得注意的是,归属于环呼吸振动模式的拉曼峰的相对强度降低,表明随着溶液浓度的降低,鸟嘌呤更趋向于平行吸附于基底表面.
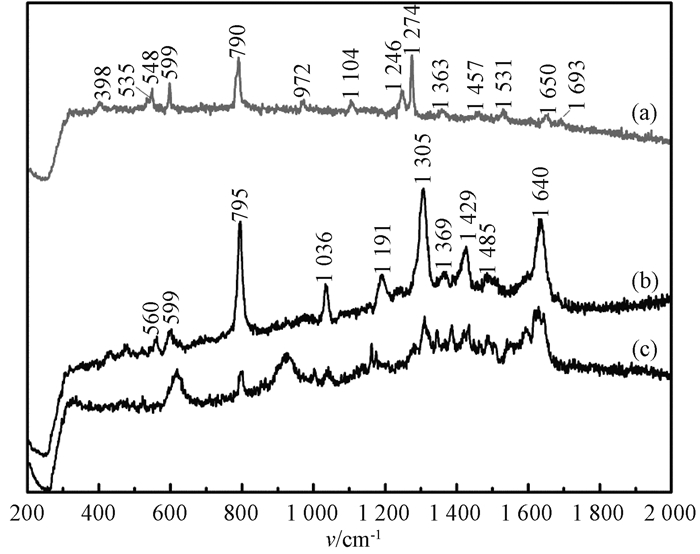
|
图 4 不同浓度胞嘧啶溶液吸附于Ag/Si-NPA的SERS光谱 Fig. 4 The SERS spectra of cytosine solutions with different concentrations adsorbed on Ag/Si-NPA (a)胞嘧啶固体粉末; (b) 10-2 mol/L胞嘧啶溶液; (c) 10-6 mol/L胞嘧啶溶液 |
图 4为不同浓度胞嘧啶溶液吸附于Ag/Si-NPA的SERS光谱.图 4(a)给出了胞嘧啶固体粉末的常规拉曼光谱作为参比,图 4(b)和图 4(c)分别为浓度为10-2 mol/L、10-6 mol/L的胞嘧啶溶液吸附于Ag/Si-NPA的SERS光谱.根据文献[8-9]的理论计算结果,对SERS光谱中出现的主要拉曼峰进行了指认.环的呼吸振动峰在常规拉曼光谱中位于790 cm-1处,在图 4(b)中则略微移动至795 cm-1处且显著增强.另外,位于1 036 cm-1(C4—NH2摇摆振动)、1 191 cm-1(N1—H、C6—H摇摆振动)、1 305 cm-1(C2—N3、C2—N1伸缩振动)、1 640 cm-1(C2=O伸缩振动)的拉曼峰也都明显增强,这些峰均归属于环的面内振动.值得注意的是,常规拉曼光谱中位于535 cm-1(NH2剪切振动)和972 cm-1(C6—H摇摆振动)的振动峰在SERS光谱中减弱甚至消失.根据SERS表面选择定则[7],上述结果均表明胞嘧啶分子是垂直吸附于Ag颗粒表面.
此外,涉及C2=O7振动的位于599 cm-1(C2=O7、C2—N3摇摆振动)和1 640 cm-1(C2=O7伸缩振动)的拉曼峰均显著增强,并且峰位位于1 305 cm-1(C2—N3、C2—N1伸缩振动)的拉曼峰增强最大.这些结果表明C2和O7靠近于Ag的表面.同时,与N3相关的振动且位于548 cm-1(N3—C4、C4—C5摇摆振动)的拉曼峰,在SERS光谱中增强且频移至560 cm-1.位于1 191 cm-1(N1—H、C6—H摇摆振动)和1 036 cm-1(C4—NH2摇摆振动)处拉曼峰的出现,以及1 246 cm-1(C6—H、N1—H摇摆振动,C6—N1伸缩振动)和972 cm-1(C6—H摇摆振动)处拉曼峰的消失,表明N3、N1、C4靠近基底表面而C6则远离基底表面.由于胞嘧啶与金属之间最可能形成化学键的位置是N3[10],因此,胞嘧啶分子是通过N3和羰基(C2=O7)吸附于Ag/Si-NPA表面.通过其几何结构可知,胞嘧啶分子仅含有一个六元环,其对应于表面选择定则的距离效应并不如鸟嘌呤那么明显.
图 4(c)为胞嘧啶溶液浓度降低至10-6 mol/L时的SERS光谱.可以看出,随着胞嘧啶溶液浓度的降低,环呼吸振动模式对应的拉曼峰的相对强度降低.另外,较低浓度时在972 cm-1处出现了归属于面外摇摆振动的峰,表明当溶液浓度降低时,胞嘧啶分子的吸附角度将会有所倾斜.
2.2.4 胸腺嘧啶的SERS探测图 5为不同浓度胸腺嘧啶溶液吸附于Ag/Si-NPA的SERS光谱.图 5(a)给出了作为参比的胸腺嘧啶固体粉末的常规拉曼光谱,图 5(b)和图 5(c)则分别对应于浓度为10-2 mol/L、10-6 mol/L的胸腺嘧啶溶液吸附于Ag/Si-NPA的SERS光谱.根据文献[11-12]的理论计算结果,对SERS光谱中出现的主要拉曼峰进行了指认.与鸟嘌呤和胞嘧啶不同,胸腺嘧啶的环呼吸振动模式对应的拉曼峰位有较大的频移,由740 cm-1频移至781 cm-1.文献[13]研究结果表明,与环有关的振动频移归因于金属表面与π键之间的相互作用.因此,环呼吸振动较大的频移表明胸腺嘧啶的嘧啶环与Ag颗粒之间存在着一定的相互作用.
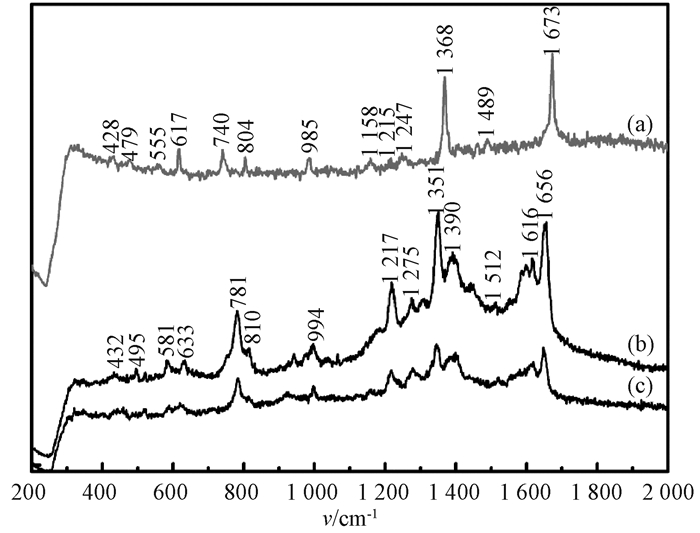
|
图 5 不同浓度胸腺嘧啶溶液吸附于Ag/Si-NPA的SERS光谱 Fig. 5 The SERS spectra of thymine solutions with different concentrations adsorbed on Ag/Si-NPA (a)胸腺嘧啶固体粉末; (b) 10-2 mol/L胸腺嘧啶溶液; (c) 10-6 mol/L胸腺嘧啶溶液 |
与环面内振动相关的一系列振动带,分别位于740 cm-1(环呼吸振动)、804 cm-1(C6N1C2挤压振动,C5—CH3伸缩振动)、1 215 cm-1(环变形振动,N1—H、C6—H弯曲振动)、1 673 cm-1(C4—C5、C4=O8伸缩振动,N1—H、C6—H弯曲振动)处的拉曼峰均有显著的增强,表明胸腺嘧啶分子是垂直吸附于Ag的表面.另外,出现于617 cm-1(N3—H摇摆振动)、985 cm-1(C9—H10、C9—H11、C9—H12摇摆振动)处归属于面外振动及环呼吸振动的拉曼峰有较大的频移,表明胸腺嘧啶分子是倾斜吸附在Ag原子表面,环平面与Ag表面的夹角相比于其他DNA碱基更小.
常规拉曼光谱中位于1 673 cm-1(C4—C5、C4=O8伸缩振动)的振动峰在图 5(b)中频移至1 656 cm-1, 并被显著增强,表明羰基(C4=O8)应接近于基底表面,而胸腺嘧啶中另一个与羰基有关且归属于C2=O7的振动带在常规拉曼光谱和SERS光谱中均未探测到.此外,涉及N3的振动且位于617 cm-1(N3—H摇摆振动)、1 368 cm-1(N3—H、C6—H弯曲振动)的拉曼峰均被显著增强.由以上实验结果可得,胸腺嘧啶分子是通过N3和C4=O8吸附于Ag原子表面,1 390 cm-1(C4—C5伸缩振动,N3—H、N1—H1弯曲振动)处拉曼峰的出现证实了上述结论.
通过对比不同浓度胸腺嘧啶溶液的SERS光谱,可以看出,随着胸腺嘧啶溶液浓度的降低,环呼吸振动峰的强度下降,表明随着溶液浓度的降低,胸腺嘧啶分子的吸附角度将会有所倾斜.
2.3 DNA碱基SERS探测的普遍规律通过以上分析可以看出,吸附于Ag/Si-NPA表面的碱基在SERS探测中有几个普遍的规律.鸟嘌呤、胞嘧啶、胸腺嘧啶吸附于Ag/Si-NPA活性基底后,虽然收集到的SERS光谱中大多数拉曼峰位都有明显的频移,但光谱结构与其固体粉末的常规拉曼光谱相比表现出明显的一致性.在SERS光谱中最强的拉曼峰虽然峰位频移略有不同,但均归属于面内环呼吸振动,鸟嘌呤和胞嘧啶拉曼峰的频移较小,胸腺嘧啶的峰位频移较大,与环有关的振动频移归因于金属表面与π键之间的相互作用.因此,环呼吸振动拉曼峰的频移表明三种碱基均是略有倾斜地吸附于基底表面,与胞嘧啶和鸟嘌呤相比,胸腺嘧啶的倾斜角度更小.
电场强度随着与金属表面距离的增加呈指数下降,因此,靠近基底表面的振动峰会比远离基底表面的振动峰产生更大的增强效果.鸟嘌呤分子中含有两个相邻的C—N环,所以其距离效应比嘧啶分子更加明显,这与SERS检测结果一致.另外,位于1 690 cm-1附近归属于羰基(C=O)伸缩振动的拉曼峰均增强且有一定程度的红移.图 6给出了鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)的几何结构以及吸附于Ag/Si-NPA上最可能的空间结构和取向.
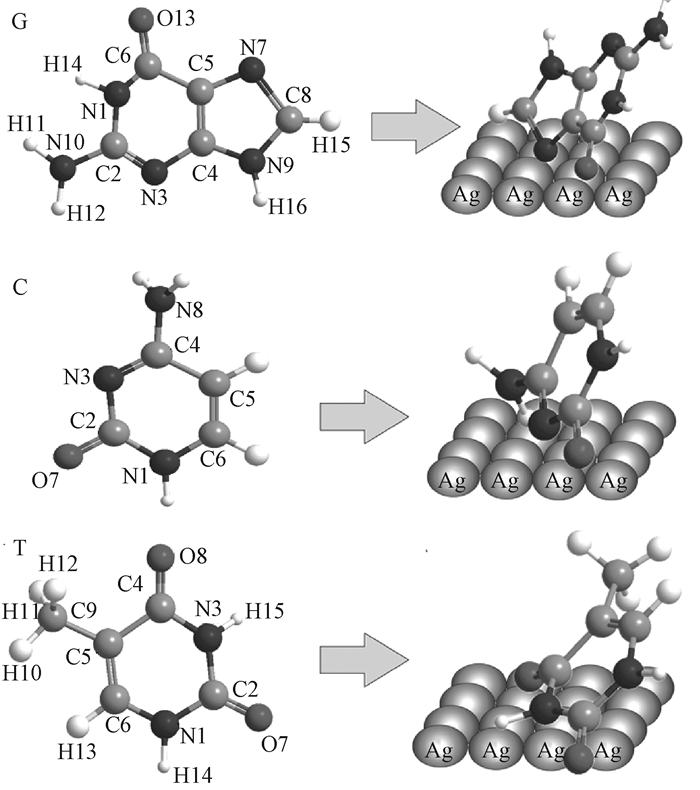
|
图 6 鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)的几何结构以及吸附于Ag/Si-NPA上最可能的空间结构和取向 Fig. 6 The geometric construction of guanine(G), cytosine(C), thymine(T), and the most probable space configuration and orientation of the molecules adsorbed on Ag/Si-NPA |
通过SERS的方法研究了三种DNA碱基(鸟嘌呤、胞嘧啶和胸腺嘧啶)在低浓度时的吸附行为.以Ag/Si-NPA为SERS的活性基底,对不同浓度的DNA碱基进行了SERS探测,并与碱基固体粉末的常规拉曼光谱进行了对比分析.通过对比发现,三种DNA碱基均是略微倾斜地吸附于基底表面,但倾斜角度不同,胸腺嘧啶的倾斜角度要小于鸟嘌呤和胞嘧啶的倾斜角度.不同碱基的吸附位点相似,都是通过羰基和氮原子吸附于Ag原子表面.另外,随着溶液浓度的降低,碱基分子更趋向平行吸附于基底表面.研究结果表明,Ag/Si-NPA是一种具有潜力的SERS活性基底,可实现对低浓度生物分子的探测,有望应用于DNA快速测序工程.
| [1] |
许海军, 富笑男, 孙新瑞, 等. 硅纳米孔柱阵列的结构和光学特性研究[J]. 物理学报, 2005, 54(5): 2352-2357. DOI:10.3321/j.issn:1000-3290.2005.05.071 (  0) 0) |
| [2] |
XU H J, LI X J. Silicon nanoporous pillar array:a silicon hierarchical structure with high light absorption and triple-band photoluminescence[J]. Opt Express, 2008, 16(5): 2933-2941. DOI:10.1364/OE.16.002933 (  0) 0) |
| [3] |
FENG F, ZHI G, JIA H S, et al. SERS detection of low-concentration adenine by a patterned silver structure immersion plated on a silicon nanoporous pillar array[J]. Nanotechnology, 2009, 20(29): 295501. DOI:10.1088/0957-4484/20/29/295501 (  0) 0) |
| [4] |
WANG Y Q, MA S, YANG Q Q, et al. Size-dependent SERS detection of R6G by silver nanoparticles immersion-plated on silicon nanoporous pillar array[J]. Appl Surf Sci, 2012, 258(15): 5881-5885. DOI:10.1016/j.apsusc.2012.02.129 (  0) 0) |
| [5] |
LI X J, HU X, JIA Y, et al. Tunable superstructures in hydrothermally etched iron-passivated porous silicon[J]. Appl Phys Lett, 1999, 75(19): 2906-2908. DOI:10.1063/1.125186 (  0) 0) |
| [6] |
GIESE B, MCNAUGHTON D. Density functional theoretical (DFT) and surface-enhanced Raman spectroscopic study of guanine and its alkylated derivatives[J]. Phys Chem Chem Phys, 2002, 4(20): 5171-5182. DOI:10.1039/b203830g (  0) 0) |
| [7] |
MOSKOVITS M, SUH J S. Surface selection rules for surface-enhanced Raman spectroscopy: calculations and application to the surface-enhanced Raman spectrum of phthalazine on silver[J]. J Phys Chem, 1984, 88(23): 5526-5530. DOI:10.1021/j150667a013 (  0) 0) |
| [8] |
CAMAFEITA E, SÁNCHEZ-CORTÉS S, GARCÍA-RAMOS J V. SERS of cytosine and its methylated derivatives on gold sols[J]. J Raman Spectrosc, 1995, 26(2): 149-154. DOI:10.1002/jrs.v26:2 (  0) 0) |
| [9] |
LIU S, ZHENG G, LI J. Raman spectral study of metal-cytosine complexes:a density functional theoretical (DFT) approach[J]. Spectrochim Acta A, 2011, 79(5): 1739-1746. DOI:10.1016/j.saa.2011.05.049 (  0) 0) |
| [10] |
ATAKA K, OSAWA M. In situ infrared study of cytosine adsorption on gold electrodes[J]. J Electroanal Chem, 1999, 460(1/2): 188-196. (  0) 0) |
| [11] |
SHANG Z G, TING D N, WONG Y T, et al. A study of DFT and surface enhanced Raman scattering in silver colloids for thymine[J]. J Mol Struct, 2007, 826(1): 64-67. DOI:10.1016/j.molstruc.2006.05.007 (  0) 0) |
| [12] |
CHO K H, CHOO J, JOO S W. Tautomerism of thymine on gold and silver nanoparticle surfaces: surface-enhanced Raman scattering and density functional theory calculation study[J]. J Mol Struct, 2005, 738(1/2/3): 9-14. (  0) 0) |
| [13] |
GAO X, DAVIES J P, WEAVER M J. A test of surface selection rules for surface-enhanced Raman scattering:the orientation of adsorbed benzene and monosubstituted benzenes on gold[J]. J Phys Chem, 1990, 94(17): 6858-6864. DOI:10.1021/j100380a059 (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


