2. 河南中烟工业有限责任公司 河南 郑州 450016
2. Henan ZhongYan Industrial Co., LTD, Zhengzhou 450016, China
部分药物属于酰胺类化合物,对酰胺的合成研究引起了人们的广泛关注[1-3].酰胺合成的方法主要有羧酸或羧酸类衍化物与胺类物质缩合[4]、酶催化反应[5]、腈类的水解反应[6]、芳基卤的氨基羰基化反应[7]、硫代酸和叠氮的酰胺化反应[8]等.但这些方法都存在一些不足,比如反应需要重金属的参与[9],易污染环境,代价较高昂,反应条件苛刻等.随着对酰胺合成方法的不断探索,发现可以通过有机催化或金属催化胺和醛生成酰胺[10-11].醇与胺反应合成酰胺是一种原子经济性与环境友好反应[12].本文以NaI/Fe3+为催化剂,有机胺盐为氮源,水为溶剂, 由苯甲醇合成了苯甲酰胺.该方法具有环境友好、原料易得且反应条件温和等优点.
1 实验部分 1.1 试剂与仪器苯甲醇、环己胺、正丙胺、正丁胺均为分析纯(国药集团化学试剂有限公司);70%(质量分数)叔丁基过氧化氢(TBHP)(北京百灵威科技有限公司);65%~70%(质量分数)乙胺水溶液(阿拉丁化学试剂有限公司).
1H-NMR谱由Bruker DPX 400 MHz型核磁共振仪测定;IR谱由Thermo Nicolet IR 200型红外光谱仪测定,KBr压片;反应液中原料及各种产物的含量由7895A型气质联用色谱仪通过内标法测定.
1.2 苯甲酰胺的合成与表征将苯甲醇、胺、碱、NaI依次加入到50 mL三口瓶中,搅拌,加入H2O和适量TBHP;加热使体系升温至80 ℃,反应4 h后冷却至室温;二氯甲烷萃取,饱和食盐水洗涤,有机层用无水硫酸干燥,过滤,浓缩.醇与胺或胺盐合成酰胺的反应路线如图 1所示.
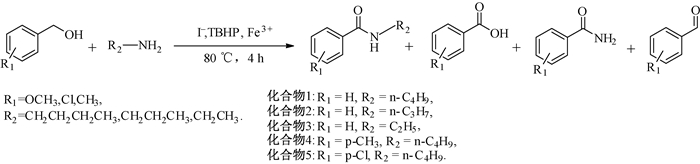
|
图 1 醇与胺或胺盐合成酰胺的反应路线 Figure 1 The reaction route of alcohol with amine or its salt for amide |
化合物1(N-丁基苯甲酰胺)的IR(KBr,cm-1): 3 318, 2 958, 2 929, 2 867, 1 640, 1 541, 1 305, 851, 802, 701;1H-NMR (DMSO-d6, δ): 8.44 (1H, s, 氨基), 7.82~7.83 (2H, d, J=4 Hz, 苯基), 7.50~7.54 (1H, m, 苯基), 7.43~7.47 (2H, m, 苯基), 3.23~3.28 (2H, m, 亚甲基), 1.38~1.51 (2H, m, 亚甲基), 1.24~1.32 (2H, m, 亚甲基), 0.89~0.93 (3H, t, 甲基).
化合物2(N-丙基苯甲酰胺)的IR(KBr,cm-1): 3 305, 2 928, 2 871, 1 640, 1 540, 1 306, 1 149, 1 024, 801, 699;1H-NMR(DMSO-d6, δ): 8.45~8.47 (1H, t, 氨基), 7.83~7.84 (2H, d, J=4 Hz, 苯基), 7.50~7.52 (1H, m, 苯基), 7.44~7.48 (2H, m, 苯基), 3.35 (H2O), 3, 21~3, 25 (2H, m, 亚甲基), 2.50~2.51 (DMSO-d6), 1.51~1.58 (2H, m, 亚甲基), 0.88~0.91 (3H, t, 甲基).
化合物3(N-乙基苯甲酰胺)的IR(KBr,cm-1): 3 305, 2 974, 2 930, 1 640, 1 539, 1 305, 1 149, 866, 700, 677;1H-NMR (DMSO-d6, δ): 8.46~8.47 (1H, t, 氨基), 7.83~7.85 (2H, d, J=8 Hz, 苯基), 7.50~7.52 (1H, m, 苯基), 7.44~7.48 (2H, m, 苯基), 3.27~3.32 (2H, m, 亚甲基), 2.50~2.51 (DMSO-d6), 0.89~0.93 (3H, t, 甲基).
化合物4(N-丁基对甲基苯甲酰胺)的IR(KBr,cm-1): 3 322, 2 959, 2 930, 1 639, 1 544, 1 460, 1 308, 1 184, 837, 750;1H-NMR (DMSO-d6, δ): 8.34~8.37 (1H, t, 氨基), 7.74~7.76 (2H, d, J=8 Hz, 苯基), 7.24~7.26 (2H, d, J=8 Hz, 苯基), 3.22~3.27 (2H, m, 亚甲基), 2.51 (3H, s, 甲基), 1.46~1.49 (2H, m, 亚甲基), 1.29~1.34 (2H, m, 亚甲基), 0.88~0.92 (3H, t, 甲基).
化合物5(N-丁基对氯苯甲酰胺)的IR(KBr,cm-1): 3 322, 2 958, 2 931, 1 623, 1 533, 1 474, 1 013, 844, 756;1H-NMR (DMSO-d6, δ): 8.51~8.54 (1H, t, 氨基), 7.84~7.87 (2H, d, J=12 Hz, 苯基), 7.52~7.55 (2H, m, 苯基), 3.23~3.28 (2H, m, 亚甲基), 1.47~1.50 (2H, t, 亚甲基), 1.30~1.37 (2H, m, 亚甲基), 0.88~0.92 (3H, t, 甲基).
2 结果与讨论以NaI/Fe3+为催化剂,水为溶剂,TBHP为氧化剂,有机胺盐为氮源,由苯甲醇合成了酰胺类化合物.通过气质联用色谱仪分析反应条件的改变对原料的转化率、中间产物与产物的产率的影响,进而优化反应条件,以期获得较高产率的苯甲酰胺.
2.1 氧化剂对反应的影响氧化剂(TBHP)的用量对反应的影响见表 1.当原料与氧化剂的物质的量之比为1:1~1:5时,苯甲醇转化率和N-丁基苯甲酰胺的产率随着氧化剂用量的增加而升高,苯甲醇转化率从84%升高至100%,N-丁基苯甲酰胺的产率从48%升高至75%,同时副产物减少.当原料与氧化剂的物质的量之比为1:8和1:10时,随着氧化剂用量的增加,苯甲醇转化率保持在100%,没有变化,而副产物产率增加,N-丁基苯甲酰胺的产率减少.因此,较佳的原料与氧化剂的物质的量之比为1:5.
|
|
表 1 氧化剂的用量对反应的影响 Table 1 The influence of oxidate dosage on reaction |
碱在胺氧化合成酰胺的反应中起关键作用[13],能够活化底物胺.不同碱性试剂对反应的影响见表 2.对于第一主族碱金属的碳酸盐,随着碱性的增加,N-丁基苯甲酰胺的产率从72%降低到67%.当使用BaCO3为碱性试剂时,N-丁基苯甲酰胺的产率达到75%.因此,选择BaCO3作为由苯甲醇反应合成苯甲酰胺的碱性试剂.
|
|
表 2 不同碱性试剂对反应的影响 Table 2 The influence of different alkali reagents on reaction |
碱性试剂(BaCO3)的用量对反应的影响见表 3.当苯甲醇与BaCO3的物质的量之比为1:0~1:2时,N-丁基苯甲酰胺的产率随着BaCO3用量的增加而升高,从26 %升高到75 %;而苯甲醇与BaCO3的物质的量之比为1:3和1:4时,N-丁基苯甲酰胺的产率几乎没有变化.因此,较佳的苯甲醇与BaCO3的物质的量之比为1:2.
|
|
表 3 BaCO3用量对反应的影响 Table 3 The influence of BaCO3 dosage on reaction |
丁胺盐酸盐作为氮源来合成苯甲酰胺,其与正丁胺的实验结果对比见表 4.两种氮源与苯甲醇的反应,所得到的几种副产物及中间产物的产率不同,但苯甲酰胺的产率相似.鉴于丁胺盐酸盐更适合水相反应体系,而且胺盐作为氮源时副产物较少.因此,丁胺盐酸盐适合作为由苯甲醇反应合成苯甲酰胺的氮源.
|
|
表 4 氮源对反应的影响 Table 4 The influence of nitrogen source on reaction |
试验不同芳基的苄醇和不同烷基胺的盐,相应的反应产率见表 5.可以发现,随着底物胺中烷基的碳链增加,酰胺的产率从64 %升高到76 %.在反应条件下,所有底物都能够得到中等以上产率的苯甲酰胺.
|
|
表 5 反应底物的扩展 Table 5 Substrate extension of reaction |
在醇与胺反应合成酰胺的体系中,过渡金属离子的加入会促进反应的进行.在反应过程中,金属离子通过电子和质子的转移,高价态和低价态离子与氧化剂生成两种配合物,从而参与到氧化-还原反应的循环[14].一些金属离子对反应的影响见表 6.可以看到,不同金属离子对反应的影响具有明显差别.Fe2+、Fe3+、Mn2+和Pd2+的加入,增加了N-丁基苯甲酰胺的产率,其中Fe3+促进效果较为显著,能够使产率达到93 %.然而Cu2+的加入,抑制了N-丁基苯甲酰胺的生成,使产率降低.
|
|
表 6 金属离子对反应的影响 Table 6 The influence of metal ions on reaction |
通过绿色环保的方法氧化苯甲醇,以有机胺盐为氮源,高效合成了苯甲酰胺类化合物,通过气质联用色谱仪研究不同条件对反应的影响,从而优化出较佳的反应条件为:丁胺盐酸盐为氮源,NaI/Fe3+为催化剂,氧化剂TBHP的物质的量为苯甲醇的5倍,碱性试剂BaCO3的物质的量为苯甲醇的2倍,苯甲醇的转化率为100%,产物N-丁基苯甲酰胺的产率为93%.
| [1] |
ISHIHARA K, OHARA S, YAMAMOTO H. 3, 4, 5-Trifluorobenzeneboronic acid as an extremely active amidation catalyst[J]. J Org Chem, 1996, 61(13): 4196-4197. DOI:10.1021/jo9606564 (  0) 0) |
| [2] |
GOTOR V. Non-conventional hydrolase chemistry: amide and carbamate bond formation catalyzed by lipases[J]. Bioorg Med Chem, 1999, 7(10): 2189-2197. DOI:10.1016/S0968-0896(99)00150-9 (  0) 0) |
| [3] |
PATCHETT A A. Excursions in drug discovery[J]. Med Chem, 1993, 36(15): 2051-2058. DOI:10.1021/jm00067a001 (  0) 0) |
| [4] |
HIROYUKI M, RISA F, YUHEI S, et al. Lanthanum(Ⅲ) triflate catalyzed direct amidation of esters[J]. Org Lett, 2014, 16(7): 2018-2021. DOI:10.1021/ol500593v (  0) 0) |
| [5] |
RANTWIJK F V, HACKING M A, SHELDON R A. Lipase-catalyzed synthesis of carboxylic amides: nitrogen nucleophiles as acyl acceptor[J]. Monatsh Chem, 2000, 131(6): 549-569. DOI:10.1007/s007060070086 (  0) 0) |
| [6] |
TOBIAS J, SHERBOW E L D, RICHARD I S, et al. Investigation of 1, 3, 5-triaza-7-phosphaadamantane-stabilized silver nanoparticles as catalysts for the hydration of benzonitriles and acetone cyanohy drin[J]. ACS Catal, 2014, 4(9): 3096-3104. DOI:10.1021/cs500830s (  0) 0) |
| [7] |
CHEN W, LI K B, HU Z Q, et al. Utility of dysprosium as a reductant in coupling reactions of acyl chlorides: the synthesis of amides and diaryl-substituted acetylenes[J]. Organometallics, 2011, 30(7): 2026-2030. DOI:10.1021/om200080f (  0) 0) |
| [8] |
KOLAKOWSKI R V, SHANGGUAN N, SAUERS R R, et al. Mechanism of thio acid/azide amidation[J]. J Am Chem Soc, 2006, 128(17): 5695-5702. DOI:10.1021/ja057533y (  0) 0) |
| [9] |
MUTHAIAH S, GHOSH S C, JEE J E, et al. Direct amide synthesis from either alcohols or aldehydes with amines: activity of Ru(Ⅱ) hydride and Ru(0) complexes[J]. J Org Chem, 2010, 75(9): 3002-3006. DOI:10.1021/jo100254g (  0) 0) |
| [10] |
ZHU M W, KENICHI F, RYOHEI Y. Aerobic oxidative amidation of aromatic and cinnamic aldehydes with secondary amines by CuI/2-pyridonate catalytic system[J]. J Org Chem, 2013, 77(20): 9102-9109. (  0) 0) |
| [11] |
ZHOU B, DU J J, YANG Y X, et al. Rhodium(Ⅲ)-catalyzed intermolecular direct amidation of aldehyde C-H bonds with N-chloroamines at room temperature[J]. Org Lett, 2013, 15(12): 2934-2937. DOI:10.1021/ol400921r (  0) 0) |
| [12] |
BANTREIL X, KANFAR N, GEHIN N, et al. Inron-catalyzed benzamide formation:application to the synthesis of moclobemide[J]. Tetrahedron, 2014, 70(34): 5093-5099. DOI:10.1016/j.tet.2014.06.001 (  0) 0) |
| [13] |
RAJENDER R, UMA M, VENKATESHWAR M, et al. Oxidative amidation of aldehydes and alcohols with primary amines catalyzed by KI-TBHP[J]. Eur J Org Chem, 2008, 21: 3619-3622. (  0) 0) |
| [14] |
WANG N W, LIU R H, CHEN J P, et al. NaNO2-activated, iron-TEMPO catalyst system for aerobic alcohol oxidation under mild conditions[J]. Chem Commun, 2005, 37(42): 5322-5324. (  0) 0) |
 2017, Vol. 49
2017, Vol. 49


