2. 郑州大学 药学院 河南 郑州 450001
2. School of Pharmaceutical Sciences, Zhengzhou University, Zhengzhou 450001, China
植物激素是一类天然存在的信号分子,在细胞分裂、分化和生长、种子休眠和萌发、植物发育、结果和衰老等方面起着至关重要的作用。根据其多样性和生物学功能,植物激素主要包括乙烯、生长素类(auxins,AXs)、细胞分裂素(cytokinins,CKs)、赤霉素类(gibberellins,GAs)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)和油菜素类固醇等。尽管每类植物激素都有其特定的生物学功能,但它们通常利用协同作用或拮抗作用来共同调节植物对生物和非生物的胁迫反应。越来越多的研究表明植物激素信号在植物生命周期中参与复杂的相互作用[1]。植物激素由于存在于复杂的生物基质中,且浓度较低,化学性质多样,例如,吲哚乙酸(indole acetic acid,IAA)、ABA、SA和赤霉素(gibberellin,GA3)显酸性,而玉米素(zeatin,ZT)显碱性,这使得对它们的分析相当具有挑战性,需要对不同种类的植物激素进行快速通用的样品预处理及分析方法的开发和验证。目前测定植物内源激素的方法主要有气相色谱法(gas chromatography,GC)[2]、毛细管电泳法[3]、酶联免疫法[4]、液相色谱法(liquid chromatography,LC)[5]和液相色谱-质谱联用法(liquid chromatography-mass spectrometry,LC-MS)[6]等,其中LC-MS联用法由于具有灵敏、高效、准确的优点,是目前植物激素检测方法开发的方向。
地黄是一种传统的玄参科中药材,含有丰富的糖和环烯醚萜类物质,其活性成分对免疫系统、内分泌系统、血液系统、神经系统和心血管系统等具有广泛的药理作用[7-8]。关于地黄药理、药效和活性成分的研究已有大量报道,而关于地黄在自然生长状态下的不同器官中获得的植物激素的内源性变化的研究较少。本研究旨在建立一种基于LC-MS的同时检测地黄中5类激素中5种不同酸碱性内源植物激素的方法,定量分析地黄生长过程中叶片和块茎中ABA、SA、IAA和ZT含量的变化,以期增进对植物激素作用机制的了解,并在合理范围内使用以提高地黄的药用价值的研究。
1 实验部分 1.1 材料、试剂与仪器地黄采自焦作市的试验田,其在6月移植,10月收获。期间分别在苗期(6月23日、7月31日)、拉线期(8月24日)、快速增长期(9月17日)、成熟期(10月12日)取样,每次收集同一片土地上长势相近的8个样品。将样品的叶和块茎分开并用清水冲洗,然后冷冻干燥保存在-80 ℃。
标准品(IAA、ZT、GA3、SA、ABA)和内标(苯甲酸)购自Sigma公司;甲酸(优级纯)、乙酸(优级纯)、甲醇(色谱纯)、乙腈(色谱纯)购自Merck公司;乙酸乙酯(分析纯)购自天津市科密欧化学试剂有限公司。C18(Supelclean LC-18)固相萃取(solid-phase extraction,SPE)柱(500 mg,3 mL)购自Sigma公司;Oasis MAX、MCX和HLB SPE柱(60 mg,3 mL)购自Waters公司。实验用水均为Milli-Q超纯水机制备的超纯水。
HPLC-MS(Waters,美国):2695高效液相色谱仪,2996光电二极管阵列(photo-diode array,PDA)检测器;Q-TOF MicroTM质谱仪;MassLynx V4.1软件系统。
1.2 地黄样品的提取将冻干的地黄样品研磨成粉末,称取2 g样品用20 mL预冷的甲醇/水(体积比80 ∶ 20)在4 ℃条件下萃取12 h,在萃取之前,将内标(1 μg/mL的苯甲酸)添加到每个样品中。将第一次萃取的残余物用10 mL萃取溶剂萃取2 h,合并第一次萃取液在40 ℃旋蒸除去甲醇。之后,12 000 rpm下离心10 min,吸取上清液,用水将上清液体积调至4 mL后,加入8 mL石油醚除色素。萃取分离后,用HCl调节水相的pH值至2.5后,加入两倍体积的乙酸乙酯超声5 min并萃取激素。酸式提取后,用NH3·H2O将水相的pH值调节至9,重复相同的步骤,合并酯相,于40 ℃下旋蒸至干。叶片提取物用200 μL甲醇复溶,经0.22 μm有机滤膜过滤后进样分析。块茎提取物复溶于2 mL甲醇/水(体积比20 ∶ 80)中,然后进行SPE纯化步骤,见1.3。
1.3 SPE纯化地黄块茎提取物C18 SPE柱纯化方法:3 mL甲醇、3 mL水活化小柱,2 mL 80 %的甲醇溶液平衡小柱。将块茎粗提取液用HCl调节其pH值至5.6上样。用8 mL含0.075%的乙酸/水(体积比95∶5)的甲醇洗脱,收集洗脱液在40 ℃蒸干,200 μL甲醇复溶,经0.22 μm有机滤膜过滤后进样分析。
MAX SPE柱纯化方法:3 mL甲醇、3 mL水活化小柱,直接将块茎粗提取液上样,用3 mL的5 mmol/L乙酸铵洗涤除杂。用4 mL含2%甲酸的甲醇溶液洗脱目标物,将洗脱液在40 ℃蒸干后于200 μL甲醇中复溶,经0.22 μm有机滤膜过滤后进样分析。
1.4 色谱-质谱仪器分析条件色谱柱为Agilent C18色谱柱(4.6 mm × 250 mm,5 μm);流动相为甲醇(A)和0.001%的甲酸水溶液(B);梯度洗脱程序为0~5 min,40%~60% A;5~10 min,60% A;10~15 min,60%~80% A;15~20 min,80%~40% A。流速为1 mL/min;柱后分流比为4∶1。进样量为10 μL;柱温为30 ℃。电离方式:ESI电离源,负离子模式;毛细管电压2.7 kV;锥孔电压20 V,离子源温度80 ℃,脱溶剂氮气温度180 ℃,碰撞电压5 V,扫描范围m/z 100~500,锥孔气流速50 L/h,脱溶剂气流速380 L/h。所选定量离子如下:ZT,m/z 218;GA3,m/z 345;SA,m/z 137;IAA,m/z 174;ABA,m/z 263。
2 结果分析与讨论 2.1 实验条件的优化 2.1.1 地黄块茎粗提物的纯化方法由于地黄块茎粗提取物中含有大量的有机物干扰植物激素的测定,为降低基质效应,本文比较了4种SPE小柱的纯化效率。其中C18和MAX SPE柱纯化方法见1.3,HLB联合MCX柱的纯化方法见文献[9],MAX联合MCX柱的纯化方法见文献[10]。在样品中分别加入混标(0.5 μg/mL)和内标(0.25 μg/mL),通过比较4种SPE方法获得的各激素与内标的相对峰面积发现,5种植物激素的响应信号在C18 SPE柱上得到显著提高(表 1),因此选择C18小柱纯化样品。
|
|
表 1 植物激素在不同固相萃取小柱纯化方法下的响应值 Tab. 1 The response of the five phytohormones on four candidate SPE methods |
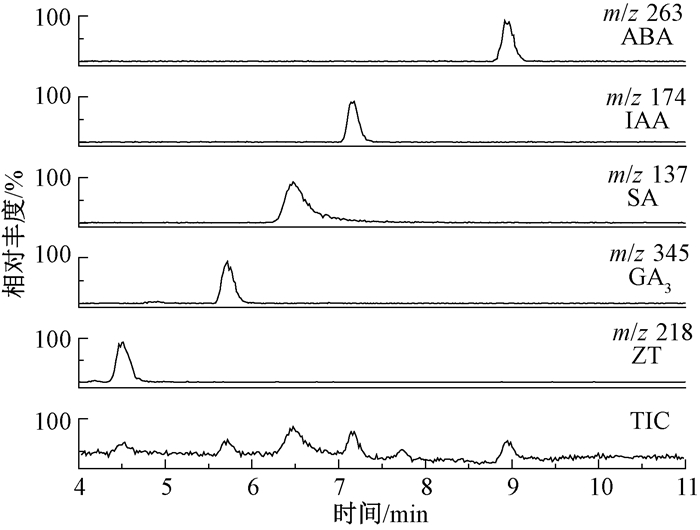
以甲醇(A)和水(B)作流动相,选择不同流动相体积比对激素进行洗脱,结果发现,在等度洗脱条件下,激素难以分离且分离时间较长,而采用梯度洗脱,可在20 min内完成对样品的分离。缓冲液中酸的存在可以抑制酸性激素的解离,从而改善峰的对称性和分离度,故选择比较了水(B)中甲酸含量为0.001%、0.01%、0.1%时的分离效果。结果发现,当水中甲酸含量为0.001%时,植物激素能获得更好的分离效果及检测灵敏度。图 1是在1.4分析条件下得到的地黄叶片提取物中5种植物激素的LC-MS总离子流图(total ion current,TIC)和相应的提取离子流图(extracted ion current,EIC)。
|
图 1 地黄叶提取物的LC-MS的TIC和其中5种植物激素的EIC Fig. 1 LC-MS TIC chromatogram and the corresponding EIC chromatograms of the five phytohormones in a leave sample |
在优化条件下,对该LC-MS方法的线性范围、检出限(limit of detection,LOD)、定量限(limit of quantitation,LOQ)、精密度和回收率进行了验证(表 2)。用混合标准储备液逐级稀释配制标准曲线所需的浓度,由表 2可见,线性相关系数在0.995 9~0.999 2之间,线性关系良好。以混合标准储备液稀释至信噪比(signal-noise ratio,S/N)为3时为检出限,S/N=10时为定量限,得到检出限范围为0.013~0.038 μg/mL,定量限范围为0.043~0.127 μg/mL。对重复性的验证得到日内和日间精度:日内和日间相对标准偏差(relative standard deviation,RSD)范围分别是1.7%~3.2%和3.0%~10.5%(n=3),表明该方法具有较好的可重复性。对回收率的测定分别在叶片和块茎中进行:取2 g植物样品作为空白,分别加入相同体积的水(空白)和各目标激素浓度均为1 μg/mL的混标,经预处理后进样分析,重复3次操作,测得的样品加标浓度扣除空白对照浓度后,除以所加标准品浓度得到加标回收率,所测块茎和叶中5种植物激素的回收率范围分别是78.4%~96.7%和81.9%~106.7%,满足方法准确性要求。
|
|
表 2 植物激素的线性范围、回归方程、相关系数、检出限、定量限、精密度和回收率 Tab. 2 The linear range, regression equation, correlation coefficient, limit of detection, limit of quantitation, precision and recovery of analytes for the target phytohormones |
按照1.2~1.4方法对地黄生长期中叶片和块茎中的5种植物激素进行了跟踪检测,在叶片中可检测到全部目标植物激素,而块茎中未检出GA3(推测块茎中的GA3浓度在定量限下),因此我们对地黄生长期中叶片和块茎中的除GA3外的其他植物激素的浓度进行了比较分析,结果见表 3。
|
|
表 3 地黄中4种内源性激素的动态变化 Tab. 3 The dynamics of changes in endogenous amounts of 4 hormones in Rehmannia glutinosa |
生长素IAA和细胞分裂素ZT有促进叶片生长扩张的作用。由表 3可见,地黄叶片中IAA和ZT的含量在叶片生长初期含量较低,之后二者浓度逐渐增加,在七月底和八月初达到顶峰(IAA为2.218 μg/g,ZT为1.217 μg/g),这段时间叶茎逐渐伸长、叶片迅速扩张,之后,其含量下降并在8月底保持在相对稳定的水平,此时叶片生长缓慢,当其浓度在低点时,叶片生长也基本停止。SA和ABA在对外界应激中都起着重要作用[11-12],由表 3可见,从叶片成熟到脱落,叶片中ABA含量在整个生长过程中呈下降趋势,SA的含量总体呈下降趋势(在8月底和10月底稍有波动),二者均在9月底达到较低水平,并保持稳定状态到最后。推测种子播种初期叶片中SA和ABA的含量高有利于植物对抗新生长环境的影响,因为第一次采集时间6月底正是将地黄从室内移植到炎热干旱的外界自然环境中时间,由于环境条件变化大,叶片中的SA和ABA的抗性在移植初期达到最高水平,之后植物叶片抗性减弱,可检测到SA和ABA含量也在降低,到最后阶段含量稳定。
在块茎的发育过程中IAA和ZT的浓度近似保持稳定状态,根系呈持续生长的状态(表 3)。ABA的浓度从苗期到拉线期均呈上升趋势,此后逐渐下降,在最后阶段保持稳定直到果实成熟,这种行为与报道[13]中对洋姜的研究结果一致,即低ABA含量增高可能对块茎生长有利。由此推测ABA不仅能调节对环境胁迫的反应,还能控制茎的生长,刺激块茎的萌发。此外,块茎中SA和ABA的浓度在地黄生长的苗期(7月31日)到成熟期(10月12日)表现出相似的先增高后降低的趋势,这表明SA和ABA对地黄块茎的生长有着协同的作用。
植物的不同器官对激素的敏感性受多种因素的影响,如植物体内受体的种类和含量、细胞对激素的通透性及其代谢周转速率等。地黄块茎中生长素IAA的浓度在4个发育时期均低于叶片中的含量,这可能是因为块茎的发育对IAA的含量更敏感。块茎中与植物抗性有关的ABA和SA的含量也低于叶片,这可能是因为块茎是储存器官,不需要参与大量的代谢活动的原因(在马铃薯植株中也检测到类似的模式[14])。在地黄的整个发育期中块茎和叶中IAA和ZT的整体含量较低,呈现出较小的变化,而ABA和SA的含量较高,呈现出显著的变化,不仅浓度变化范围宽,并且有相似的变化趋势,由此可见,ABA和SA对植物抗性和块茎形成可能有一定的协同作用。有报道表明,在使用寄生植物感染的番茄中,在宿主-寄生相互作用的初始阶段,SA和ABA的含量均增加[15],显示出SA和ABA对生物应激的协同抗性作用,同时也有报道SA和ABA对外界应激(包括生物应激和非生物应激)表现出拮抗作用[16],由此可见SA-ABA在植物中作用机制的复杂性,需要更深一步的研究。
3 结论本文建立了一种同时分析地黄组织中的5种不同酸/碱性的内源性植物激素(生长素、脱落酸、细胞分裂素、赤霉素和水杨酸)的LC-MS方法,对在不同的生长时期地黄叶片和块茎中植物激素的水平进行了检测和差异性比较,初步分析了含量动态变化的可能成因。由于内源激素水平可以协调内在的发育过程并传达环境信息,这项工作有助于理解植物激素在生理过程中的串扰,以及有助于在地黄不同发育阶段,通过使用外源生长调节剂来调节植物体内激素的水平来影响块茎生长、产量和质量的研究。
| [1] |
VANSTRAELEN M, BENKOVÁ E. Hormonal interactions in the regulation of plant development[J]. Annual review of cell and developmental biology, 2012, 28: 463-487. DOI:10.1146/annurev-cellbio-101011-155741 (  0) 0) |
| [2] |
RAWLINSON C, KAMPHUIS L G, GUMMER J P A, et al. A rapid method for profiling of volatile and semi-volatile phytohormones using methyl chloroformate derivatisation and GC-MS[J]. Metabolomics, 2015, 11(6): 1922-1933. DOI:10.1007/s11306-015-0837-0 (  0) 0) |
| [3] |
郭振朋, 王晓瑜, 陈义. 反向电渗流非水毛细管电泳法快速测定微量赤霉素[J]. 色谱, 2017, 35(1): 65-69. GUO Z P, WANG X Y, CHEN Y. Rapid determination of micro gibberellins by non-aqueous capillary electrophoresis with reversed electroosmotic flow[J]. Chinese journal of chromatography, 2017, 35(1): 65-69. (  0) 0) |
| [4] |
李先恩, 孙鹏, 祁建军, 等. 地黄栽培种与野生种内源激素含量的差异[J]. 作物学报, 2013, 39(7): 1276-1283. LI X E, SUN P, QI J J, et al. Changes of hormones in cultivars and wild-type varieties of rehmannia glutinosalibosch[J]. Acta agronomica sinica, 2013, 39(7): 1276-1283. (  0) 0) |
| [5] |
肖爱华, 陈发菊, 贾忠奎, 等. 梯度洗脱高效液相色谱法测定红花玉兰中4种植物激素[J]. 分析试验室, 2020, 39(3): 249-254. XIAO A H, CHEN F J, JIA Z K, et al. Determination of 4 plant hormones in Magnolia wufengensis by gradient elution high performance liquid chromatography[J]. Chinese journal of analysis laboratory, 2020, 39(3): 249-254. (  0) 0) |
| [6] |
陈千思, 卢紫舒, 沈少君, 等. HPLC-MS/MS法测定烟叶中7种植物内源激素[J]. 烟草科技, 2018, 51(11): 51-57. CHEN Q S, LU Z S, SHEN S J, et al. Determination of seven endogenous phytohormones in tobacco by high performance liquid chromatography-tandem mass spectrometry[J]. Tobacco science & technology, 2018, 51(11): 51-57. (  0) 0) |
| [7] |
李路易, 梁冬雨, 易清清, 等. 地黄单体梓醇促成骨细胞分化的活性研究[J]. 医药导报, 2020, 39(4): 533-537. LI L Y, LIANG D Y, YI Q Q, et al. Study on the activity of catalpol from Rehmannia glutinosa to promote the osteogenic differentiation[J]. Herald of medicine, 2020, 39(4): 533-537. (  0) 0) |
| [8] |
彭辉. 地黄多糖对心肌缺血再灌注损伤大鼠保护作用研究[J]. 辽宁中医药大学学报, 2016, 18(6): 39-42. PENG H. Protection of Rehmannia glutinosa polysaccha-rides on rats with myocardial ischemia-reperfusion injury[J]. Journal of Liaoning university of traditional Chinese medicine, 2016, 18(6): 39-42. (  0) 0) |
| [9] |
IZUMI Y, OKAZAWA A, BAMBA T, et al. Development of a method for comprehensive and quantitative analysis of plant hormones by highly sensitive nanoflow liquid chromatography-electrospray ionization-ion trap mass spectrometry[J]. Analytica chimica acta, 2009, 648(2): 215-225. DOI:10.1016/j.aca.2009.07.001 (  0) 0) |
| [10] |
LIU S C, CHEN W Q, QU L, et al. Simultaneous determination of 24 or more acidic and alkaline phytohormones in femtomole quantities of plant tissues by high-performance liquid chromatography-electrospray ionization-ion trap mass spectrometry[J]. Analytical and bioanalytical chemistry, 2013, 405(4): 1257-1266. DOI:10.1007/s00216-012-6509-2 (  0) 0) |
| [11] |
夏方山, 毛培胜, 闫慧芳, 等. 水杨酸对植物种子及幼苗抗逆性的影响[J]. 草业科学, 2014, 31(7): 1367-1373. XIA F S, MAO P S, YAN H F, et al. Effects of salicylic acid on stress resistance of seeds and seedling[J]. Pratacultural science, 2014, 31(7): 1367-1373. (  0) 0) |
| [12] |
FLORS V, TON J, VAN DOORN R, et al. Interplay between JA, SA and ABA signalling during basal and induced resistance against Pseudomonas syringae and Alternaria brassicicola[J]. The plant journal, 2008, 54(1): 81-92. (  0) 0) |
| [13] |
LI L L, SHAO T Y, YANG H, et al. The endogenous plant hormones and ratios regulate sugar and dry matter accumulation in Jerusalem artichoke in salt-soil[J]. Science of the total environment, 2017, 578: 40-46. DOI:10.1016/j.scitotenv.2016.06.075 (  0) 0) |
| [14] |
KOLACHEVSKAYA O O, SERGEEVA L I, FLOKOVÁ K, et al. Auxin synthesis gene tms1 driven by tuber-specific promoter alters hormonal status of transgenic potato plants and their responses to exogenous phytohormones[J]. Plant cell reports, 2017, 36: 419-435. DOI:10.1007/s00299-016-2091-y (  0) 0) |
| [15] |
TORRES-VERA R, GARCÍA J M, POZO M J, et al. Expression of molecular markers associated to defense signaling pathways and strigolactone biosynthesis during the early interaction tomato-Phelipanche ramosa[J]. Physiological and molecular plant pathology, 2016, 94: 100-107. DOI:10.1016/j.pmpp.2016.05.007 (  0) 0) |
| [16] |
MOEDER W, UNG H, MOSHER S, et al. SA-ABA antagonism in defense responses[J]. Plant signaling & behavior, 2010, 5(10): 1231-1233. (  0) 0) |
 2021, Vol. 53
2021, Vol. 53

