| 肝癌TACE术后CDFI血流信号分级与CT增强扫描表现及生存时间的关系 |
2. 江苏省南通市肿瘤医院病案室,江苏 南通 226361
原发性肝细胞癌是我国常见的恶性肿瘤,发病隐匿,多数患者就诊时已失去手术切除机会[1]。2017年肝癌诊疗指南中指出,对于高龄、严重肝硬化、肿瘤数目多、巨大无法完整切除、术后无法保留足够功能代偿肝组织、血管侵犯、肝外转移等患者,经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是首选治疗方案[2]。CDFI可提供肿瘤血供信息,评价肝癌TACE术后疗效[3]。然而,超声评价TACE后预后研究较少。本研究分析肝癌患者TACE术后肿瘤的CDFI血流信号,并与CT增强扫描对比,随访患者生存时间,以探讨超声在肝癌TACE术后评估中的作用。
1 资料与方法 1.1 一般资料回顾性分析我院2013年6月至2014年6月行TACE治疗且资料完整的肝癌患者38例,其中男25例,女13例;年龄34~77岁,平均(58±12)岁。均经临床、超声、CT、AFP及其他检查确诊,纳入标准:Ⅱb期、Ⅲa期或Ⅲb期患者,肝功能分级Child-Pugh A或B级;肝肾功能正常;影像学图像清晰;随访资料完整。排除标准:肝功能严重障碍(Child-Pugh C级),包括黄疸、肝性脑病、难治性腹水或肝肾综合征;凝血功能严重减退,且无法纠正;门静脉主干完全被癌栓栓塞,且侧支血管形成少;合并活动性肝炎或严重感染且同时治疗者;肿瘤远处广泛转移,估计生存期<3个月者;恶病质或多器官功能衰竭;肾功能障碍;图像不清晰者;治疗期间接受消融者;对比剂过敏者,失随访者。肿瘤均为单发,最大径5.2~14.5 cm;位于肝左叶17例,右叶21例;Ⅱb期11例,Ⅲa期23例,Ⅲb期4例。行1次TACE治疗2例,2次14例,3次及以上22例。
1.2 TACE方法采用Seldinger插管法行腹腔动脉或肝总动脉造影,明确肿瘤位置、供血血管。将导管超选择置入肿瘤供血动脉,注入以下化疗药物中的3种(吡柔比星10~30 mg、5-氟尿嘧啶500~1 000 mg、奥沙利铂50~100 mg、顺铂30~40 mg),超液态碘油5~15 mL与化疗药混合,在荧光透视下注入。完毕用明胶海绵颗粒(350~560 μm)栓塞供血动脉,术后给予对症治疗,间隔1个月,再进行下一次治疗。
1.3 超声检查末次TACE术后1~6个月内行超声检查。超声、CT检查同期(间隔时间1周内),若先行CT增强扫描,超声隔天进行。多次检查以末次检查纳入研究。使用Philips IU22超声仪,探头频率3~5 MHz。检查前禁食、空腹8 h以上,常规检查肝胆脾胰腹腔等部位,着重了解肝脏有无慢性肝病、肝硬化、肿瘤位置、结节数目、最大径、包膜、声晕、内部血流信号情况,以及门静脉是否存在瘤栓、腹腔是否有转移灶等。先行二维超声检查,确定肿瘤部位,然后采用CDFI分析肿瘤内部血流信号,血流信号分为无明显血流(-)、分支状血流(+)和篮状血流(++)[4]。
1.4 CT检查CT随访根据患者对TACE的耐受程度、治疗反应及肝功能变化进行,通常于末次TACE后1~6个月行CT扫描[5]。多次检查以末次检查纳入研究。采用Siemens Sensation 16 CT机,扫描参数:120 kV,层距、层厚均为5 mm,先行上腹部平扫,然后经肘静脉注射碘海醇100 mL,流率3 mL/s,行动脉期(30 s)、门静脉期(60~70 s)、延迟期(120~180 s)3期扫描。观察肿瘤内部碘油沉积、增强扫描表现。
1.5 随访采用电话、信件方式随访患者生存时间。生存时间计算从肿瘤末次TACE术后超声检查开始,至患者死亡。
1.6 统计学分析采用SPSS 24.0软件,计量资料以x±s表示;CDFI血流信号分级与CT增强扫描表现比较行秩相关检验,采用Kaplan-Meier法描绘生存曲线,生存分析采用log-rank检验。以P<0.05为差异有统计学意义。
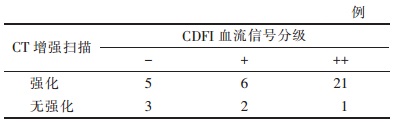
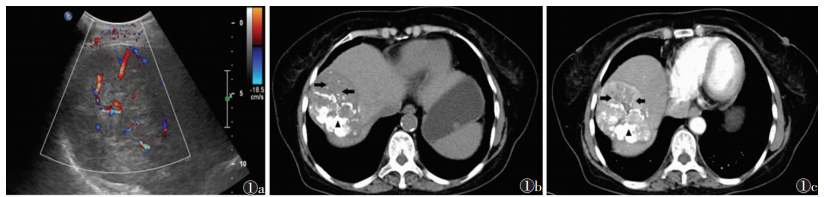
2 结果 2.1 肿瘤CDFI血流信号与CT增强扫描表现的相关性CDFI血流信号分级与CT增强扫描表现存在相关性,秩相关检验r=0.38,P=0.019。CDFI有血流信号时,CT示肿瘤内多存在强化(表 1,图 1);CDFI未见明显血流信号时,CT示肿瘤碘油沉积好(图 2)。
| 表 1 CDFI血流信号分级与CT增强扫描表现 |
 |
 |
| 图 1 男,54岁,右叶肝癌,经导管肝动脉化疗栓塞(TACE)治疗4次后3个月,生存时间12个月 图 1a CDFI示血流信号++级 图 1b CT平扫示肿瘤内局部碘油沉积 图 1c CT动脉期示不均匀碘油沉积(黑三角)及非沉积区强化(黑箭) |
 |
| 图 2 男,63岁,右叶肝癌,TACE治疗6次后2个月,生存时间32个月 图 2a CDFI示内部无明显血流信号(-级) 图 2b CT平扫示肿瘤内部碘油沉积良好(▲) 图 2c CT动脉期见碘油沉积较好,无明显强化 |
2.2 不同血流信号分级患者生存时间比较
CDFI血流分级为“-”的患者生存时间36~48个月,平均(39±8)个月,中位生存期38个月;“+”患者生存时间18~34个月,平均(27±9)个月,中位生存期29个月;“++”患者生存时间8~32个月,平均(18±8)个月,中位生存期17个月;血流信号分级高者,生存时间短,不同CDFI血流信号分级患者的生存时间差异有统计学意义(χ2=19.36,P<0.000 1)(图 3)。
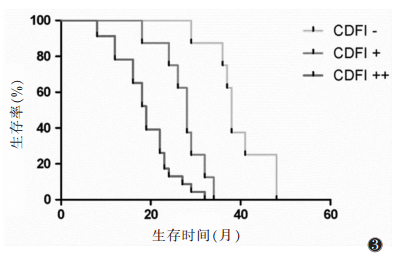 |
| 图 3 3组生存时间曲线 |
3 讨论
CT是肝癌TACE术后目前广泛采用的随访方法,增强扫描能准确反映肿瘤血供的丰富程度,评估肿瘤是否存在活性[5],对肝癌TACE术后疗效及其残灶活性的评估有重要作用[6]。TACE术后肝癌复发病理表现为肿瘤内新生肿瘤血管形成,与动脉栓塞不完全、侧支循环形成、动脉-门脉分流有关[7]。但有研究[8-9]认为,碘油在CT上呈致密高密度,可能会影响增强扫描后对残留肿瘤强化的观察,影响CT对疗效评价的敏感性和准确性。
CDFI可反映肝癌介入治疗后肿瘤内部及其周围血供的变化情况,评价肿瘤供血减少、消失或增加[7],为肝癌介入术后判断预后提供一种简便的影像学方法。肝癌TACE后肿瘤存在血供,表明碘油沉积差、有癌细胞残留;碘油沉积是TACE术后影响预后的独立危险因素,沉积越少,表明预后越差[10]。分子机制研究[11]表明,TACE栓塞肿瘤血管,复发灶碘油沉积差,残癌细胞血管内皮细胞生长因子分泌增强、微血管密度(MVD)表达增加。CDFI血流信号可直观地反映微血管丰富程度,宏观、无创评价肝癌的发生发展[12]。肝癌CDFI血流信号分级与MVD表达相关,CDFI分级较高者,MVD表达较高、预后较差[13-14]。本研究随访结果显示,CDFI分级与生存时间有相关性,肝癌患者TACE术后血流信号阴性者,平均生存时间较长,血流信号分级高者,平均生存时间较短(χ2=19.36,P<0.000 1)。本研究中CDFI血流信号分级与CT增强扫描表现存在相关性(秩相关检验r=0.38,P=0.019),肿瘤内超声检查有血流信号者,CT动脉期也多强化。
总之,虽然CDFI可显示肿瘤内血供信息,但仍存在一些缺陷,如角度依赖性、混叠效应、对缓慢血流不敏感;碘油沉积的高密度也可产生声影,干扰对血流信号的评估,以致部分肝癌TACE术后CDFI血流信号出现假阴性。本研究中5例CT增强扫描可见强化,而CDFI血流信号为阴性。MRI多平面立体成像对比度较高[5],可对原发性肝癌TACE术后疗效进行更精确的评估。同时超声造影可显示肿瘤微血管[15],弥补CDFI的不足,今后可运用超声造影检查肝肿瘤,并进行更精细研究,以更好评价超声在肝癌TACE术后随访评估中的作用。
| [1] |
周进, 方丽, 谢华, 等. 索拉非尼治疗原发性肝癌的疗效与血清b-FGF水平的相关性研究[J]. 四川医学, 2017, 38(1): 4-6. |
| [2] |
李照, 朱继业. 《原发性肝癌诊疗规范(2017年版)》解读[J]. 临床肝胆病杂志, 2017, 33(9): 1655-1657. DOI:10.3969/j.issn.1001-5256.2017.09.006 |
| [3] |
时正义. 影像学检查在原发性肝癌TACE术后疗效评价中的应用价值及进展[J]. 华夏医学, 2011, 24(6): 746-749. DOI:10.3969/j.issn.1008-2409.2011.06.047 |
| [4] |
Tanaka S, Kitamura T, Fujita M, et al. Color Doppler flow imaging of liver tumors[J]. AJR, 1990, 154: 509-514. DOI:10.2214/ajr.154.3.2154912 |
| [5] |
Du F, Jiang R, Gu M, et al. The clinical application of 320-detector row CT in transcatheter arterial chemoembolization (TACE) for hepatocellular carcinoma[J]. Radiol Med, 2015, 120: 690-694. DOI:10.1007/s11547-015-0523-3 |
| [6] |
孙伟, 李忱瑞. CT对肝癌TACE术后疗效及其残灶活性的评估作用分析[J]. 中国CT和MRI杂志, 2015, 13(5): 77-79, 106. DOI:10.3969/j.issn.1672-5131.2015.05.024 |
| [7] |
刘健, 黄道中, 胡道予. 超声评价原发性肝癌肝动脉化疗栓塞后疗效的价值及前景[J]. 放射学实践, 2005, 20(12): 1106-1108. DOI:10.3969/j.issn.1000-0313.2005.12.023 |
| [8] |
王月波, 陈加源. CT及MRI对原发性肝癌经导管肝动脉化疗栓塞术后疗效评估的对比[J]. 实用医学杂志, 2017, 33(18): 3110-3114. DOI:10.3969/j.issn.1006-5725.2017.18.034 |
| [9] |
庄广义, 任伟新, 迪里木拉提·巴吾冬, 等. 原发性肝癌TACE术后CT和DSA随访对比分析[J]. 介入放射学杂志, 2009, 18(12): 942-945. DOI:10.3969/j.issn.1008-794X.2009.12.018 |
| [10] |
吕嘉玲, 杜端明, 刘鹏程, 等. 肝动脉化疗栓塞治疗原发性肝癌的预后因素分析[J]. 实用放射学杂志, 2012, 28(1): 114-118. DOI:10.3969/j.issn.1002-1671.2012.01.030 |
| [11] |
邵国良, 王建华, 周康荣, 等. 肝动脉化疗栓塞对肝癌肿瘤新生血管生成及血管内皮细胞生长因子表达的影响[J]. 中华肝脏病杂志, 2002, 10(3): 170-173. DOI:10.3760/j.issn:1007-3418.2002.03.003 |
| [12] |
肖际东, 沈守荣, 朱文晖, 等. 彩色多普勒超声检测肝癌血流及其与MVD、VEGF表达的关系[J]. 中国医学影像技术, 2007, 23(6): 884-887. DOI:10.3321/j.issn:1003-3289.2007.06.029 |
| [13] |
张璟卓, 刘颖, 马艳艳. 超声检测肝癌血流分级及其与HIF-1α、MVD表达的关系[J]. 世界华人消化杂志, 2014, 22(11): 1587-1591. |
| [14] |
吴名凤, 沈智勇, 蒋晓娟. 超声评估原发性肝癌患者预后的Cox比例风险回归模型分析[J]. 中华实用诊断与治疗杂志, 2015, 29(2): 204-205. |
| [15] |
Liu M, Lin MX, Lu MD, et al. Comparison of contrast-enhanced ultrasound and contrast-enhanced computed tomography in evaluating the treatment response to transcatheter arterial chemoemb-olization of hepatocellular carcinoma using modified RECIST[J]. Eur Radiol, 2015, 25: 2502-2511. DOI:10.1007/s00330-015-3611-9 |
 2020, Vol. 18
2020, Vol. 18


