| CT影像组学预测肝内胆管细胞癌术后生存状态的价值 |
肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)是发生于二级胆管分支和周围分支的高度侵袭性恶性肿瘤,占肝脏原发肿瘤的5%~30%,发病率仅次于肝细胞肝癌,死亡率较高[1-4]。近年来,影像组学通过从图像中提取和挖掘大量定量特征,在肿瘤组织学分层、肿瘤分级或分期、预后评估疗效评价方面显示出较高价值[5-7]。此外,列线图作为一种可靠的预测工具已被广泛应用,其可通过纳入临床资料的定量风险因素评估肿瘤[6, 8-9]。因此,本研究使用结合CT增强扫描图像的影像组学列线图预测ICC患者的术后生存状态,并指导临床治疗。
1 资料与方法 1.1 一般资料回顾性分析2011年1月至2022年5月我院确诊为ICC并行手术治疗127例患者的临床及CT资料。127例中2011年1月至2018年12月共收治96例,其中男女比例约1.18∶1(男52例,女44例),平均年龄(61.135±9.685)岁;无症状59例,腹部不适31例,胆管梗阻4例,发热或消瘦2例。96例按照7∶3的比例随机分为训练集(68例)和测试集(28例)。2019年1月至2022年5月收治的31例ICC患者作为外部验证集。对127例患者进行随访,统计生存期。
1.2 仪器与方法使用东芝16层CT、GE 64层CT (Revolution EVO)或Philips 256层CT进行检查。扫描参数:120 kV, 130 m As,层厚、层距均为5 mm,螺距1.0。增强扫描使用高压注射器注射碘对比剂,分别于注射后30、90 s扫描。
1.3 图像预处理及肿瘤的勾画在提取组学特征之前,进行图像重采样和灰度标准化。由1名腹部放射科医师使用ITK-SNAP软件在每层轴向动脉期和门静脉期图像上勾勒出肿瘤边界,由另1名资深腹部放射科医师验证。2名医师均知道病理结果。基于分割的肿瘤ROI,使用人工智能工具包3.0版分别从动脉期和门静脉期CT图像中提取组学特征,包括一阶特征、形状特征、灰度共生矩阵(GLCM)特征、灰度大小区域矩阵(GLSZM)特征、灰度游程矩阵(GLRLM)特征。
1.4 特征筛选与模型建立对每个ROI初始提取293×2个特征,使用单因素Cox回归分析从提取的图像特征中选择显著的预测因子,特征符合IBSI标准[10]。对这些特征行的相关性分析及组内相关系数计算,如果2个参数之间的相关性r > 0.9,保留1个参数纳入后期研究。然后,采用最小绝对收缩与选择算子(the least absolute shrinkage and selection operator, LASSO)Cox回归分析构建影像组学模型。使用LASSO回归分析筛选特征,并根据特征以其系数权重进行线性组合形成影像组学评分(图 1)。基于训练集影像组学评分的截断值,将患者分成高危组和低危组。
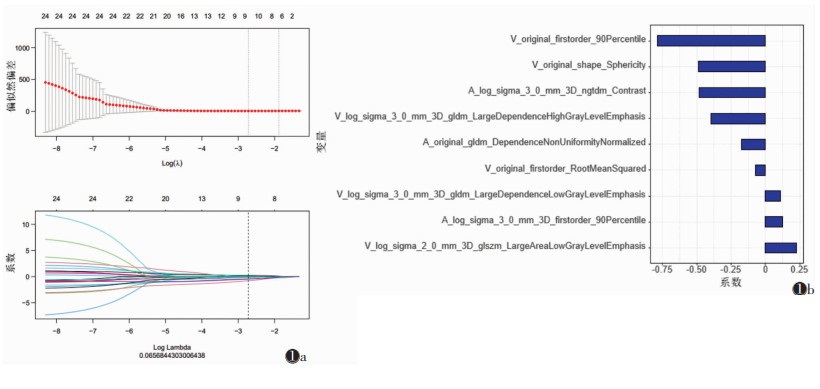 |
| 注:图 1a为最小绝对收缩与选择算子(LASSO)回归交叉验证图;图 1b为LASSO回归系数变化图 图 1 使用Cox-logistic回归模型选择影像组学特征 |
临床资料采用Cox单因素逻辑回归分析,筛选P < 0.05的临床变量,再行Cox多因素回归分析构建临床模型。多因素分析中P < 0.05的变量被确定为与生存相关的临床生存模型预测因子。
将影像组学模型的影像组学评分和临床生存模型的预测因子用于构建联合模型,并绘制列线图及校准曲线。计算Harrell的C指数以评估3种模型的预测性能。此外,绘制3种模型的决策曲线。
1.5 统计学方法使用R软件(版本4.0.2)和Python(版本3.5.6)进行数据分析。Mann-Whitney U检验和χ2检验用于确定临床病理变量值差异是否有统计学意义。以双尾P < 0.05为差异有统计学意义。Kaplan-Meier生存分析(K-M曲线)和对数秩检验(log-rank检验)分别用于分析高危组和低危组患者在测试集和外部验证集中的生存时间及其差异。
2 结果 2.1 临床特征训练集和测试集的临床特征比较,差异均无统计学意义(均P > 0.05)。单因素分析表明,年龄、腹部症状、白蛋白、球蛋白、丙氨酸氨基转移酶、血小板计数、癌胚抗原、CA125、微血管侵犯、生长形态、血管侵犯、TNM分期、手术切缘情况、手术方式及术后复发差异均有统计学意义(均P < 0.05)。多因素分析表明,血小板计数、癌胚抗原、TNM分期、手术切缘情况、术后复发差异均有统计学意义(均P < 0.05,表 1)。
| 表 1 单因素与多因素结果分析 |
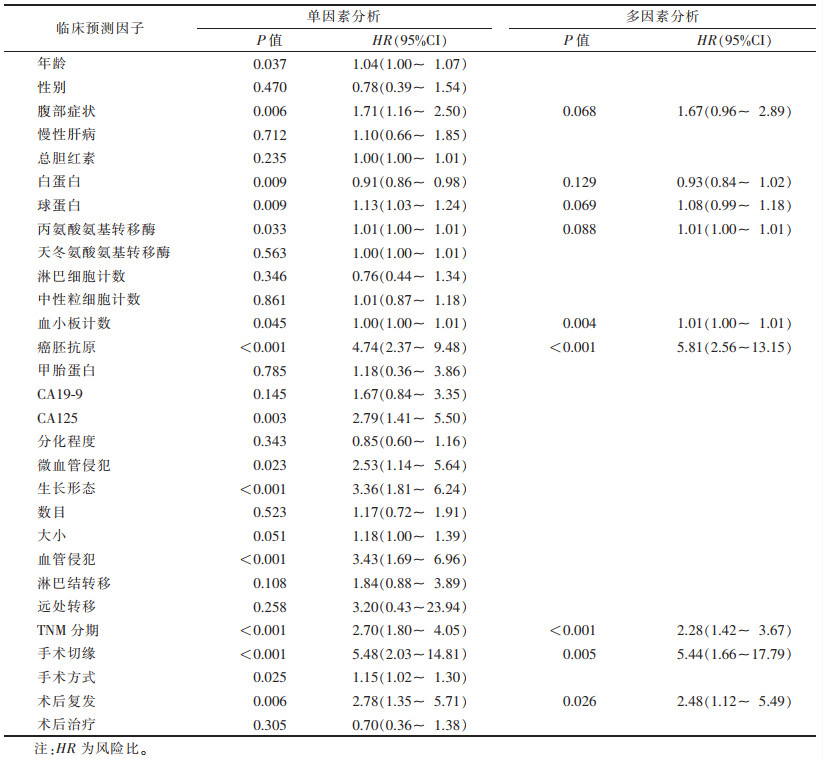 |
127例患者术后1、2、3年生存率分别为72.4%(92/127)、55.1%(70/127)和26.8%(34/127),中位生存期为26个月。
2.2 K-M曲线及结果K-M生存曲线提示,高危组与低危组之间3年总体生存期差异有统计学意义(P < 0.000 1);在影像组学模型中测试集及外部验证集P值分别为0.056 0、0.005 1;在临床模型中测试集及外部验证集P值分别为0.310 0、0.000 34;在联合模型中测试集P值为0.001,外部验证集P < 0.000 1(图 2)。
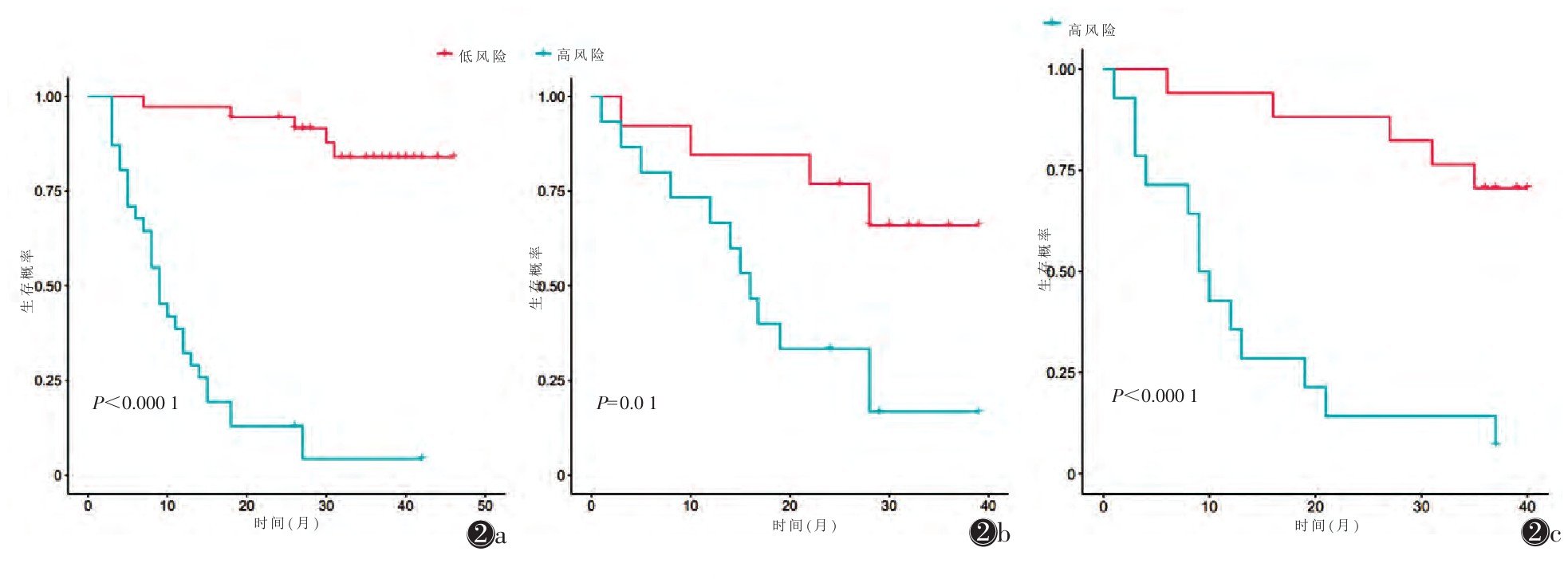 |
| 注:图 2a为训练集,图 2b为测试集,图 2c为外部验证集。图中P值为log-rank检验的P值 图 2 K-M曲线 |
2.3 模型评估
联合模型的校准曲线显示,1年总体生存期较2、3年总体生存期预测与实际生存可能性更趋于一致,2年总体生存期实际较预测可能性稍低(图 3)。3种模型的决策曲线分析联合模型优于其他方案(图 4)。
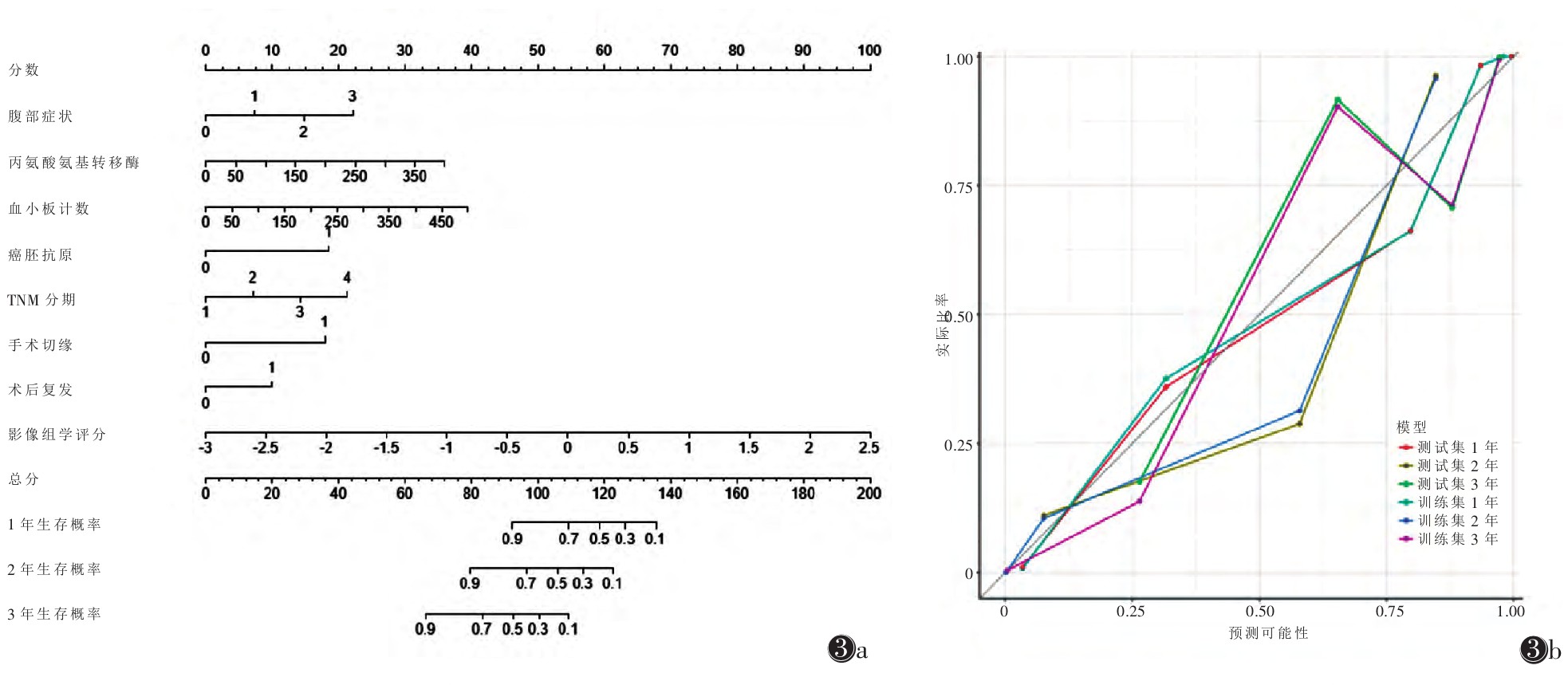 |
| 注:图 3a为列线图,图 3b为校准曲线 图 3 肝内胆管细胞癌生存期独立危险因子的列线图及其校准曲线 |
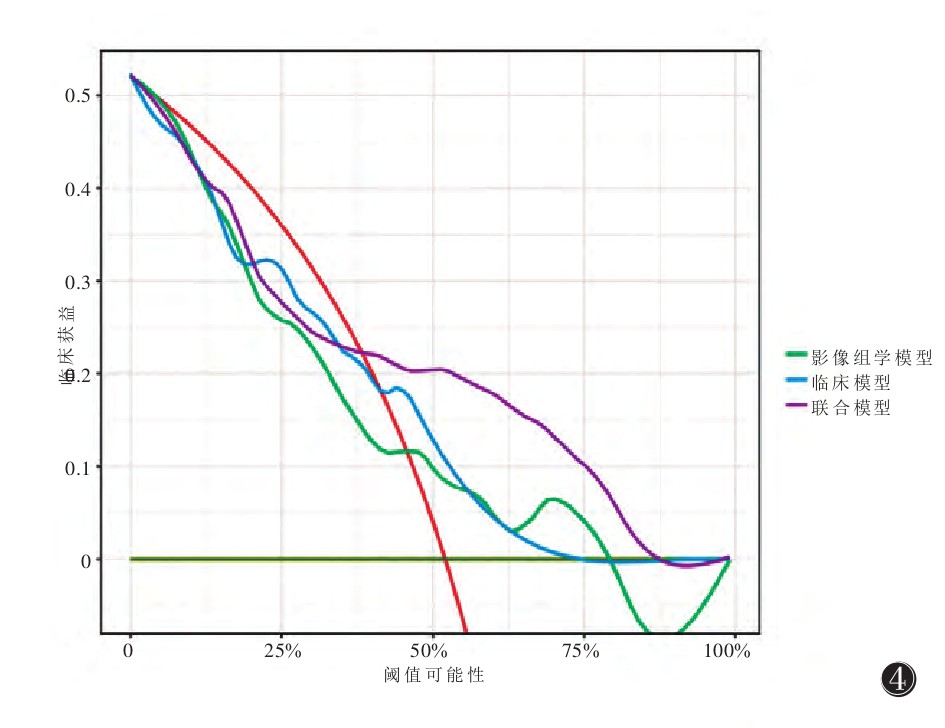 |
| 注:红色代表存在高危假设,黄色代表低危假设。结果表明,联合模型优于其他方案 图 4 决策曲线分析 |
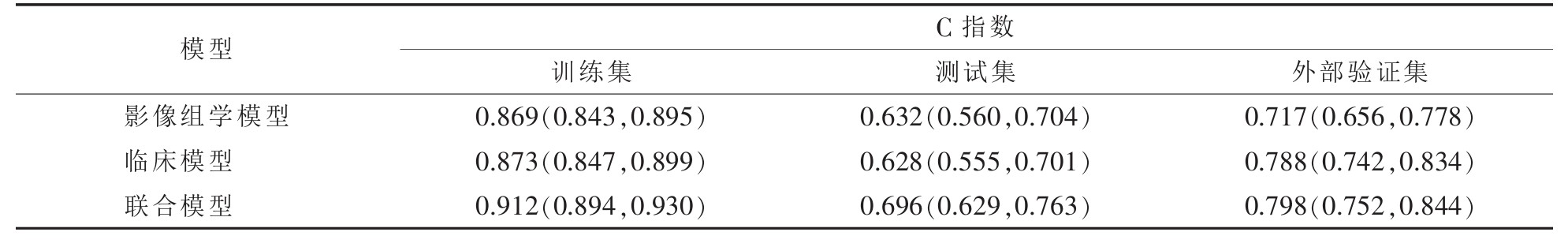
在影像组学模型、临床模型及联合模型中,联合模型效能最优(表 2)。
| 表 2 3种模型鉴别性能 |
 |
3 讨论
目前,手术切除仍是ICC最好的治疗选择。但由于起病隐匿、缺乏典型临床症状等特点,ICC确诊时多为进展期或晚期,仅30%~40%的患者确诊后有手术机会,但术后复发和/或远处转移概率很高[11-12],术后生存率较低,文献报道1年生存率约73.3%, 3年生存率约43.8%, 5年生存率约30.4%[13]。本组127例术后患者中位生存期为26个月,1、2、3年生存率分别约为72.4%、55.1%和26.8%, 3年生存率较文献报道低。
ICC患者的预后较差,临床分期对预测生存率和选择治疗方案至关重要。最近较多研究表明,肿瘤数量、有无血管侵犯(包括微血管及大血管侵犯)、手术切缘阳性和淋巴结转移等都是影响ICC预后的重要因素[1, 13-14]。影像学检查在ICC患者的术前诊断和治疗中起着重要作用。CT增强扫描已成为ICC术前评估的重要影像检查方法[15-16],同时可对原发肿瘤、血管和淋巴结状态,以及肿瘤侵犯邻近结构与程度综合评估,并获得肿瘤分期信息。本研究得出,腹部症状、丙氨酸氨基转移酶、血小板计数、癌胚抗原、TNM分期、手术切缘及术后复发情况是影响肝内胆管癌术后生存期的危险因素,对预测肝内胆管细胞癌术后生存期具有较大临床价值。
本研究通过结合CT增强扫描图像的影像组学列线图预测ICC患者的术后生存状态。基于训练集的影像组学评分的截断值,将这些患者分为高危组和低危组,3年期总体生存期差异显著。影像组学特征、临床病理危险因素纳入联合模型,其表现优于临床模型,表明联合模型具有更大价值。绘制了患者总体生存期的影像组学列线图校准曲线,根据估计结果与观察到的1、2和3年结果之间的一致性。决策曲线分析表明,联合模型优于影像组学模型及临床模型,临床获益最大。本研究计算C指数以评估影像组学列线图的预测效能,结果显示在影像组学模型、临床模型及联合模型中,联合模型效能最优。
综上所述,本研究利用影像组学评分结合临床危险因素构建定量化模型预测ICC术后生存期,该模型无论在训练集、测试集或外部验证集中,均对ICC术后生存期预测具有良好价值,可为临床决策提供新的方法。
本研究的局限性:纳入的临床特征不够全面,样本量及外部验证数据较少,仍需扩大样本量进一步验证。
| [1] |
LEE A J, CHUN Y S. Intrahepatic cholangiocarcinoma: the AJCC/UICC 8th edition updates[J]. Chin Clin Oncol, 2018, 7(5): 52. DOI:10.21037/cco.2018.07.03 |
| [2] |
VIJ M, PURI Y, RAMMOHAN A, et al. Pathological, molecular, and clinical characteristics of cholangiocarcinoma: a comprehensive review[J]. World J Gastrointest Oncol, 2022, 14(3): 607-627. DOI:10.4251/wjgo.v14.i3.607 |
| [3] |
BERTUCCIO P, MALVEZZI M, CARIOLI G, et al. Global trends in mortality from intrahepatic and extrahepatic cholangiocarcinoma[J]. J Hepatol, 2019, 71(1): 104-114. DOI:10.1016/j.jhep.2019.03.013 |
| [4] |
BANALES J M, CARDINALE V, CARPINO G, et al. Expert consensus document: cholangiocarcinoma: current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma(ENS-CCA)[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(5): 261-280. DOI:10.1038/nrgastro.2016.51 |
| [5] |
PARMAR C, GROSSMANN P, BUSSINK J, et al. Machine learning methods for quantitative radiomic biomarkers[J]. Sci Rep, 2015, 5: 13087. DOI:10.1038/srep13087 |
| [6] |
GU J, LIANG B Y, ZHANG E L, et al. Prognostic nomograms based on the cirrhotic severity scoring for preoperative prediction of long-term outcomes in patients with HBVrelated hepatocellular carcinoma and Child-Pugh grade A liver function[J]. J Oncol, 2022, 2022: 7031674. |
| [7] |
HUANG Y, LIU Z, HE L, et al. Radiomics signature: a potential biomarker for the prediction of disease-free survival in early-stage (ⅠorⅡ) non-small cell lung cancer[J]. Radiology, 2016, 281(3): 947-957. DOI:10.1148/radiol.2016152234 |
| [8] |
OUYANG J, HU Z, TONG J, et al. Construction and evaluation of a nomogram for predicting survival in patients with lung cancer[J]. Aging(Albany NY), 2022, 14(6): 2775-2792. |
| [9] |
BALACHANDRAN V P, GONEN M, SMITH J J, et al. Nomograms in oncology: more than meets the eye[J]. Lancet Oncol, 2015, 16(4): 173-180. DOI:10.1016/S1470-2045(14)71116-7 |
| [10] |
VAN GRIETHUYSEN J J M, FEDOROV A, PARMAR C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): 104-107. DOI:10.1158/0008-5472.CAN-17-0339 |
| [11] |
KHUNTIKEO N, CHAMADOL N, YONGVANIT P, et al. Cohort profile: cholangiocarcinoma screening and care program(CASCAP)[J]. BMC Cancer, 2015, 15: 459. DOI:10.1186/s12885-015-1475-7 |
| [12] |
SHROFF R T, KENNEDY E B, BACHINI M, et al. Adjuvant therapy for resected biliary tract cancer: ASCO clinical practice guideline[J]. J Clin Oncol, 2019, 37(12): 1015-1027. DOI:10.1200/JCO.18.02178 |
| [13] |
KANG S H, HWANG S, LEE Y J, et al. Prognostic comparison of the 7th and 8th editions of the American Joint Committee on Cancer staging system for intrahepatic cholangiocarcinoma[J]. J Hepatobiliary Pancreat Sci, 2018, 25(4): 240-248. DOI:10.1002/jhbp.543 |
| [14] |
HWANG S, LEE Y J, SONG G W, et al. Prognostic impact of tumor growth type on 7th AJCC staging system for intrahepatic cholangiocarcinoma: a single-center experience of 659 cases[J]. J Gastrointest Surg, 2015, 19(7): 1291-1304. DOI:10.1007/s11605-015-2803-6 |
| [15] |
JOO I, LEE J M, YOON J H. Imaging diagnosis of intrahepatic and perihilar cholangiocarcinoma: recent advances and challenges[J]. Radiology, 2018, 288(1): 7-13. DOI:10.1148/radiol.2018171187 |
| [16] |
FORNER A, VIDILI G, RENGO M, et al. Clinical presentation, diagnosis and staging of cholangiocarcinoma[J]. Liver Int, 2019, 39(1): 98-107. DOI:10.1111/liv.13968 |
 2023, Vol. 21
2023, Vol. 21


