| 肺癌PET-CT的最大标准摄取值与肿瘤微淋巴管密度及微血管密度的相关性研究 |
2. 潍坊医学院附属医院影像中心,山东 潍坊 261031
肺癌是我国发病率和死亡率均居首位的恶性肿瘤,5年生存率低于15%[1-2],其早期诊断与精准治疗是目前研究的焦点。PET-CT综合了CT解剖显示与PET组织功能、代谢两方面的影像学优势,从分子形态学、功能学两方面观察肺癌特征,在肺癌的早期诊断、功能成像、精准分期上有显著优势[3]。本研究初步探讨最大标准摄取值(maximum standard uptake value,SUVmax)与肺癌PET-CT征象、病理、微血管密度(microvessel density,MVD)及微淋巴管密度(lymphatic microvessel density,LMVD)的相关性,旨在分析SUVmax对肺癌早期诊断、早期治疗及预后评估的意义。
1 资料与方法 1.1 一般资料回顾性分析潍坊医学院附属医院2017年10月至2019年3月行手术切除并经病理证实的42例肺癌患者的临床及影像资料,其中男27例,女15例;年龄42~78岁,平均(58.50±10.24)岁。42例中鳞状细胞癌12例,腺癌24例,小细胞肺癌6例。依据2017年国际抗癌联盟(International Against Cancer,UICC)肺癌的TNM分期(第八版)[4]进行分期。患者术前均行PET-CT,且之前均未接受过抗肿瘤治疗,临床资料完整。所有患者均签署知情同意书。本研究获得医院伦理委员会批准。
1.2 仪器与方法采用Siemens Biograph 64型PET-CT仪。患者禁饮食4~6 h,血糖控制在正常范围,经静脉注射18F-FDG显像剂,剂量0.15~0.20 mCi/kg体质量,嘱患者多饮水、避光、静卧40~60 min、排尿后行全身扫描。CT扫描参数:120 kV,90~250 mA,层厚5 mm,旋转时间0.50 s,螺距0.81。同机行PET扫描:矩阵168×168,采集时间2.5 min/床位,依据患者身高采集6~8张床位。后对CT图像行衰减校正,并采用TOP重建法对在横断面、冠状面及矢状面的CT、PET图像进行融合成像。三维图像重建通过WizardTM工作站的MSViewer软件同机融合。
1.3 图像处理由2位经验丰富的核医学高级职称医师采用双盲法独立分析CT、PET及PET-CT图像。将肺门及纵隔淋巴结与原发灶区分开来,将断层图像上3个层面的相应连续位置局灶放射性增高视为异常。以由工作站自动勾画出肿瘤边界及ROI为主,人工修正为辅,分别测量原发肿瘤和淋巴结SUVmax。选择目前常用的肺部结节良恶性判断界值,即SUVmax>5为阳性。18F-FDG由CTI RDSeclipse回旋加速器及自动生成系统自行生产,符合质控要求。观察记录肿块最大径、分叶征、棘突征、胸膜牵拉征、血管集束征、空泡征、肺门和/或纵隔淋巴结肿大、原发肿瘤及淋巴结18F-FDG摄取的SUVmax(图 1)。
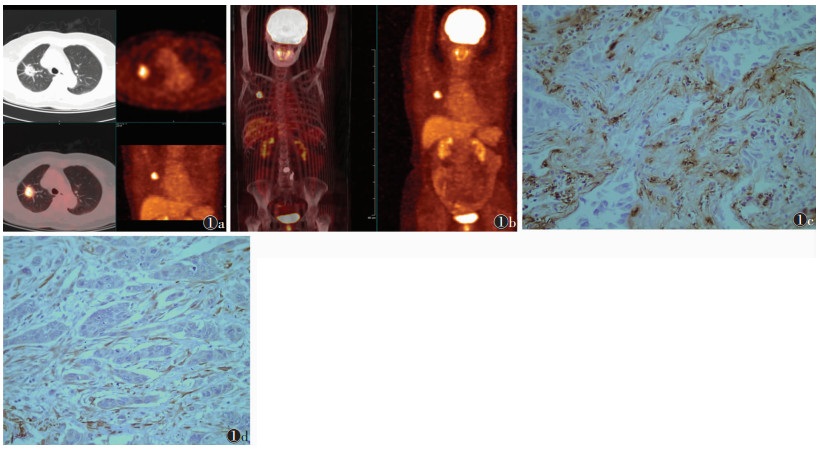 |
| 图 1 女,63岁,右上肺周围型肺腺癌 图 1a 18F-FDG PET-CT肺窗示右肺上叶后段33 mm× 26 mm软组织密度肿块影,伴放射性异常浓聚,最大标准摄取值(SUVmax)为13.21,可见毛刺征、胸膜牵拉征、小空泡征;纵隔见多发轻度肿大淋巴结,部分轻度摄取18F-FDG,SUVmax值为6.2 图 1b 18F-FDG PET-CT躯干部MIP示右肺上叶片状放射性异常浓聚影,骨骼未见18F-FDG摄取异常增高 图 1c 癌组织CD34免疫组化染色(×200),可见肿瘤组织间质中富含棕黄色条状染色的新生血管 图 1d 癌组织D2-40免疫组化染色(×200),显示肿瘤组织间质丰富的淋巴管染色 |
1.4 免疫组化染色
所有原发灶标本取下后经4%多聚甲醛固定、石蜡包埋,取肿瘤组织连续石蜡切片行HE染色及免疫组织化学链霉素抗生物素蛋白-过氧化物酶(SP)法染色(D2-40单克隆抗体、CD34单克隆抗体均购于福州迈新生物技术开发有限公司)。
MVD的判定:计数参照Weidner等的方法,首先在低倍镜(×100)下识别出3个血管染色最密集的区域,即“热点”,然后在高倍镜(×200)下计数微血管,取3个视野平均值作为MVD值。LMVD的判定:根据D2-40蛋白在淋巴管内皮细胞的阳性标记技术,计数方法同MVD(图 1)。
1.5 统计学方法采用Microsoft Excel 2003录入数据,使用SPSS 17.0统计软件。计量资料采用方差分析及Pearson相关分析,显著标准为0.05(双侧)。以P<0.05为差异有统计学意义。
2 结果 2.1 肺癌病理类型与原发肿瘤及淋巴结SUVmax的关系(表 1)| 表 1 不同病理类型肺癌的SUVmax比较(x±s) |
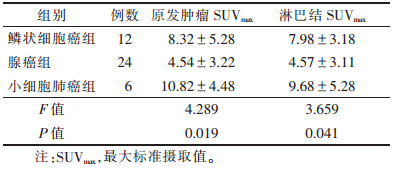 |
不同病理类型肺癌的原发肿瘤及淋巴结SUVmax差异均有统计学意义(均P<0.05),鳞状细胞癌组SUVmax高于腺癌组,小细胞肺癌组高于鳞状细胞癌组。
2.2 肺癌TNM分期与原发肿瘤及淋巴结SUVmax的关系(表 2)| 表 2 不同TNM分期肺癌的SUVmax比较(x±s) |
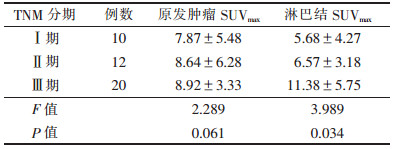 |
肺癌TNM分期中,Ⅰ期淋巴结为非转移淋巴结,Ⅱ、Ⅲ期为转移淋巴结;不同TNM分期肺癌的淋巴结SUVmax比较,差异有统计学意义(P<0.05);不同TNM分期肺癌的原发肿瘤SUVmax比较,差异无统计学意义(P>0.05)。
2.3 肺癌分化程度与原发肿瘤及淋巴结SUVmax的关系(表 3)| 表 3 不同分化程度肺癌的SUVmax比较(x±s) |
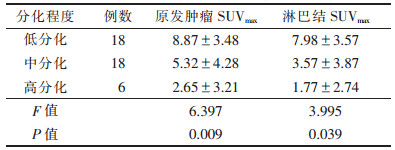 |
不同分化程度肺癌的原发肿瘤SUVmax及淋巴结SUVmax差异均有统计学意义(均P<0.05)。
2.4 原发肿瘤及淋巴结的SUVmax与肿瘤MVD、LMVD的关系(表 4)| 表 4 肺癌的SUVmax与LMVD及MVD的关系(个/视野,x±s) |
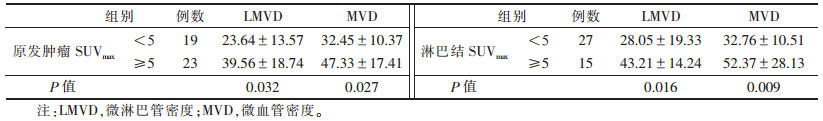 |
肺癌MVD在原发肿瘤及淋巴结SUVmax分组中差异均有统计学意义(均P<0.05);LMVD在原发肿瘤及淋巴结SUVmax分组中差异均有统计学意义(均P<0.05)。
2.5 原发肿瘤SUVmax与肺癌形态学表现的相关性分析(表 5)| 表 5 肺癌的原发肿瘤SUVmax与PET-CT表现相关性分析 |
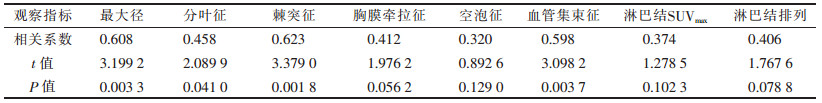 |
双变量符合正态分布,用Pearson相关系数分析,原发肿瘤的SUVmax与肿瘤的最大径、分叶征、棘突征、血管集束征均呈正相关(相关系数分别为0.608、0.458、0.623、0.598,均P<0.05),与空泡征、胸膜牵拉征、淋巴结SUVmax、淋巴结排列无明显相关性(均P>0.05)。
3 讨论 3.1 原发肿瘤SUVmax与LMVD、MVD的关系肿瘤微血管、微淋巴管统称为肿瘤微脉管,是微循环的重要组成。大量研究[2, 5-6]证明,肿瘤的发生、生长、转移、预后均与之密切相关。微脉管的研究是肿瘤机制研究及肿瘤治疗的重要途径,通过检测LMVD和MVD可客观了解肿瘤组织中的新生微淋巴管和微血管的活跃程度。
研究[5-9]显示,肺癌原发灶FDG摄取率越高,肿瘤的侵袭性和淋巴结转移率越高;FDG摄取与肿瘤细胞增殖活度、肿块倍增时间及病理分化程度等有关;因此,FDG摄取率可作为肺癌中临床预测肿瘤生物学行为的有效指标。但关于用SUV判断肺癌预后的临界值仍存在较大争论。SUV为半定量指标,指病灶内放射性摄取量,是全身平均摄取量的倍数,代表代谢活动水平。目前,学界的共识为SUV高表示病灶摄取葡萄糖代谢水平高,病灶细胞增殖活跃,肿瘤转移概率增加,预后差。SHIN等[6]通过对非小细胞肺癌的研究发现,SUVmax>6是预后危险因子;KOH等[5]对小细胞肺癌分析显示,SUVmax与预后呈负相关,SUVmax为2.5是区分肺结节良恶性较好的分界值;SAKAKIBARA等[9]研究发现,SUVmax与肿瘤新生血管形成密切相关。目前对于SUVmax分界值,国外研究结果大多集中在5~11,国内多为2~10,多数认为5作为分界点较理想,故本研究以5为界进行研究。本研究显示,LMVD、MVD值在SUVmax≥5组中明显高于<5组,说明病灶SUVmax与肿瘤细胞的增殖活跃度、肿瘤的淋巴转移、血行转移有明显相关性,与预后呈负相关,可作为鉴别诊断肺癌良恶性病变及预测侵袭性、转移及预后的一项较客观的影像指标。
3.2 淋巴结SUVmax与LMVD、MVD的关系淋巴结的SUVmax可在细胞分子代谢水平评估淋巴结转移情况,从而实现早期精确诊断;尤其在区别直径<1 cm的转移淋巴结或直径>1 cm的非转移淋巴结方面,PET图像依据其代谢性高低,观察是否为有活性肿瘤细胞,减少CT诊断淋巴结转移中的假阴性和假阳性,提高诊断准确率。但目前尚未有关淋巴结SUVmax与肿瘤微脉管形成的相关研究。本研究发现,LMVD、MVD在原发肿瘤及淋巴结SUVmax分组上差异均有统计学意义,提示淋巴结SUVmax越高,肿瘤LMVD、MVD计数越高,肿瘤越易于淋巴转移、血运转移,其增殖性更强,恶性度越高,预后不良。
3.3 原发肿瘤及淋巴结SUVmax与肺癌部分临床病理、CT征象的相关性研究[5, 7]显示,肺癌SUVmax与增殖细胞核抗原显著相关,SUVmax可反映肿瘤的增殖活跃程度。SIM等[8]报道,非小细胞肺癌FDG摄取与Glut-1/3的表达及肿瘤细胞的分化程度相关,细胞分化越差,FDG摄取会越高。SAKAKIBARA等[9]研究认为,FDG的摄取与肿瘤细胞的增殖性、活性肿瘤细胞数、分化程度及MVD等均有相关性。本研究结果与上述研究相符,其中小细胞肺癌SUVmax高于肺鳞状细胞癌,鳞状细胞癌高于腺癌;肺癌组织学分级中,低、中、高分化的肿瘤的SUVmax差异有统计学意义,即分化程度越高,SUVmax越小。本研究还发现,淋巴结的SUVmax与肿瘤类型、分化程度及临床TNM分期密切相关,目前尚无相关报道。
程凯等[10]报道,肺癌SUVmax在有无淋巴结转移分组中差异无统计学意义,认为病灶最大径对FDG摄取有影响。本研究结果与其有差异,肺癌Ⅲ期的淋巴结SUVmax明显高于Ⅱ期和Ⅰ期,即有淋巴转移SUVmax明显高于无淋巴转移,提示SUVmax可预测肺癌转移。
SUVmax与肿瘤大小的关系报道不一[8-11]。SAKAKIBARA等[9]认为病灶的FDG摄取与其大小无明显相关性,与病灶的倍增时间有关。SIM等[8, 11]则认为,肺癌病灶的FDG摄取与肿瘤大小呈正相关。本研究发现,肿瘤最大径与其SUVmax呈正相关,最大径越大,SUVmax越大,反之亦然。SUVmax与肿块最大径的相关性可能解释为:①较大肿瘤中存活的肿瘤细胞数量多,所以FDG摄取较高;②较大的肿瘤,血管、淋巴管丰富,血供充足,肿瘤代谢活性强;③恶性肿瘤的侵袭性和恶性生物学行为随着肿瘤的增长加强,导致FDG摄取升高。
肺癌其他恶性形态学征象与SUVmax的关系以往未见报道,本研究显示分叶征、血管集束征、棘突征与SUVmax呈正相关。可解释为深分叶征、棘突征代表肿瘤增殖性较高,细胞增殖活跃,代谢强;血管集束征可反映肿瘤血供,血供丰富者肿瘤细胞增殖速度会相应增加,以上征象与FDG摄取呈正相关。SUVmax、分叶征、棘突征、血管集束征均为肺癌的重要征象,可一定程度预测肿瘤细胞的增殖性,反映其恶性程度。
综上所述,PET-CT是目前临床上广泛应用的肿瘤分子影像学检查方法,可从病灶的功能代谢及病理形态改变两方面共同测评病灶性质,SUVmax在测评肿瘤生物学行为、疗效随访及预后等方面有重要价值[10-12],结合其他PET-CT征象联合分析将有更大的临床应用前景。本研究局限性:纳入例数较少,有待扩大样本量进一步证实研究结果。
| [1] |
WANG L, YU C, LIU Y, et al. Lung cancer mortality trends in China from 1988 to 2013:new challenges and opportunities for the government[J]. Int J Environ Res Public Health, 2016, 13(11): 1052. DOI:10.3390/ijerph13111052 |
| [2] |
RUZYCKA M, CIMPAN M R, RIOS-MONDRAGON I, et al. Microfluidics for studying metastatic patterns of lung cancer[J]. J Nanobiotechnology, 2019, 17(1): 71. |
| [3] |
SUDHAKARAN S, BASHOURA L, STEWART J, et al. Pulmonary cryptococcus presenting as a solitary pulmonary nodule[J]. Am J Respir Crit Care Med, 2017, 196(9): 1217-1218. DOI:10.1164/rccm.201703-0601IM |
| [4] |
王鑫, 支修益. 国际肺癌研究协会(IASLC)第八版肺癌TNM分期解读[J]. 中华胸部外科杂志, 2016, 3(2): 70-76. |
| [5] |
KOH Y W, LEE S J, Park S Y. 18F-fluorodeoxyglucose positron emission tomography is correlated with the pathological necrosis and decreased microvessel density in lung adenocarcinomas[J]. Ann Nucl Med, 2019, 33(2): 93-102. |
| [6] |
SHIN S, PAK K, KIM I J, et al. Prognostic value of tumor-to-blood standardized uptake ratio in patients with resectable non-small-cell lung cancer[J]. Nucl Med Mol Imaging, 2017, 51(3): 233-239. DOI:10.1007/s13139-016-0456-3 |
| [7] |
ZHAO L, TONG L, LIN J, et al. Characterization of solitary pulmonary nodules with 18F-FDG PET/CT relative activity distribution analysis[J]. Eur Radiol, 2015, 25(7): 1837-1844. DOI:10.1007/s00330-015-3592-8 |
| [8] |
SIM Y T, GOH Y G, DEMPSEY M F, et al. PET-CT evaluation of solitary pulmonary nodules:correlation with maximum standardized uptake value and pathology[J]. Lung, 2013, 191(6): 625632. |
| [9] |
SAKAKIBARA Y, SUZUKI Y, FUJIE T, et al. Radiopathological features and identification of mycobacterial infections in granulomatous nodules resected from the lung[J]. Respiration, 2017, 93(4): 264-270. DOI:10.1159/000456550 |
| [10] |
程凯, 葛鲁娜, 付正. 肺癌18F-FDG PET/CT SUVmax值与临床因素及肿瘤标志物相关性研究[J]. 中华肿瘤防治杂志, 2016, 23(13): 884-887. |
| [11] |
KROCHMAL R, ARIAS S, YARMUS L, et al. Diagnosis and management of pulmonary nodules[J]. Expert Rev Respir Med, 2014, 8(6): 677-691. DOI:10.1586/17476348.2014.948855 |
| [12] |
梁萌, 郑容. PET/CT在非小细胞肺癌放射治疗中的应用现状[J]. 中国医学影像技术, 2014, 30(8): 1276-1279. |
 2020, Vol. 18
2020, Vol. 18


