| ADC值及相对ADC值对肿块样浆细胞性乳腺炎与肉芽肿性乳腺炎的鉴别诊断价值 |
2. 重庆市中医院 临床药学部,重庆 400021
肿块样浆细胞性乳腺炎(mass-like plasma cell mastitis,ML-PCM)和肉芽肿性乳腺炎(granulomatous mastitis,GM)临床表现及影像学特点极其相似,钼靶和超声基本无法区分[1],临床鉴别十分困难,误诊率极高,而两者的治疗方法及预后也不同,因此准确鉴别两者意义重大[2-3]。目前,DWI、定量ADC及其相对ADC(relative ADC,rADC)已被广泛应用于临床,且表现出极大的价值[4-5],但应用ADC、rADC对GM及ML-PCM鉴别诊断极少报道。本文回顾性分析2009年1月至2018年11月我院经病理证实的196例ML-PCM与168例GM的MRI图像,旨在探讨ADC及rADC对两者的鉴别诊断价值。
1 资料与方法 1.1 一般资料196例ML-PCM与168例GM,均为女性。ML-PCM组年龄15~62岁,平均(37.3±10.2)岁;单侧发病175例,双侧发病21例;左侧107处,右侧110处;病程最短7 d,最长超过2年,平均8个月。GM组年龄18~64岁,平均(38.1±12.5)岁;单侧发病154例,双侧发病14例;左侧95处,右侧87处;病程最短11 d,最长超过2.5年,平均10个月。患者对检查知情同意,并签署知情同意书。本研究经我院伦理委员会批准。
1.2 仪器与方法采用Siemens 1.5 T MRI扫描仪、16通道双侧乳腺专用相控表面线圈。患者取俯卧位,双侧乳腺自然悬垂于线圈的双孔内,双侧前臂紧贴头颅、置于前方,扫描范围为腋窝至双侧乳房下界,包括双侧全部乳房。扫描序列及参数见表 1。动态增强扫描采用脂肪抑制序列,预扫描蒙片满意后,采取高压注射器经肘静脉留置通道注射对比剂+15 mL生理盐水(流率2.0~2.5 mL/s、剂量0.1 mmol/kg体质量),连续扫描8期(表 1)。
| 表 1 1.5 T MRI扫描序列及参数 |
 |
1.3 图像分析
所有影像资料由2位主治医师(工作12、16年)参照BI-RADS-MRI标准对DWI图像进行主观评价,如图像严重扭曲、变形或信号缺失,则为扫描失败,予以排除。将原始数据传至ADW 4.6后处理工作站采用双盲法测量ADC值。正常腺体ADC值:结合T1WI增强扫描、T2WI图像确定正常腺体中间区域,放置ROI,大小10~20 mm2,使同一患者ROI大小保持一致;ML-PCM、GM病灶的ADC值:结合T1WI、T2WI增强扫描图像确定病变最大截面中间区域,在b值为1 000 s/mm2图像上勾画ROI,尽量避开正常腺体、囊变、脓肿区域;每位医师测量3次,取平均值;计算rADC值,rADC=ML-PCM或GM的ADC值/正常腺体ADC值。
1.4 统计学方法采用SPSS 25.0统计软件对数据进行分析,符合正态分布数据以x±s表示。采取组间相关系数(ICC)评价2位医师测量ADC值的一致性,ICC > 0.8为一致性好;0.6~0.8为一致性较好;<0.6为一致性差。采用独立样本t检验比较2组ADC、rADC的差异。绘制ROC曲线并确定最佳诊断阈值,计算AUC,评价ADC、rADC值鉴别诊断ML-PCM、GM的效能。以P<0.05为差异有统计学意义。
2 结果 2.1 一致性分析所有DWI图像均无明显变形或信号缺失,ML-PCM、GM的T2WI、T1WI增强扫描、DWI图像均呈稍高信号,ADC呈低信号(图 1,2)。2位医师测量ML-PCM、GM病灶[ICC=0.938,95%CI(0.915,0.956)]及正常腺体[ICC=0.925,95%CI(0.896,0.946)]ADC值一致性好。
 |
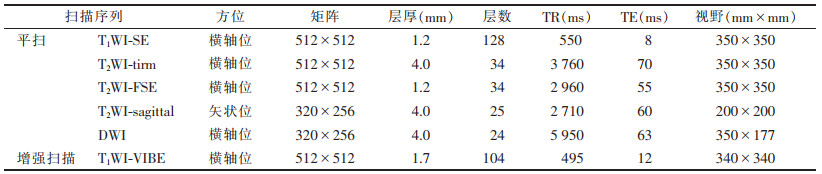
| 图 1 女,35岁,右乳腺浆细胞性乳腺炎(PCM) 图 1a T2WI轴位平扫示右侧乳腺外象限片状稍高信号 图 1b T1WI抑脂轴位增强扫描示病变明显强化(长箭),邻近导管扩张、增宽 图 1c,1d b=1 000 s/mm2时,DWI示右侧乳腺外侧病变轻度弥散受限,ADC值为0.963×10-3 mm2/s(长箭);对侧正常腺体组织ADC值为1.637×10-3 mm2/s(短箭) 图 1e,1f 穿刺标本(HE×100)及手术病理标本(HE×200)示右乳腺导管周围及间质内见大量淋巴细胞及浆细胞、少量中性粒细胞,提示PCM |
 |
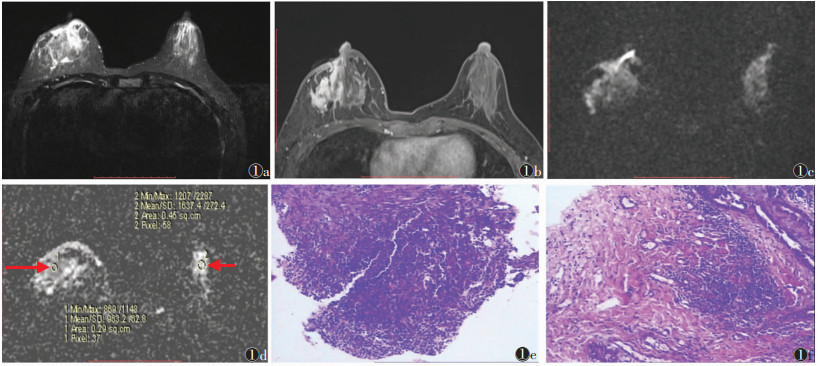
| 图 2 女,28岁,右乳腺肉芽肿性乳腺炎(GM) 图 2a T2WI轴位平扫示右侧乳腺外象限片状稍高信号 图 2b T1WI抑脂轴位增强扫描示病变呈明显结节状强化(长箭) 图 2c,2d b=1 000 s/mm2时,DWI示右侧乳腺外侧病变轻度弥散受限,ADC值为1.362×10-3 mm2/s(长箭);测量对侧正常腺体组织ADC值为1.681×10-3 mm2/s(短箭) 图 2e,2f 穿刺标本(HE×100)及手术病理标本(HE×200)示右乳腺见淋巴细胞、中性粒细胞并肉芽肿形成,倾向于肉芽肿性小叶炎 |
2.2 2组病灶ADC、rADC比较
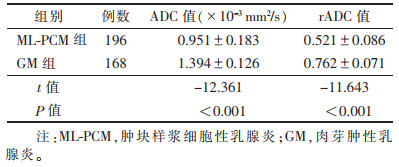
ML-PCM组ADC值及rADC值均低于GM组(均P<0.05)(表 2)。
| 表 2 2组病灶ADC值、rADC值比较(x±s) |
 |
2.3 ADC值及rADC值鉴别诊断效能
ADC值及rADC值鉴别诊断ML-PCM、GM的ROC曲线(图 3),ADC值取1.041×10-3 mm2/s时,其鉴别诊断ML-PCM、GM的敏感度及特异度分别为84.3%和87.5%,AUC为0.776;rADC值取0.527时,其鉴别ML-PCM、GM的敏感度及特异度分别为90.2%和92.4%,AUC为0.931。
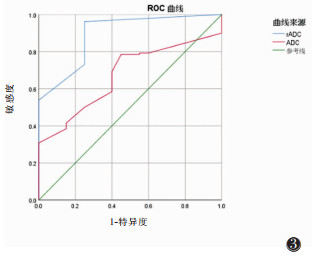 |
| 图 3 ADC值及rADC值鉴别ML-PCM与GM的ROC曲线 |
3 讨论
浆细胞性乳腺炎(plasma cell mastitis,PCM)又称乳腺导管扩张症,好发于非哺乳期中年女性,既往研究[6-7]认为与乳头发育不良、哺乳中断造成乳腺导管排泄障碍,以及异常激素刺激导管,上皮细胞碎屑或含脂性分泌物由导管内渗出,从而引起浆细胞、淋巴细胞为主的瘤样变,若病变呈肿块样改变,即ML-PCM。GM为局限于小叶非干酪样坏死炎性病变,晚期可破溃形成窦道;有学者[8]认为GM为免疫系统疾病,可能与避孕药关系密切;亦有学者[9]认为与高泌乳素症使得机体激素失衡或创伤、化学刺激引起小叶肉芽肿炎性改变有关。
PCM临床治疗主要采用疏肝清热、活血止痛、温阳化痰、化瘀散结等方法。GM主要以肿块为主,可伴脓肿形成,最终脓肿破溃形成多发瘘管,因此有学者[10]将其分为肿块期、脓肿期及瘘道期,目前多采用中西医结合治疗,主要包括通络散结法、调气合营法内服外用及激素治疗等,其有效率及复发率明显优于单纯西医治疗。
常规影像学单纯依靠大小、形态、强化情况及TIC等鉴别PCM与GM,但准确率不高:①GM位于乳腺小叶且分布于除乳晕外的周边腺体深层,不伴乳腺导管扩张改变,早期MRI表现为腺体分布不均或无异常改变;PCM位于较表浅乳晕区且伴乳腺导管不同程度扩张。②由于病因不同MRI示GM对侧乳腺导管常无扩张,而PCM多表现为对侧乳腺导管扩张。③PCM位于乳晕旁表浅位置,扩张导管早期即可形成瘘管,故乳晕旁瘘管为PCM典型MRI表现;GM进展期小叶孤立病灶间互相连通,MRI典型表现呈粗细不均串珠样病变。本研究示ML-PCM的ADC值及rADC值均低于GM,原因主要由于病变内容物不一致,PCM存在较多上皮细胞碎屑或含脂性分泌物并引起浆细胞、淋巴细胞瘤样改变,肿块通常较致密,而GM内含有丰富蛋白质及脂肪渗出物,引起局部中性粒细胞及巨细胞浸润,分布通常较松散。
当PCM表现为肿块型(ML-PCM)时与GM较难鉴别,既往主要依靠临床病史鉴别,PCM病程长、为慢性反复发作,而GM为短时间内急性发作,临床诊断准确率和敏感度均较低[2-3, 11]。DWI是目前唯一能在活体组织中无创性检测水分子扩散运动的方法,其可提供组织中细胞密度、微循环及微结构的信息,组织发生病变时,其细胞结构、功能和代谢发生异常改变,影响水分子在细胞内及细胞间的扩散能力,从而区分病变良恶性。多项研究[12-14]显示,乳腺癌的ADC值明显低于乳腺炎,但其研究主要对象均以乳腺癌为主,很少将非哺乳期乳腺炎纳入其中。DWI中b值选取至关重要,当b值较小时其敏感度较低,随b值增大,其敏感度亦增大,但图像噪声亦随之增加,高场强中还可出现图像变形、伪影等表现,严重影响ADC值测量准确性,既往研究[12-14]认为b值为800~1 000 s/mm2时,DWI能较好地区分ML-PCM及GM,故本研究将b值定为1 000 s/mm2。ML-PCM与GM病灶大量炎症细胞浸润于腺体周围,导致细胞外组织间隙变小,水分子扩散受限,因此DWI呈高信号,ADC值降低。因ML-PCM与GM病变不同,ML-PCM主要以浆细胞渗出瘤样变为主,而GM以肉芽肿聚集瘤样变为主,故ADC值有助于鉴别。
ADC值受细胞密度、微循环灌注、心跳呼吸、年龄、月经周期等影响较大。多项研究[15-16]认为rADC值较ADC值更稳定,可减少由于机体因素、MRI机型号、b值及线圈等不同而导致的误差。祝翠玲[17]利用rADC值鉴别高级别胶质瘤与脑转移瘤。亦有学者[18]研究脑膜瘤中ADC值、rADC值与Ki-67增殖指数的相关性,发现rADC值的敏感度高于ADC值。本研究中ML-PCM组病灶rADC值低于GM组,其鉴别诊断ML-PCM及GM的敏感度和特异度均较高,与既往结论一致。但实际工作中,rADC值需额外测量某一部位的ADC值,且须手工计算,增加了医师的工作量,而ADC值则相对简单、直接。
本研究的不足:①仅以正常腺体ADC值为参照,未分析以其他组织为参照是否影响rADC值的诊断效能;②选取b值单一,未对其他b值的诊断效能进行分析;③为回顾性研究,对象为ML-PCM及GM,而未对非肿块型进行研究,存在一定的选择偏倚;④样本量相对较小;⑤ROI选取为病变最大层面,而未包含病变全部,因此不能反映全部病变的ADC值及rADC值;⑥ROI虽尽量避开正常腺体、囊变及脓肿区域,但仍不能完全除外ML-PCM中夹杂病变中心由于导管内上皮细胞碎屑、微生物、高蛋白或类脂性分泌聚集导致小囊变情况存在。
综上所述,ADC值及rADC值均能有效鉴别诊断ML-PCM与GM,rADC可更精确分析两者的差异,为临床诊断、治疗及鉴别诊断提供更客观的依据。
| [1] |
PLUGUEZ-TURULL C W, NANVES J E, QUINTERO C J, et al. Idiopathic granulomatous mastitis:manifestations at multimodality imaging and pitfalls[J]. Radiographics, 2018, 38(2): 330-356. DOI:10.1148/rg.2018170095 |
| [2] |
孙璐. 浆细胞性乳腺炎与肉芽肿性乳腺炎的鉴别及诊治[J]. 现代医药卫生, 2017, 33(14): 2129-2131. |
| [3] |
祝琴, 李远平, 张英毅. 浆细胞性乳腺炎和肉芽肿性乳腺炎的临床特征及治疗对策[J]. 中国实用医药, 2016, 11(32): 26-28. |
| [4] |
ZHANG L, HU J, GUYS N, et al. Diffusion-weighted imaging in relation to morphology on dynamic contrast enhancement MRI:the diagnostic value of characterizing non-puerperal mastitis[J]. Eur Radiol, 2018, 28(3): 992-999. DOI:10.1007/s00330-017-5051-1 |
| [5] |
CHU A N, SEILER S J, HAYES J C, et al. Magnetic resonance imaging characteristics of granulomatous mastitis[J]. Clin Imag-ing, 2017, 43: 199-201. DOI:10.1016/j.clinimag.2017.03.012 |
| [6] |
马风荣, 袁慧书. 浆细胞性乳腺炎影像学研究进展[J]. 放射学实践, 2019, 34(8): 925-929. |
| [7] |
王军大, 杨华, 方玉, 等. 肿块样浆细胞性乳腺炎多种MRI征象的多因素分析[J]. 临床放射学杂志, 2019, 38(8): 1395-1399. |
| [8] |
费正华, 罗志琴, 李志. 磁共振动态增强和弥散加权成像在不同类型乳腺炎性疾病诊断与鉴别诊断的应用价值[J]. 中华医院感染学杂志, 2017, 27(3): 628-631. |
| [9] |
艾昭东, 胡平胜, 于小平. 非特异性肉芽肿性乳腺炎的影像学表现[J]. 中国中西医结合影像学杂志, 2017, 15(2): 189-192. |
| [10] |
黄玲. 浆细胞性乳腺炎和肉芽肿性乳腺炎的临床特征及治疗对策[J]. 中国医药科学, 2017, 7(23): 14-16, 87. |
| [11] |
刘佩芳. 浆细胞性乳腺炎和肉芽肿性乳腺炎的影像学诊断及鉴别诊断[J]. 国际医学放射学杂志, 2009, 32(3): 268-273. |
| [12] |
ASLAN H, POURBAGHER A, COLAKOGLU T. Idiopathic gran-ulomatous mastitis:magnetic resonance imaging findings with diffusion MRI[J]. Acta Radiologica, 2016, 57(7): 84-86. |
| [13] |
郭睿, 邓奎品, 肖运平. 非特异性肉芽肿性乳腺炎与非肿块样强化乳腺癌的MRI征象及临床分析[J]. 实用放射学杂志, 2017, 33(5): 11-16. |
| [14] |
郑桦, 符孔, 李传资, 等. DWI和DCE-MRI鉴别不同乳腺炎性疾病类型的价值研究[J]. 河北医药, 2018, 40(21): 38-41. |
| [15] |
NADRLJANSKI M M, MILOSEVIC Z C. Relative apparent diffusion coefficient (rADC) in breast lesions of uncertain malignant potential (B3 lesions) and pathologically proven breast carcinoma (B5 lesions) following breast biopsy[J]. Eur J Radiol, 2020, 124: 108854. DOI:10.1016/j.ejrad.2020.108854 |
| [16] |
YILMAZ E, SARI O, YILMAZ A, et al. Diffusion-weighted imaging for the discrimination of benign and malignant breast masses; utility of ADC and relative ADC[J]. J Belg Soc Radiol, 2018, 102(1): 24. DOI:10.5334/jbsr.1258 |
| [17] |
祝翠玲. 近瘤周水肿区ADC及rADC值在鉴别诊断高级别胶质瘤与脑转移瘤中的价值[J]. 长治医学院学报, 2018, 32(5): 375-378. |
| [18] |
沈金花, 董光, 方龙江. 脑膜瘤中ADC值、rADC值与Ki-67增殖指数的相关性分析[J]. 临床放射学杂志, 2017, 36(1): 11-14. |
 2020, Vol. 18
2020, Vol. 18
