| 儿童肺炎相关性肺栓塞的临床、CT及CTPA特点 |
目前,关于儿童肺炎相关性肺栓塞的文献及研究报道越来越多[1],但多针对疾病的临床特征、实验室检查结果及治疗方式等[2],关于影像表现则多为描述为肺部广泛、大片实变影,少见详细论述。因此,本文旨在总结分析肺炎引起肺栓塞患儿的临床特点、实验室检查及影像表现等,以提高对该病的诊断水平。
1 资料与方法 1.1 一般资料回顾性分析我院2021年1月1日至2022年4月1日收治的24例肺炎相关性肺栓塞患儿的临床资料、实验室检查及胸部影像表现。24例中,男13例,女11例;年龄3~12岁,平均(6.95±2.27)岁。临床症状:发热20例,咳嗽20例,喘息2例,气促、呼吸困难4例,胸痛22例,腹痛6例。查体发现三凹征阳性2例,呼吸音减低8例,呼吸急促7例。缺铁性贫血2例,先天性心脏病术后1例。病原学检查:支原体感染23例,腺病毒感染2例,EB病毒感染1例,铜绿假单胞菌感染1例。24例中并发肝损伤6例,脾栓塞2例,脓毒血症1例,感染性心内膜炎5例,败血症1例,皮疹2例,腹腔积液3例。所有患儿白细胞计数及中性粒细胞百分比均增高;淋巴细胞百分比升高3例,降低11例;D-二聚体均升高,平均(3.525±3.007)μg/m L,最高达16.300μg/mL。
纳入标准:①既往无肺栓塞病史;②入院前未接受抗生素、激素等药物治疗;③影像及临床资料齐全。排除标准:①近期有手术、外伤引起的制动、创伤史或留置静脉中心导管;②合并其他部位感染;③有肿瘤、先天性心血管病、自身免疫性疾病,凝血因子Ⅴ与Ⅷ突变等基因遗传病,以及凝血酶原、蛋白酶、肝素辅助因子、纤维蛋白酶异常等相关病史。
1.2 仪器与方法使用Philips 256排螺旋CT扫描仪行胸部平扫及CT肺动脉造影(computed tomographic pulmonary,CTPA)检查。扫描参数:100 kV,自动管电流,层厚0.625 mm。患儿检查前禁食4~6 h,3岁以下及不能配合患儿均口服10%水合氯醛镇静,剂量0.5 mL/kg体质量。患儿取仰卧位,扫描范围自胸廓入口处至双膈面水平。使用非离子型对比剂(欧乃派克,碘浓度300 mg/mL),剂量2.0~2.5 mL/kg体质量,注射流率0.5~2.5 mL/s。使用自动触发扫描技术,触发点设置在近上腔静脉水平的右心房,延迟3 s后开始扫描。
1.3 图像分析由2名主治医师采用双盲法分析图像,观察患儿肺炎部位、面积、性质、胸腔积液及CTPA后肺动脉栓塞部位、范围、形式、是否合并肺坏死等表现。其中肺栓塞诊断依据为CT连续2个截面及多个平面均可见。根据肺部炎症感染累及范围(肺叶受累程度:无病灶,0分;<5%,1分;5%~25%,2分;26%~49%,3分;50%~75%,4分;>75%,5分;各肺叶CT评分之和为总评分,范围0~25分)、栓子大小(按照轴位图像上栓子长径与同层面肺动脉长径比值描述,分为≤1/2与>1/2)等,对CT图像结果进行半定量评分、统计。
1.4 统计学分析使用SPSS 19.0软件分析数据,连续变量符合正态分布以 x±s表示,不符合正态分布以M(QL,QU)表示。
2 结果24例患儿的肺叶受累CT评分为4~21分,平均(9.60±4.65)分。左、右肺分布范围:左肺上叶2例,下叶4例;右肺上叶4例,中叶1例,下叶13例。其中炎性病变性质均匀2例,坏死14例。左侧胸腔积液4例,右侧胸腔积液3例,双侧胸腔积液2例。栓子分布以肺叶动脉多见,共17处(其中又以右侧肺叶动脉最常见,10处),其次为肺段动脉与亚段动脉各7处,左肺动脉2处,右肺动脉1处。栓子长径与同层面血管长径比值>1/2者22例。栓子类型以中心型最常见,共19处,其次分别为偏心型11处、完全型4处。
影像改变:①24例均可见肺部累及不同范围实变,但以右肺下叶多见。②双侧肺动脉栓塞10例,其中双侧对称性栓塞3例。③以右肺下叶肺叶动脉栓塞最多。④栓子最大长径与同层面血管长径比值多>1/2。⑤栓子多以中心充盈缺损形式存在于对应肺动脉内。仅10例肺部最大实变与肺动脉栓塞部位一致(图1,2),其中7例为肺叶实变对应叶级肺栓塞,3例为肺叶实变对应段级肺栓塞。
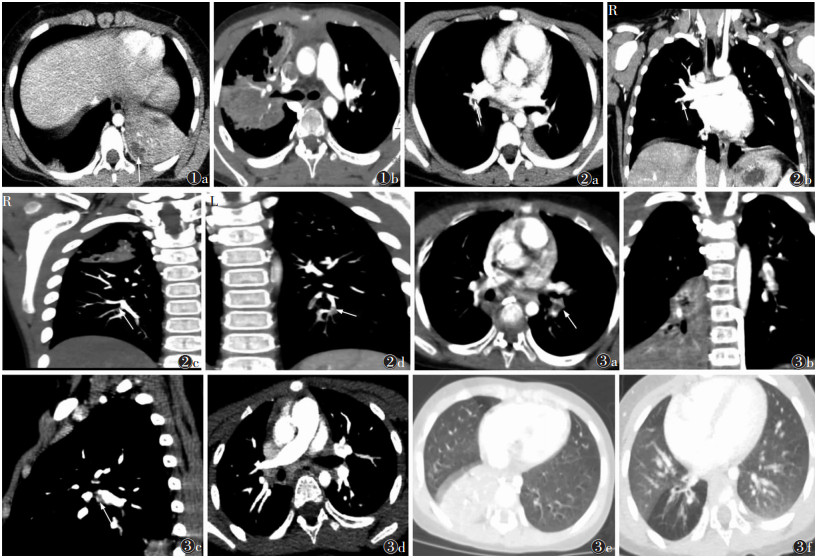 |
| 注:图1患者,女,7岁。左、右肺下叶大片实变影并不均匀强化,中心可见坏死。炎症病灶内的肺动脉近端可见,远端未见明确显示,提示肺动脉栓塞。图2患者,男,5岁。图2a~2d分别为横轴位、冠状位及MIP图像,病变肺动脉增强扫描后管腔内见片状充盈缺损(箭);其中栓塞的肺动脉与肺部炎症分布未见明确相关(图2c)。图3患者,女,3岁4个月。图3a~3c分别为横轴位、冠状位、矢状位图像,左肺下叶肺动脉增强扫描后见长条状充盈缺损,对应近端肺动脉管径增宽(箭);患儿经抗炎、抗凝、溶栓治疗后,原栓子已消失(图3d);原右侧肺部炎性病灶(图3e)已基本吸收,呈局限性肺气肿样改变(图3f) 图 1~3 肺炎相关性肺栓塞患儿CT图像 |
22例间隔(29.08±17.57)d复查,提示D-二聚体升高3例,正常19例。影像复查提示患儿原肺栓塞消失或体积变小,肺部炎性浸润面积变小或密度变淡,胸腔积液已吸收。但其中2例在原肺部实变上继发,出现空洞,并出现新的同侧胸腔积液。另3例在新部位出现肺栓塞,其中2例为亚段级肺动脉,1例为段级肺动脉,栓子分布形式为2例中心型,1例偏心附壁型。所有新栓子体积均不超过同肺动脉管径1/2。2例又分别间隔48 d与71 d复查CTPA,提示原栓子已消失,肺部CT正常,未见残留病灶(图3)。
3 讨论肺栓塞是以各种栓子阻塞肺动脉或其分支为其发病原因的一组疾病或临床综合征的总称。临床主要依据Wells评分或改良版日内瓦评分去初步预测成人肺栓塞发生的可能,或依据患者呼吸困难、气促、胸痛、咯血、晕厥、D-二聚体升高等典型表现进行判断[3]。然而对于肺炎患儿,无法通过以上方法确定是否合并肺栓塞,原因为低龄儿童无法准确表达自身感受;呼吸困难、胸痛等典型肺栓塞表现易被肺炎基础症状掩盖;D-二聚体随年龄改变可有不同的阈值[4]。此时,CTPA检查对明确儿童肺栓塞的诊断有着不可替代的作用,且其快速、无创、图像后处理功能强大,其中冠状位、矢状位及3D等MPR与MIP已被证明检测肺栓塞与观察者之间的一致性显著提高[5-6]。
本组患儿病原学检查以支原体感染为主,年龄以学龄期为主(20例,83.3%),最常见症状为发热、咳嗽、胸痛。上述符合之前对于支原体作为肺炎住院患儿中常见病原学以及好发生于学龄前学龄期儿童,尤其是幼儿园及学校密集接触人群等报道;直接支持了支原体以损伤宿主血管内皮为主,促进血栓形成的理论假说[7-9]。本组均伴D-二聚体升高,但D-二聚体针对不同人群正常范围阈值有一定差异性,成人或儿童在社区获得性肺炎中均较多伴D-二聚体升高[10-11]。Liu等[12]对43例肺炎支原体肺炎患儿的回顾性研究提示D-二聚体>11.1 mg/L有助于血栓形成的早期诊断,本组仅2例符合。
本组患儿的胸部CT及CTPA特征:①肺部实变多见大叶性改变,以右肺下叶多见。②实变区出现坏死。③共34处栓子,但仍以单侧单处栓塞常见,以肺叶动脉尤其是右肺叶动脉发生最多,其次栓子体积多较大,且以中心型充盈缺损最常见。上述特征与Degerstedt等[13-14]研究结果一致。值得注意的是,本组仅10例肺栓塞的发生部位与对应最大实变区的肺叶或肺段动脉一致;余14例随机分布在无炎症浸润的肺叶或肺段动脉。虽较多文献认为肺部大片实变是肺栓塞的危险因素之一[15-17],但在儿童中,临床常由于炎症在CT上仅以小病灶形式出现而较少考虑肺栓塞并发症的可能,而忽略了CPTA检查。因此,笔者大胆推测肺栓塞亦可能同样出现在小叶性肺炎的患儿中。此时明确肺炎引起肺栓塞的间接影像表现尤为重要,如胸腔积液及肺动脉扩张[18-20]等。但以上征象在本组发生率并不高。
本研究中,对24例患儿在大环内酯类药物应用的基础上,又行抗凝、溶栓甚至激素等治疗,后期复查胸部CT及CTPA均显示大部分患儿影像情况明显好转;3例继发新肺段或亚段肺栓塞,后2次复查显示栓子消失。Pelland-Marcotte等[21]指出,大面积肺栓塞(低血压、无脉博或持续性严重心动过缓)或次大面积栓塞(右心室功能障碍或心机坏死)是肺栓塞不良预后的危险因素。本组5例继发性感染性心内膜炎,余均无上述表现。因而推测无论栓子发生部位(主肺动脉除外,本组无此类病例)、大小甚至后期是否继发等,及时准确的治疗均能避免患儿远期的肺损害及继发肺部后遗改变。
| [1] |
CARPENTER S L, RICHARDSON T, HALL M. Increasing rate of pulmonary embolism diagnosed in hospitalized children in the United States from 2001 to 2014[J]. Blood Adv, 2018, 2(12): 1403-1408. DOI:10.1182/bloodadvances.2017013292 |
| [2] |
何忠, 刘佳明, 郑锐. 肺栓塞合并肺炎的临床特点分析[J]. 中国医科大学学报, 2021, 50(1): 89-91. |
| [3] |
中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. |
| [4] |
赵灿, 胡京敏, 郭丹杰. 血浆D-二聚体临界值联合Wells量表对可疑肺栓塞的除外价值[J]. 北京大学学报(医学版), 2018, 50(5): 828-832. |
| [5] |
张少娟, 郭佑民, 李洪伦, 等. CTPA与V/Q扫描诊断肺栓塞的比较研究[J]. 中国医学影像技术, 2004, 20(3): 414-418. |
| [6] |
SCHUELLER-WEIDEKAMM C, SCHAEFER-PROKOP C M, WEBER M, et al. CT angiography of pulmonary arteries to detect pulmonary embolism: improvement of vascular enhancement with low kilovoltage settings[J]. Radiology, 2006, 241(3): 899-907. DOI:10.1148/radiol.2413040128 |
| [7] |
胡亚美, 蒋载芳, 申昆玲, 等. 诸福堂实用儿科学(上)[M]. 8版. 北京: 人民卫生出版社, 2015: 1255.
|
| [8] |
中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童肺炎支原体肺炎诊治专家共识(2015年版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1308. |
| [9] |
朱敏, 潘莉, 钱文秀, 等. 儿童重症肺炎支原体肺炎凝血功能与内皮细胞功能变化分析[J]. 临床肺科杂志, 2019, 24(10): 1828-1833. |
| [10] |
SELIGMAN R, RAMOS-LIMA L F, OLIVEIRA VDO A, et al. Biomarkers in community-acquired pneumonia: a state-of-the-art review[J]. Clinics(Sao Paulo), 2012, 67(11): 1321-1325. |
| [11] |
侯月, 王俊宏, 陈芳, 等. D-二聚体水平变化对肺炎支原体肺炎患儿的临床意义[J]. 中国现代医学杂志, 2021, 31(13): 83-87. |
| [12] |
LIU J, HE R, WU R, et al. Mycoplasma pneumoniae pneumonia associated thrombosis at Beijing Children’s hospital[J]. BMC Infect Dis, 2020, 20(1): 51. |
| [13] |
DEGERSTEDT S G, WINANT A J, LEE E Y. Pediatric pulmonary embolism: imaging guidelines and recommendations[J]. Radiol Clin North Am, 2022, 60(1): 69-82. |
| [14] |
杨利新, 王蓓, 徐保平, 等. 儿童肺炎支原体肺炎合并肺栓塞的临床和影像学表现[J]. 实用放射学杂志, 2020, 36(5): 784-787. |
| [15] |
ZHANG X, YANG Q, GAO B, et al. Klebsiella pneumoniae infection associated septic pulmonary embolism in an emergency department from east China[J]. Ann Palliat Med, 2021, 10(2): 1521-1529. |
| [16] |
RIYAHI S, DEV H, BEHZADI A, et al. Pulmonary embolism in hospitalized patients with COVID-19: a multicenter study[J]. Radiology, 2021, 301(3): 426-433. |
| [17] |
CHEN S, DING Y, VINTURACHE A, et al. Pulmonary embolism associated with mycoplasma in a child[J]. Lancet Infect Dis, 2020, 20(11): 1347. |
| [18] |
DE ALMEIDA MENS I, NEVES V O. Hampton’s Hump[J]. N Engl J Med, 2021, 385(19): 1796. |
| [19] |
FINDIK S. Pleural effusion in pulmonary embolism[J]. Curr Opin Pulm Med, 2012, 18(4): 347-354. |
| [20] |
SOSA LOZANO L A, GOODMAN L R, SHAHIR K. Pulmonary embolism: optimizing the diagnostic imaging approach[J]. Hosp Pract(1995), 2010, 38(3): 153-162. |
| [21] |
PELLAND-MARCOTTE M C, TUCKER C, KLAASSEN A, et al. Outcomes and risk factors of massive and submassive pulmonary embolism in children: a retrospective cohort study[J]. Lancet Haematol, 2019, 6(3): 144-153. |
 2023, Vol. 21
2023, Vol. 21


