| 首发精神分裂症患者前额叶皮质T2信号强度变化的MRI研究 |
精神分裂症(schizophrenics,SZ)是一种慢性致残性精神类疾病,以多种严重精神症状长期持续或不断加重为特点,伴持久的缺陷性症状。作为与人类情感及认知功能密切相关的前额叶皮质在SZ的影像学研究中已得到广泛关注[1-2],但这些研究多局限于体积、功能方面,鲜有对其信号强度的研究。而MRI T2信号值可根据组织内的游离水及结合水变化反映组织中炎症、水肿、神经胶质增生等一系列病理改变[3]。故本研究对比首发未用药SZ与健康对照组前额叶皮质各亚区T2信号强度的变化,探讨该信号强度变化在诊断SZ中的价值,为SZ的早期诊断提供影像学帮助。
1 资料与方法 1.1 一般资料 1.1.1 SZ组收集2016年1月至2017年5月我院收治的首次发作的SZ患者。入组标准:未使用抗精神病药物且首次就诊,同时符合《中国精神障碍分类和诊断标准第3版修订本》和《美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)》[4]中的SZ诊断标准。排除神经系统及其他精神疾病、明确的器质性疾病。共入组34例,其中男18例,女16例;年龄19~57岁,平均(31±7)岁;平均受教育年限(14.2±2.8)年;病程(7±5)个月。入组时阳性和阴性症状量表(positive and negative syndrome scale,PANSS)阴性症状分数(23.74±3.85)分,PANSS阳性症状分数(23.38±3.96)分,PANSS一般病理分数(33.82±3.71)分,PANSS总分(84.71±7.13)分。
1.1.2 对照组来自本院职工或家属,躯体检查和实验室检查结果均未发现异常,排除神经、精神疾病,无严重烟、酒等滥用情况;否认2系3代精神疾病史。共入组35例,其中男18例,女17例;年龄18~55岁,平均(30±8)岁;平均受教育年限(16.4±2.1)年。
2组性别、年龄、受教育年限差异均无统计学意义(均P > 0.05)。2组均为右利手。本研究经医院伦理委员会批准,受试者均知情、并签署知情同意书。
1.2 仪器与方法受试者在检查前静坐休息30 min,向其解释检查过程及注意事项,强调检查时头部勿移动。采用Siemens 1.5 T MRI超导型扫描仪行头颅MRI扫描,定位于正中矢状面,行平行于脑干长轴的冠状斜切面扫描。扫描参数:①用于解剖结构定位的T1WI,采用FFE3D,射频脉冲TR 15 ms,TE 5 ms,NEX 5,FOV 220 mm×220 mm,矩阵512×512,翻转角150°,层厚1.5 mm,无间隔。②用于测量信号的T2WI,采用FSE,TR 4 500 ms,TE 94 ms,NEX 5,FOV 220 mm×220 mm,矩阵512×512,翻转角150°,层厚2.0 mm,无间隔。
1.3 前额叶皮质信号分析由3名影像科医师经过训练后,盲法测量前额叶皮质各部的T2信号,并在1周后重复测量,取平均值,以减少人为误差。测量方法:依据Toshiyuki等[2]的方法对前额叶皮质进行分区(分为额极、额上回、额中回、额下回4个部分),在工作站上手动勾画各部分ROI,计算机将自动给出ROI内的T2信号强度值。同时取每一受试者左右侧别各部的信号平均值(每一部分各选取2个层面)。
1.4 统计学方法采用SPSS 17.0统计学软件进行分析,计量数据以x±s表示,数据符合正态分布,组间比较采用两独立样本t检验。PANSS评分与前额叶皮质各亚区T2信号强度值相关性分析采用Pearson相关分析。以P < 0.05为差异有统计学意义。统计图使用GraphPad Prism6软件进行绘制。
2 结果 2.1 2组前额叶皮质各部分T2信号强度分析(表 1)| 表 1 2组前额叶皮质各亚区T2信号强度比较(x±s) |
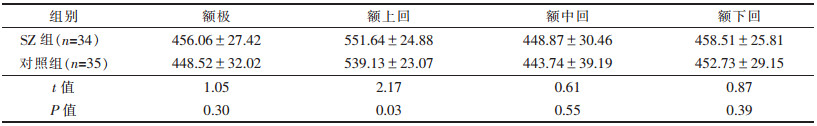 |
SZ患者额上回T2信号强度与对照组比较差异有统计学意义(t=2.17,P < 0.05);SZ患者额极、额中回、额下回T2信号强度与对照组比较差异均无统计学意义(t=1.05、0.61、0.87,均P > 0.05)。
2.2 T2信号值与PANSS分数的相关性分析(图 1)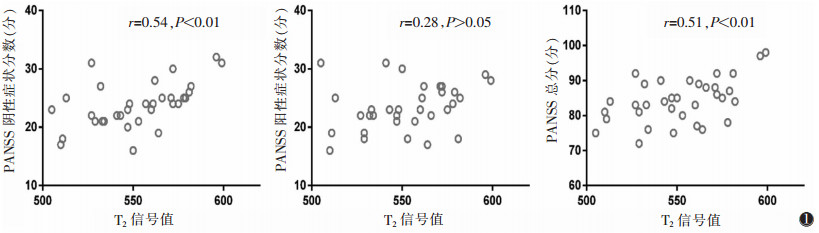 |
| 图 1 额上回T2信号值与PANSS分数的散点图(PANSS:阳性和阴性症状量表) |
额上回T2信号与PANSS阴性症状分数、PANSS总分均呈正相关(r=0.54、0.51,均P < 0.01)。
3 讨论SZ是一种常见的重性精神疾病,多起病于青壮年,病程迁延,复发率、致残率高,严重影响患者的生活质量。因此,越来越多的研究关注SZ的早期识别和干预,希望能改善其不良预后。SZ的病因及发病机制仍未明了。前额叶皮质与多种皮层及皮层下结构,包括杏仁体、扣带皮质、岛叶、丘脑、海马和纹状体在功能上都有高度的连接性[5]。大量神经影像学研究[6-7]表明,前额叶皮质结构及功能异常在SZ的发病机制中占重要地位。研究[8-10]显示,某些病理改变可导致组织T2信号强度的变化,且较T1信号的改变更敏感,其中最重要的病理改变为组织中含水量的变化,如组织囊性变或水肿及神经胶质增生。因此,本研究通过测量首发SZ患者前额叶皮质各部T2信号值探究其在SZ早期诊断中的价值,结果显示患者额上回T2信号强度与对照组比较差异有统计学意义(P < 0.05),额极、额中回、额下回差异均无统计学意义(均P > 0.05)。Toshiyuki等[2]通过3 T MRI手动测量SZ患者前额叶皮质各部体积,发现额上回体积较正常对照组显著缩小。新近的一项研究[11]通过定量测量SZ患者死后大脑局部灰质体积发现其额上回体积显著缩小,且该脑区的细胞炎症因子处于高表达状态。因此,笔者推测SZ患者额上回T2信号异常可能与神经细胞慢性炎性状态引起的神经细胞中毒、变性、水肿等病理生理改变有关,而炎性细胞的长期刺激引起神经细胞的凋亡及再生失衡,最终引起额上回皮质萎缩。
SZ临床症状复杂多样,多表现为以阳性症状为主和以阴性症状为主2种类型。多项研究[6,12]显示,SZ患者脑皮质结构及功能的变化与临床症状有很大的关联。本研究相关性分析显示,随着SZ患者PANSS阴性症状分数、总分的升高,额上回的T2信号相应升高,两者呈正相关。这与Wible等[13]关于前额叶皮质的损害与患者阴性症状的严重程度有明显关联的研究结果大致相同。笔者推测可能是阴性症状的加重与额上回细胞炎症因子的高表达状态之间的相互作用导致细胞水肿等一系列病理生理改变的加重,T2信号随之升高。既往研究[14]显示,超高危人群已出现阴性症状,即阴性症状较阳性症状对疾病的反应更敏感。故笔者认为额上回T2信号的改变可作为SZ早期诊断的一项较客观的影像学指标。
综上所述,本研究对首发SZ患者前额叶皮质各部T2信号进行了探讨,初步发现其变化特点及其与PANSS评分之间的相互关系,可为临床首发SZ的早期诊断提供新的影像学依据。因本研究样本量较小,且尚不清楚首发SZ个体前额叶皮质信号的转化结局,因此今后应扩大样本量,并进行随访,分析T2信号在疾病病程中的变化。
| [1] |
Forbers CE, Grafman J. The role of the human prefrontal cortex in social cognition and moral judgment[J]. Annu Rev Neurosci, 2010, 33: 299-324. DOI:10.1146/annurev-neuro-060909-153230 |
| [2] |
Toshiyuki O, James J, Paul G, et al. Prefrontal cortex volume de-ficit in schizophrenia:a new look using 3 T MRI with manual parcellation[J]. Schizophr Res, 2014, 152: 184-190. DOI:10.1016/j.schres.2013.10.026 |
| [3] |
罗一烽, 曹志宏, 王冬青, 等. 轻度阿尔茨海默病海马各区磁共振T2信号的研究[J]. 中华老年心脑血管病杂志, 2013, 15(1): 49-51. |
| [4] |
American Psychiatric Association. Diagnostic and Statistical Man-ual of Mental Disorders. (DSM-Ⅳ)[M]. 4th ED. Washington DC: American Psychiatric Association, 2000: 545-547.
|
| [5] |
Hoptman MJ, Angelo D, CatalanoD, et al. Amygdalofrontal functi-onal disconnectivity and aggression in schizophrenia[J]. Schizop-hr Bull, 2010, 36: 1020-1028. DOI:10.1093/schbul/sbp012 |
| [6] |
Kawada R, Yoshizumi M, Hirao K, et al. Brain volume and dyse-xecutive behavior in schizophrenia[J]. Prog Neuropsychopharm-acol Biol Psychiatry, 2009, 33: 1255-1260. DOI:10.1016/j.pnpbp.2009.07.014 |
| [7] |
Rimol LM, Hartberg CB, NesvagR, et al. Cortical thickness and subcortical volumes in schizophrenia and bipolar disorder[J]. Biol Psychiatry, 2010, 68: 41-50. DOI:10.1016/j.biopsych.2010.03.036 |
| [8] |
Laakso MP, Partanen K, Soininen H, et al. MR T2 relaxometry in Alzheimer's disease and age-associated memory impairment[J]. Neurobiol Aging, 1996, 17: 535-540. |
| [9] |
Ramani A, Jensen JH, Helpern JA. Quantitative MR imaging in Alzheimer disease[J]. Radiology, 2006, 241: 26-44. DOI:10.1148/radiol.2411050628 |
| [10] |
Fiorelli M, Aceti F, MariniI, et al. Magnetic resonance imaging studies of postpartum depression:an overview[J]. Behav Neurol, 2015, 7: 843-913. |
| [11] |
Zhang Y, Catts VS, Sheedy D, et al. Cortical grey matter volume reduction in people with schizophrenia is associated with neuro-inflammation[J]. Transl Psychiatry, 2016, 6: 1-10. |
| [12] |
Hirshorn EA, Thompson SL. Role of the left inferior frontal gy-rus in covert word retrieval:neural correlates of switching duri-ng verbal fluency[J]. Neuropsychologia, 2006, 44: 2547-2557. DOI:10.1016/j.neuropsychologia.2006.03.035 |
| [13] |
Wible CG, Anderson J, Shenton ME, et al. Prefrontal cortex, ne-gative symptoms, and schizophrenia:an MRI study[J]. Psychiatry Res, 2001, 108: 65-78. DOI:10.1016/S0925-4927(01)00109-3 |
| [14] |
Piskulic D, Addington J, Cadenhead KS, et al. Negative sympto-ms in individuals at clinical high risk of psychosis[J]. Psychi-atry Res, 2012, 196: 220-224. DOI:10.1016/j.psychres.2012.02.018 |
 2018, Vol. 16
2018, Vol. 16


