| 原发性睾丸淋巴瘤的MRI表现 |
原发性睾丸淋巴瘤(primary testicular lymphoma,PLT)属于原发性结外非霍奇金淋巴瘤,占全身非霍奇金淋巴瘤的1%~2%,占睾丸肿瘤的1%~9%[1],较罕见,其中弥漫大B细胞淋巴瘤约占75%[2]。其起病隐匿,多以无痛性睾丸肿大为主诉,但恶性程度高,且极易复发,因此,术前准确判断肿瘤性质有助于临床制订合理的治疗方案。MRI组织分辨力高且无创,对睾丸占位性病变的定位、侵犯范围、病理类型及临床分期的判断有重要价值,但国内外学者对PLT的MRI表现探究较少。因此,本研究分析8例PLT的MRI表现,旨在提高对该病的术前诊断水平。
1 资料与方法 1.1 一般资料收集2012年1月至2020年1月经病理证实的PLT患者8例,均为弥漫大B细胞淋巴瘤;年龄46~81岁,平均(60.6±9.8)岁。临床表现:阴囊内进行性增大的无痛肿块7例,肿瘤性病变伴触痛1例,病变阴囊表面颜色均无明显变化,皮温未升高。纳入标准:①睾丸及附属结构为首发部位,诊断时可有区域淋巴结侵犯;②确诊3个月内无其他部位侵犯;③有明确病理诊断[3-4]。
1.2 仪器与方法8例均行MRI平扫,其中3例加行增强扫描。采用Siemens Avanto 1.5 T超导型MRI扫描仪,6通道体部相控阵线圈。患者取仰卧位,用毛巾夹于大腿根部托起阴囊以减少运动伪影。扫描序列及参数:T1WI TR 400~700 ms,TE 5~20 ms;矢状位、冠状位及轴位脂肪抑制T2WI,TR 4 000~6 000 ms,TE 80~100 ms;增强扫描使用对比剂Gd-DTPA,剂量0.1 mmol/kg体质量,以2~3 mL/s的流率经肘静脉注射;DWI b值取50、800 s/mm2,行轴位单次激发平面回波成像脉冲序列SS-EPI扫描,TR 4 000~6 000 ms,TE 9~15 ms;以上序列层厚5 mm,层距1 mm,激励次数2,矩阵320×272,视野(220 mm~260 mm)×(220 mm~260 mm)。
1.3 PLT的局部分期[5-6]参照国际癌症联盟及欧洲生殖细胞肿瘤研究委员会推荐的睾丸恶性肿瘤局部分期对PLT进行分期:T0期,肿瘤局限于睾丸内,周围可见正常睾丸组织包绕或睾丸周围可见完整睾丸白膜的低信号环;T1期,肿瘤侵犯睾丸白膜或附睾,未侵犯睾丸鞘膜;T2期,肿瘤侵犯睾丸鞘膜;T3期,肿瘤侵犯精索;T4期,肿瘤侵犯阴囊壁。
1.4 图像分析由2位具有5年以上影像诊断经验的主治医师采用双盲法对T2WI信号的高低、均匀性、有无瘤内坏死及有无包膜等征象进行分析。
2 结果 2.1 MRI表现8例中,单侧6例,双侧2例,病灶平均大小4.5 cm×4.3 cm×4.4 cm;5例呈圆形或类圆形,3例呈不规则分叶状。T1WI上7例病灶呈低信号(图 1a),1例呈等信号;T2WI上6例呈均匀低信号(图 1b),2例信号不均匀、以低信号为主(图 2a);增强扫描3例中,1例动态增强扫描呈轻度延迟强化(图 1c)、TIC为速升平台型(图 1d),1例病灶内可见小坏死灶而呈不均匀轻度强化,1例呈轻度均匀强化;DWI均呈高信号,ADC图呈明显低信号(图 2b,2c)。8例均见睾丸鞘膜积液,T1WI呈低信号,T2WI呈高信号,无强化。2例见小坏死灶(图 2a),但8例均未见出血及瘤周包膜改变。
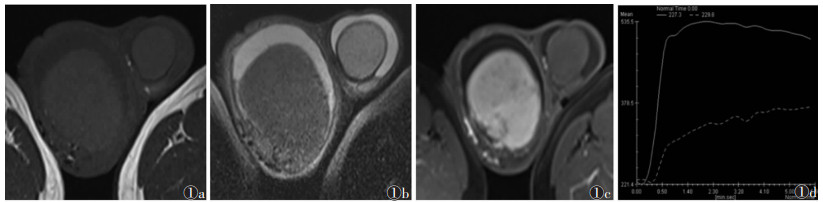 |
| 图 1 男,57岁,右侧淋巴瘤 图 1a,1b 分别为T1WI及T2WI,病变均呈低信号 图 1c MRI增强扫描示病变呈较轻度延迟强化 图 1d TIC呈速升平台型 |
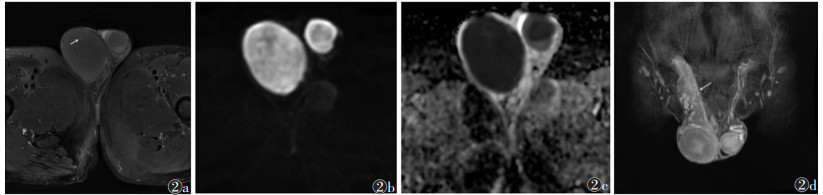 |
| 图 2 男,63岁,双侧淋巴瘤 图 2a FS-T2WI示病变呈低信号,其内小坏死灶呈高信号(白箭) 图 2b DWI呈明显高信号 图 2c ADC图呈低信号,右侧病变ADC值0.35×10-3 mm2/s,左侧病变ADC值0.48×10-3 mm2/s 图 2d MRI增强扫描呈明显强化,病变累及右侧精索(白箭) |
2.2 肿瘤局部分期及转移情况
8例均穿破白膜,表现为睾丸周围T2WI低信号环连续性中断;2例侵犯精索(图 2d),T2WI表现为精索增粗、迂曲,增强扫描呈轻度强化;5例侵犯附睾;5例累及睾丸鞘膜,T2WI表现为肿瘤与附睾及睾丸鞘膜分界不清(图 3b)。T1期3例,T2期3例,T3期2例;与术后病理对比,1例病理评估侵犯睾丸鞘膜评定为T3期,而MRI未发现鞘膜侵犯,评定为T2期,总体准确率为87.5%(7/8)。2例有双侧腹股沟淋巴结转移。
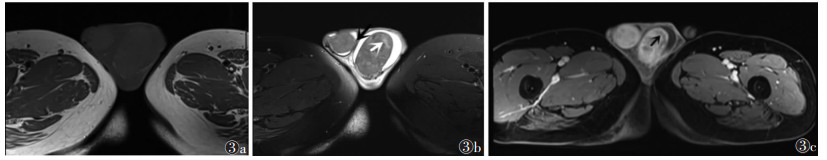 |
| 图 3 男,64岁,双侧淋巴瘤 图 3a T1WI呈低信号 图 3b T2WI呈混杂低信号,其内小坏死灶呈高信号(白箭),病变累及睾丸鞘膜(黑箭) 图 3c MRI增强扫描病变呈不均匀轻度强化,坏死灶未见明显强化(黑箭) |
2.3 病理学表现
大体标本,肿块质硬,切面灰白。镜下见肿瘤细胞体积较大,呈圆形或椭圆形,胞质丰富红染,可见单个中位核仁,核分裂象多见,肿瘤细胞围绕曲细精管弥漫浸润生长并伴少许纤维组织增生,生精小管广泛萎缩,生精成分减少。免疫组化:8例均表现为CD20、CD3及Mum-1阳性,细胞增殖指数Ki-67表达率高,平均约55%。
2.4 临床治疗及随访8例均行睾丸根治切除术,术后行6期化疗,5例接受区域淋巴结及对侧睾丸放射治疗。随访5~88个月,8例均无明确复发、转移灶。
3 讨论PLT多见于60岁以上的老年男性[7],本研究8例平均年龄(60.6±9.8)岁。研究[8]报道PLT可累及双侧睾丸,占PLT的10%~40%,本研究中2例(25.0%)累及双侧睾丸。临床上多表现为阴囊内进行性增大的无痛性肿块,全身症状少见,本研究除1例一侧睾丸触痛外,余均为无痛性肿块,从发病至就诊时间为2~12周。PLT细胞异型性明显,核分裂象多见,且有向结外器官浸润、复发的倾向,最常见的结外器官为中枢神经系统及对侧睾丸。本研究腹股沟淋巴结转移2例,但未侵犯中枢神经系统及睾丸。治疗以睾丸根治术为主,术后多采用6期R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松)的化疗方案,因PLT复发及结外器官侵犯较生殖细胞瘤常见,所以鞘内预防性注射及对侧睾丸、区域淋巴结放射治疗也同样重要。
3.1 PLT的MRI表现PLT恶性程度高、易复发,术前早发现、早诊断对改善患者预后至关重要。MRI组织分辨力高且无创,对睾丸占位性病变的定位、侵犯范围、病理类型及临床分期的判断有重要价值。但国内外有关PLT的MRI表现的报道较少,多以个案或综述的形式呈现,文献[9-12]报道,与正常睾丸实质相比,T1WI呈等或低信号,T2WI多呈均匀低信号,DWI呈高信号,ADC呈明显低信号,增强扫描呈轻度强化,肿瘤信号多较均匀,坏死、出血及瘤内分隔少见,也有报道[13]PLT增强扫描时呈不均匀明显强化。本研究7例T1WI呈低信号,1例呈等信号;6例T2WI呈低信号,2例呈混杂低信号,瘤内坏死区T2WI呈高信号;DWI呈明显高信号,ADC呈明显低信号;3例增强扫描中,1例呈轻度均匀强化,1例强化略欠均匀,1例动态增强扫描呈轻度延迟强化、TIC呈速升平台型,与国内外研究大致相同。PLT病理示淋巴瘤细胞成分单一,排列紧密,胞浆丰富,肿瘤细胞弥漫浸润睾丸曲细精管,导致曲细精管僵硬、萎缩及睾丸间质纤维化,致使肿瘤含水量低于正常睾丸实质,并使水分子自由扩散受限,睾丸间质的纤维化及残存的血-睾屏障使毛细血管相对稀疏,使对比剂进出毛细血管的时间延迟,而表现为延迟强化。
PLT手术方式的选择及患者的预后与PLT的局部肿瘤分期密切相关。MRI因其组织分辨力高,在判断肿瘤周围侵犯方面较CT或超声检查均有优势。Tsili等[5, 14]分别对14、28例睾丸恶性肿瘤的局部分期进行评估,其准确率分别为86%、92.8%。但国内外鲜有学者对PLT单独进行局部分期报道,本研究8例PTL均穿破白膜,其中5例侵犯附睾;5例累及睾丸鞘膜,2例侵犯精索,即T1期3例,T2期3例,T3期2例,与术后病理结果对比,准确率为87.5%,进一步验证了MRI对评估PLT局部分期的可行性。
3.2 鉴别诊断由于PLT无特异性临床症状和实验室指标,术前诊断符合率常较低,本研究8例中,仅3例术前影像检查诊断为淋巴瘤,5例诊断为生殖细胞瘤,因此,术前应与生殖源性肿瘤、间质源肿瘤及炎性肉芽肿进行鉴别:①精原细胞瘤,是睾丸最常见的肿瘤性病变,好发年龄30~50岁,肿瘤多呈分叶状,T2WI呈稍低信号,瘤内多见低信号间隔,增强扫描分隔强化程度高于肿瘤实质。②非精原细胞瘤,以混合性生殖细胞瘤最多见,瘤内成分混杂,囊变、坏死常见,实性部分明显强化,肿瘤边界多欠清。③内胚窦瘤,好发于婴幼儿及青少年性腺,血清甲胎蛋白显著升高,T2WI多呈混杂高信号。④畸胎瘤,呈多囊样改变,可见脂肪、钙化成分、T2WI低信号分隔及包膜,肿瘤包膜不完整,提示恶变可能。⑤间质瘤,为性索-间质来源的良性肿瘤,多见于年轻男性,T2WI呈结节状低信号,其内可有坏死、囊变,增强扫描呈明显延迟强化。⑥炎性肉芽肿,多表现为不规则肿块伴疼痛及发热,病变可累及睾丸鞘膜及阴囊,T1WI呈等或稍低信号,T2WI呈混杂高信号,强化多不均匀。
总之,老年男性出现睾丸无痛性肿大、T2WI呈均匀低信号、增强扫描呈轻度强化、肿瘤向周围侵犯生长,应考虑PLT的可能。综合分析MRI表现能提高该病术前诊断的准确率,有助于临床精准治疗及预后评估。
| [1] |
LIU K L, CHANG C C, HUANG K H, et al. Imaging diagnosis of testicular lymphoma[J]. Abdom Imaging, 2006, 31(5): 610-612. DOI:10.1007/s00261-005-0115-0 |
| [2] |
CASTRODEZA A V, NIETO A T, GONZALEZ M M, et al. Diagnosis of a primary testicular lymphoma by echography and magnetic resonance imaging[J]. Clin Transl Oncol, 2006, 8(6): 456458. |
| [3] |
廖冶丹, 谢琳. 原发性睾丸淋巴瘤的诊断及治疗进展[J]. 医学综述, 2017, 23(22): 4443-4447. |
| [4] |
杨志蓉, 刘卫平. 睾丸淋巴组织肿瘤的研究进展[J]. 临床与实验病理学杂志, 2013, 29(8): 902-906. |
| [5] |
TSILI A C, ARGYROPOULOU M I, GIANNAKIS D, et al. MRI in the characterization and local staging of testicular neoplasms[J]. AJR Am J Roentgenol, 2010, 194(3): 682-689. DOI:10.2214/AJR.09.3256 |
| [6] |
KREGE S, BEYER J, SOUCHON R, et al. European consensus on diagnosis and treatment of germ cell cancer:a report of the second meeting of the European Germ Cell Cancer Consensus group(EGCCCG):Part Ⅱ[J]. Eur Urol, 2008, 53(3): 478-496. |
| [7] |
LOKESH K N, SATHYANARAYANAN V, KUNTEGOWDANAHALLI C L, et al. Primary Diffuse large B-Cell lymphoma of testis:a single centre experience and review of literature[J]. Urol Ann, 2014, 6(3): 231-234. DOI:10.4103/0974-7796.134277 |
| [8] |
BHATIA K, VAID A K, GUPTA S, et al. Primary testicular nonHodgkin's lymphoma——a review article[J]. Sao Paulo Med J, 2007, 125(5): 286-288. |
| [9] |
龙德云, 杜开齐, 柳杰, 等. 原发性睾丸淋巴瘤的MRI表现及其鉴别诊断[J]. 中国医学影像技术, 2013, 29(6): 972-975. |
| [10] |
肖桂卿, 张玮, 邹松, 等. 原发性睾丸淋巴瘤的CT和MRI评价[J]. 医学影像学杂志, 2013, 23(11): 1763-1765, 1770. |
| [11] |
MITTAL P K, ABDALLA A S, CHATTERJEE A, et al. Spectrum of extratesticular and testicular pathologic conditions at scrotal MR Imaging[J]. Radiographics, 2018, 38(3): 806-830. DOI:10.1148/rg.2018170150 |
| [12] |
MATHUR M, MILLS I, SPEKTOR M. Magnetic resonance imaging of the scrotum:pictorial review with ultrasound correlation[J]. Abdom Radiol (NY), 2017, 42(7): 1929-1955. DOI:10.1007/s00261-017-1127-2 |
| [13] |
TSILI A C, ARGYROPOULOU M I, GIANNAKIS D, et al. Primary diffuse large B-cell testicular lymphoma:magnetic resonance imaging findings[J]. Andrologia, 2012, 44(Suppl 1): 845-847. |
| [14] |
李敏, 蒋涛. 睾丸肿瘤的MRI表现[J]. 中华放射学杂志, 2013, 47(9): 820-823. |
 2021, Vol. 19
2021, Vol. 19


