| 溃疡性结肠炎的MSCT表现分析 |
2. 山东大学齐鲁医院放射科, 山东 济南 250012
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性炎性肠病,发病率逐年升高,但目前病因尚未完全明确,诊断需结合临床、影像学、内镜及病理等综合分析[1]。本文回顾性分析经临床随诊、病理证实的26例UC的MSCT资料,以提高对该病的影像诊断水平,为临床提供更多信息。
1 资料与方法 1.1 一般资料收集山东中医药大学附属医院2018年2月至2020年8月收治的26例UC患者,其中男15例,女11例;年龄17~65岁,平均(39.2±10.5)岁。主要临床表现为腹痛、腹泻、里急后重和黏液脓血便等。
1.2 仪器与方法患者于检查前一晚禁食,口服泻药清洁肠道。CT检查前口服2.5%甘露醇1 800 mL,50 min内服完,再口服200 mL以充盈胃及十二指肠,并将2.5%甘露醇400 mL于肛门注入肠道。
CT检查采用Siemens双源螺旋CT机。患者取仰卧位,扫描范围为膈顶至坐骨结节水平处。扫描参数:120 kV,230~270 mAs,层厚、层距均为5 mm。增强扫描对比剂为优维显(碘浓度300 mg/mL),剂量1.5 mL/kg体质量,注射流率3.0~4.0 mL/s。行动脉期(对比剂注入后25~30 s)、静脉期(55~60 s)及延迟期(3~5 min)扫描。扫描所得数据重建为层厚0.625 mm、层距0.5 mm图像,在工作站行MPR、曲面重组、MIP及CT仿真内窥镜等图像后处理。
1.3 影像分析由2位放射科副主任诊断医师分析图像,判断病变的部位和范围、病变肠壁厚度和强化方式、肠黏膜面和肠腔情况、肠系膜密度和肠系膜血管影情况、肠系膜淋巴结增大和肠腔外情况。病变肠壁厚度由2位医师分别在静脉期轴位图像测量,取平均值。
2 结果26例中,7例仅累及直肠、乙状结肠,13例累及直肠、乙状结肠和降结肠,6例为全结肠UC。25例出现肠壁增厚(图 1),厚度5~10 mm,平均(6.5±2.1)mm。16例病变肠壁浆膜面光滑,10例浆膜面周围可见细小条索影。21例病变肠黏膜明显强化。12例肠黏膜面多发结节样、丘状突起(图 2),10例肠黏膜下气泡。14例出现肠壁分层(图 1),表现为靶征或双环征。9例肠腔狭窄、结肠袋消失、肠管缩短变形(图 3)。17例肠系膜密度增加,15例肠系膜血管增多增粗。7例肠系膜淋巴结增大(图 4)。
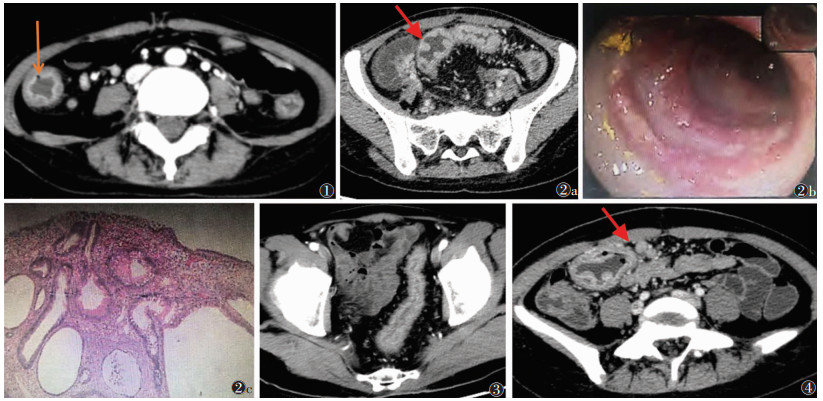 |
| 图 1 女,33岁。全结肠溃疡性结肠炎,CT示升结肠和降结肠肠壁增厚,肠壁分层,黏膜明显强化,升结肠可见黏膜下气泡(箭头) 图 2 女,25岁 图 2a CT示乙状结肠肠壁不规则增厚,黏膜见多发结节样、丘状明显强化假息肉突起(箭头) 图 2b 肠镜示乙状结肠弥漫黏膜糜烂,充血水肿,表面覆盖脓液 图 2c 病理示乙状结肠黏膜急慢性炎症,伴肉芽组织及小脓肿形成,隐窝结构变形,腺体细胞嗜酸性变 图 3 男,51岁。CT示乙状结肠肠壁增厚、僵硬,结肠袋消失,肠腔变细,肠系膜血管增多,肠外脂肪沉积 图 4 女,17岁。CT示右半横结肠肠壁增厚,黏膜不光整,肠管左侧见多个增大淋巴结(箭头) |
3 讨论
UC好发于20~40岁,少数患者50岁后发病,无明显性别差异,临床表现为腹痛、腹泻、里急后重和黏液脓血便等,可伴有不同程度的关节、皮肤、胆管、口、眼、肺、神经系统等肠外症状,严重者可并发中毒性巨结肠和继发性癌变[2]。UC的临床症状无特异性,临床鉴别诊断困难,病理诊断有时也存在很大困难。肠镜检查存在一定局限性,无法了解肠道黏膜下层、浆膜层病变及肠外情况,对肠腔狭窄明显患者应用受限,存在并发肠穿孔、肠出血的风险等[3]。而MSCT无创、快速、能够进行薄层扫描,有较高的空间和密度分辨力及强大的后处理功能,可清晰显示肠腔内外的情况;CT表现与临床症状、肠镜、病理相结合有助于医师准确、个性化诊治UC[4]。
CT检查前须充分清洁扩张肠管以清楚显示肠壁及肠腔情况,肠管充盈不良会影响对病情的准确判断,造成漏误诊。CT多期增强扫描不仅可显示肠壁和周围结构及病变肠管的强化程度,还能显示肠系膜动脉和肠系膜静脉有无栓塞、狭窄、扩张及血管分支有无增多、稀疏等。
总结分析本组UC的CT表现特点为:①肠壁增厚。正常肠壁厚约3 mm,本组肠壁厚度5~10 mm,平均(6.5±2.1)mm。黏膜及黏膜下层充血水肿、炎细胞浸润造成肠壁连续性、均匀对称的轻度增厚。病变多自直肠开始,向近端发展,本组7例仅累及直肠、乙状结肠,13例累及直肠、乙状结肠和降结肠,6例为全结肠UC。MPR、曲面重组可显示病变的全程。由于UC的炎性改变多累及黏膜和黏膜下层,较少累及固有肌层和浆膜层,故本组16例病变肠壁浆膜面光滑。本组10例浆膜面周围可见细小条索影,发生率较文献[5]报道多,可能与UC处于活动期或病变程度较重有关。若出现肠壁周围游离气体、炎性渗出等情况,则提示发生肠穿孔。应注意,UC早期可能仅表现为肠黏膜轻度增厚,CT检查易漏诊,应密切结合临床及肠镜。②肠黏膜明显强化、浅溃疡和小息肉形成。本组21例病变肠黏膜明显强化,原因可能为结肠黏膜炎性水肿致使血管通透性增大。早期UC患者的肠黏膜充血水肿呈弥漫细颗粒状,质脆,易出血,形成广泛浅小溃疡。后期肠黏膜大量新生肉芽组织增生,形成炎性息肉,表现为肠黏膜面凹凸不平,弥漫分布突向肠腔多发结节样、丘状突起,排列呈锯齿状、波浪状,直径3~5 mm,明显强化。CT仿真内窥镜图像可直观显示以上情况。③黏膜下气泡。隐窝脓肿、黏膜面溃疡在CT上可表现为肠黏膜下小圆形气泡。④肠壁分层。该征象多提示为活动性UC,病变肠壁横断面在CT增强扫描图像上表现为靶征或双环征,内层由充血增厚的黏膜形成,明显强化;黏膜下层水肿形成中间较宽的低密度层;外层为强化的浆膜。⑤肠壁僵硬、肠腔狭窄、结肠袋消失。重症患者病变肠管纤维化,肠壁僵硬,肠腔狭窄,结肠袋变浅或消失,呈铅管样。溃疡愈合瘢痕造成肠管缩短变形。少数患者可出现肠腔扩张。⑥肠系膜密度增加、肠系膜侧血管增多。长期慢性炎症刺激造成肠系膜密度增高,血管边缘模糊,肠外脂肪沉积。肠系膜充血水肿,以及肠系膜静脉回流受阻导致的小动脉充血扩张造成肠系膜侧血管增多、增粗,呈梳状排列,或呈蜈蚣足样迂曲分布,常提示病变处于活动期。⑦肠系膜淋巴结增大。炎症刺激造成淋巴结增大,增大的淋巴结沿肠系膜血管走行方向分布,无融合倾向,直径多<10 mm。若出现肠壁局限性明显增厚及周围淋巴结明显增大,则应考虑癌变可能。
UC应与以下疾病进行鉴别诊断:①克罗恩病,主要位于小肠和回盲部,呈节段性、跳跃性分布。肠壁多为非对称性增厚,累及肠壁全层,浆膜面多不光滑,易发生蜂窝织炎、肠瘘、腹腔脓肿和肛周脓肿等[6]。②缺血性结肠炎,由于动脉供血不足或静脉回流受阻引起的结肠缺血性损伤[7],多见于老年人。2支不同血管的交汇处分水岭区域侧支循环少,是缺血的好发部位,包括结肠脾曲和乙状结肠。肠缺血的程度随供血血管(腹主动脉、肠系膜上动脉或肠系膜下动脉)及狭窄程度而异,病变可为弥漫性或节段性。CT除可显示缺血肠管呈环状、对称性增厚外,还可显示动脉内血栓、瘤栓及夹层等。
总之,MSCT可清晰显示UC患者的肠壁、肠系膜血管情况及肠外表现,明确疾病的累及范围和严重程度、判断病变的时期(活动期或缓解期),在UC的诊断、评估病情、制订个体化治疗方案,以及评价疗效、判定预后等方面具有重要应用价值。
| [1] |
吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年, 北京)[J]. 中华消化杂志, 2018, 38(9): 796-813. |
| [2] |
SATO H, OKADA F, MATSUMOTO S, et al. Chest high-resolution computed tomography findings in 601 patients with inflammatory bowel diseases[J]. Acad Radiol, 2018, 25(4): 407-414. DOI:10.1016/j.acra.2017.10.010 |
| [3] |
王笑, 唐翠松, 李伟, 等. 多层螺旋CT小肠造影和消化内镜对炎症性肠病诊断价值的评价[J]. 医学影像学杂志, 2015, 25(12): 2170-2174. |
| [4] |
DEEPAK P, AXELRAD J E, ANANTHAKRISHNAN A N. The role of the radiologist in determining disease severity in inflammatory bowel diseases[J]. Gastrointest Endosc Clin N Am, 2019, 29(3): 447-470. DOI:10.1016/j.giec.2019.02.006 |
| [5] |
彭明洋, 张丹凤, 张卫东, 等. CT小肠造影对克罗恩病和溃疡性结肠炎的鉴别诊断价值[J]. 东南大学学报(医学版), 2019, 38(3): 511-514. |
| [6] |
韩欣平, 刘松峰, 郭玉芳. 64排CT小肠造影对肠道炎性病变的诊断价值[J]. 临床医学, 2019, 39(11): 57-58. |
| [7] |
BRANDT L J, FEUERSTADT P, LONGSTRETH G F, et al. ACG clinical guideline: epidemiology, risk factors, patterns of presentation, diagnosis, and management of colon ischemia (CI)[J]. Am J Gastroenterol, 2015, 110(1): 18-45. DOI:10.1038/ajg.2014.395 |
 2021, Vol. 19
2021, Vol. 19


