| 基于HRCT影像组学、临床特征与SUVmax的联合模型列线图预测cT1N0M0期肺腺癌脏层胸膜浸润的价值 |
2. 上海健康医学院上海市分子影像学重点实验室, 上海 201318;
3. 同济大学附属上海市肺科医院放射科, 上海 200433;
4. 复旦大学附属华山医院放射科, 上海 200040;
5. 上海中医药大学附属曙光医院针灸科, 上海 201203
肺癌是全球第二大最常见的癌症,腺癌是其中最常见的亚型[1]。最新的TNM分类(第八版)[2]将脏层胸膜浸润(visceral pleural invasion, VPI)作为肺癌TNM分类的独立因子,伴VPI肺癌患者更易发生局部复发和淋巴结转移[3], cT1M0N0期伴VPI患者应行肺叶切除术及纵隔淋巴结清扫,必要时行术后辅助化疗。研究报道,CT特征可能是术前VPI的独立预测因子,如胸膜凹陷、结节与胸膜的关系、结节与胸膜的距离、结节密度及实性成分占比等,但其准确率仅为62.7%~83.7%[4-7]。有文献报道18F-FDG PET中最大标准化摄取值(the maximum standardized uptake value, SUVmax)与非小细胞肺癌的VPI显著相关[8-10]。影像组学近年来已被广泛用于肺癌的诊断和预后预测中,但有关其评估肺腺癌患者是否存在VPI的研究较少[11-13]。本文联合CT影像组学、临床特征与SUVmax构建列线图模型,分析其预测肺腺癌VPI的价值。
1 资料与方法 1.1 一般资料连续收集2020年1—6月在同济大学附属上海市肺科医院接受手术切除,并行HRCT和18F-FDG PET/CT扫描的cT1N0M0期肺腺癌患者155例(157个病灶)。其中,男66例(42.6%),女89例(57.4%),平均年龄(60.48±10.28)岁。157个病灶中,病理证实有胸膜浸润47个。纳入标准:(1)病灶直径≤3 cm,临床诊断为cT1N0M0期;(2)术前30 d内行HRCT和18F-FDG PET/CT扫描;(3)经病理证实为肺腺癌,通过弹性染色判断胸膜浸润与否。排除标准:(1)CT图像上肿瘤直径 > 3 cm; (2)病理无法评估胸膜浸润与否;(3)由于呼吸伪影、肺炎或肺不张导致图像分割困难;(4)单纯磨玻璃结节。本研究经医院伦理委员会批准,且免除患者知情同意权。
1.2 仪器与方法 1.2.1 CT检查采用Siemens Somatom Definition AS或Philips Brilliance 40 CT扫描仪,患者取仰卧位,扫描范围由双肺尖至肋膈角(包括全肺)。扫描参数:120 k V,自动管电流,1.0 mm层厚重建。86例加行增强扫描。
由2位经验丰富的放射科医师分别使用肺窗(窗宽1 200 HU,窗位500 HU)和纵隔窗(窗宽400 HU,窗位60 HU)分析图像。意见不同时,经讨论达成一致。图像分析包括:结节密度(实性/部分实性),最大直径,边缘(分叶/毛刺),有无空气支气管征,结节与胸膜的关系(6种,图 1),结节距胸膜的最小距离,以及有无肺气肿。
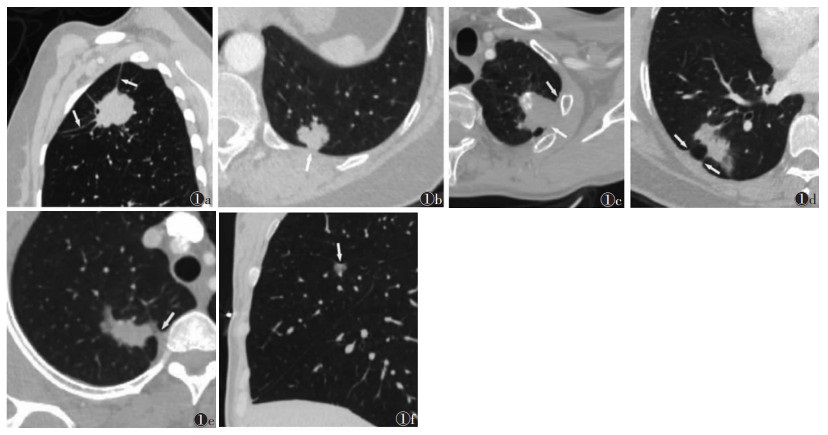 |
| 注:图 1a为结节与胸膜以单纯线样影连接(箭头);图 1b为结节与胸膜自然接触,无增厚、皱缩(箭头);图 1c为结节与胸膜接触伴胸膜增厚(箭头);图 1 d为结节与胸膜接触,胸膜呈喇叭样改变(箭头);图 1e为结节与胸膜接触,胸膜呈三角形改变(箭头);图 1f为结节与胸膜接触,胸膜呈脐凹样改变(箭头) 图 1 结节与胸膜的关系(6种) |
1.2.2 18F-FDG PET/CT扫描和SUVmax测量
使用Siemens全身PET/CT扫描仪(Biograph Mct Flow64, Erlangen)。检查前患者需空腹4~6 h。血糖控制在11.1 mmol/L以下。经静脉注射18F-FDG,剂量为0.10~0.15 m Ci/kg体质量。常规扫描层厚3 mm,扫描胸部时,加行层厚为1 mm的薄层CT图像重建。标准化摄取值(the standardized uptake value, SUV)依据体质量进行归一化[14]。SUVmax按照每例患者原发肺肿瘤体素的最高值计算。
1.3 病理分析由2名经验丰富的病理科医师通过弹性染色进行VPI评估,意见不同时,经协商达成一致:PL0,肿瘤局限于胸膜下肺实质或侵入胸膜结缔组织但尚未侵及弹力层;PL1,肿瘤侵犯超出弹力层,但未到达胸膜表面;PL2,肿瘤侵犯达脏层胸膜表面[15]。将PL1和PL2称为VPI阳性,PL0称为VPI阴性。
1.4 肿瘤分割与影像组学特征提取使用3.8.0版本ITK-SNAP软件手动分割结节[16],由1位经验丰富的放射科医师逐层勾画结节边缘,并生成立体感兴趣区(VOI)。由另1位经验丰富的放射科医师复阅分割结果,发现分割不准确时,进行局部纠正。用PyRadiomics软件提取CT图像特征,最终提取1 158个影像组学特征。
1.5 计算影像组学评分157个病灶按照7∶3的比例随机的分配到训练集(110个)和测试集(47个)。(1)采用合成少数类采样技术(synthetic minority over-sampling technique, SMOTE)算法进行数据不均衡校正。(2)采用最大相关最小冗余(minimum redundana and maximum relevance, mRMR)算法进行特征筛选,保留20个彼此相关程度较低,但与胸膜侵犯最为相关的特征。(3)用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法筛选最终的特征子集,并计算特征对应的系数,得到影像组学评分的公式。
1.6 构建临床模型和联合模型列线图将SUVmax与常规临床特征共同构建临床模型。采用单因素逻辑回归分析对临床因素进行筛选,保留P < 0.05的特征,然后采用多因素逻辑回归分析,构建多因素逻辑回归的临床模型。最后将临床模型中的临床特征与影像组学评分结合,采用多因素逻辑回归分析,构建联合模型,并用列线图进行可视化展示。
1.7 模型验证采用训练集和测试集分别对影像组学评分、临床模型和联合模型进行验证。ROC曲线用于评估模型的诊断效能,在ROC曲线上找到最佳截断值,计算模型的准确率、敏感度、特异度、阳性预测值及阴性预测值。校准曲线分析用于评估模型预测概率与真实观测概率的一致性,即判断模型的校准能力。决策曲线分析用于评估模型对患者的临床获益。
1.8 统计学分析统计分析和模型构建使用R统计软件。连续变量如符合正态分布,以x+s表示,方差齐性组间比较行独立样本t检验;否则行Wilcoxon秩和检验。分类变量用百分比表示,行Fisher确切概率法或χ2检验。采用Wilcoxon秩和检验对比胸膜浸润病灶与非胸膜浸润病灶影像组学评分的差异。约登指数用于判断模型的最佳截断值,并计算模型的准确率、敏感度、特异度、阳性预测值与阴性预测值。DeLong检验用于对比不同模型之间的效能。Hosmer-lemeshow检验用于评估模型的拟合优度。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组一般资料及临床特征比较(表 1)| 表 1 训练集和测试集一般资料及临床特征比较 |
 |
157个病灶按7∶3的比例将病灶随机分成训练集(110个)和测试集(47个),2组一般资料及临床特征比较,差异均无统计学意义(均P > 0.05)。
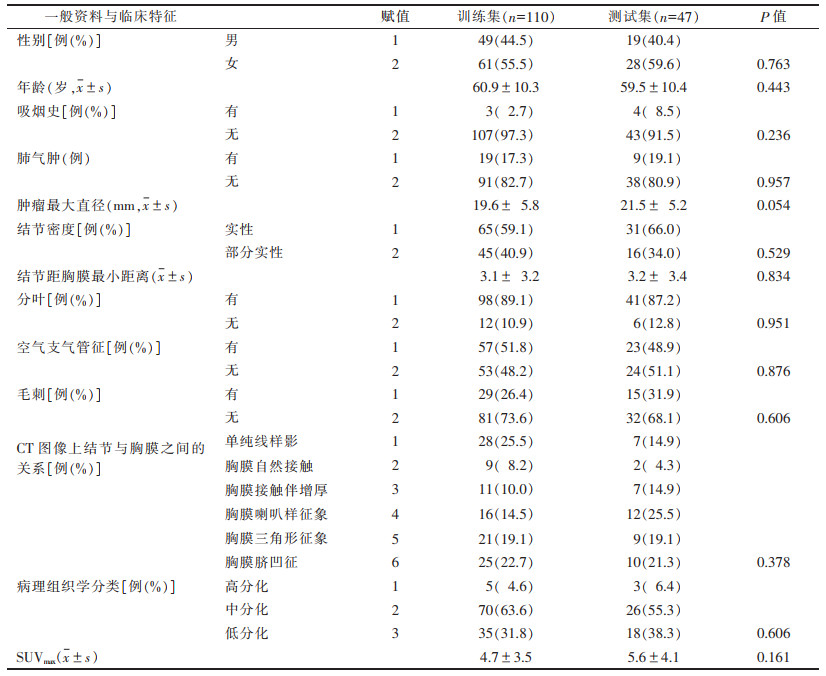
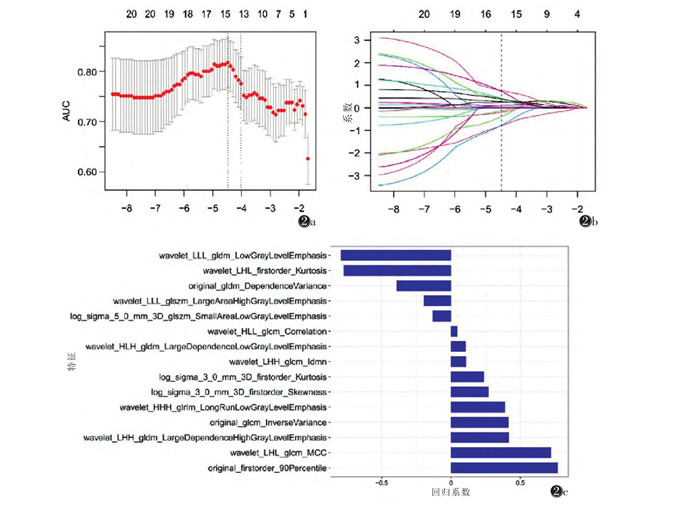
2.2 计算影像组学评分在LASSO算法特征筛选中,采用10折交叉验证,以AUC为标准确定的最优对数λ=0.011(logλ=-4.51),有15个特征的系数不为0(图 2),最终得到的影像组学评分公式:Radscore=0.77×original_firstorder_90Percentile-0.132×log_sigma_5_0_mm_3D_glszm_Small AreaLowGrayLevelEmphasis+0.416×wavelet_LHH_gldm_Large DependenceHighGrayLevelEmphasis+0.107×wavelet_HLH_gldm_LargeDependenceLowGrayLevelEmphasis+0.27×log_sigma_3_0_mm_3D_firstorder_Skewness-0.793×wavelet_LLL_gldm_LowGrayLevelEmphasis+0.414×original_glcm_InverseVariance+0.046×wavelet_HLL_glcm_Correlation+0.723×wavelet_LHL_glcm_MCC+0.389×wavelet_HHH_glrlm_LongRunLowGrayLevel Emphasis-0.196×wavelet_LLL_glszm_LargeAreaHigh GrayLevelEmphasis-0.392×original_gldm_Dependence Variance-0.773×wavelet_LHL_firstorder_Kurtosis+0.239×log_sigma_3_0_mm_3D_firstorder_Kurtosis+0.108×wavelet_LHH_glcm_Idmn-1.191。影像组学评分在训练集和测试集中,胸膜浸润组和非胸膜浸润组差异均有统计学意义(训练集P < 0.001,测试集P=0.006)(图 3)。
 |
| 注:图 2a交叉验证曲线,选择最优logλ(0.011),保留特征系数不为0的特征,其中左边的虚线表示最优的λ,右侧曲线表示λ的1倍标准差。图 2b影像组学特征的LASSO系数分布,其中,虚线为最优λ。图 2c直方图显示了最后保留的特征及模型中的回归系数 图 2 最小绝对收缩和选择算子(LASSO)算法特征筛选 |
 |
| 图 3 影像组学评分在训练集(a)和测试集(b)的分布箱图 |
2.3 临床模型和联合模型构建
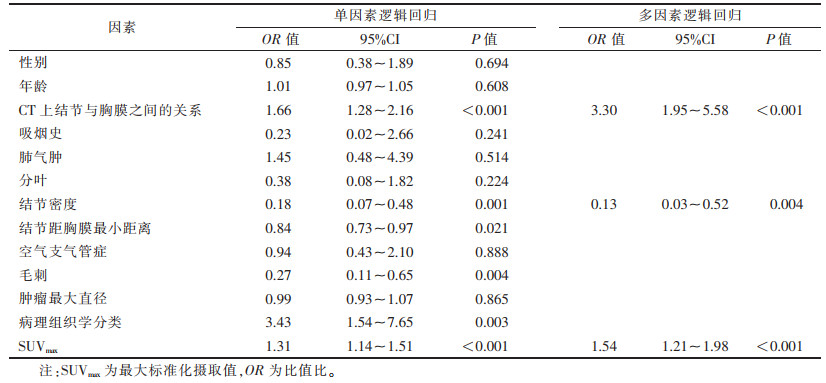
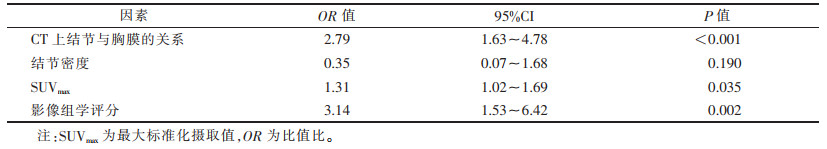
最终临床模型包含3个临床特征:CT上观测结节与胸膜的关系(P < 0.001),结节密度(P=0.004)及SUVmax(P < 0.001)(表 2)。临床模型中的独立预测因子与影像组学评分结合,采用多因素逻辑回归分析,构建联合模型(表 3)。同时,对联合模型进行可视化,生成列线图(图 4)。
| 表 2 临床因素的单因素和多因素逻辑回归分析结果 |
 |
| 表 3 临床因素联合影像组学评分构建联合模型的多因素逻辑回归分析结果 |
 |
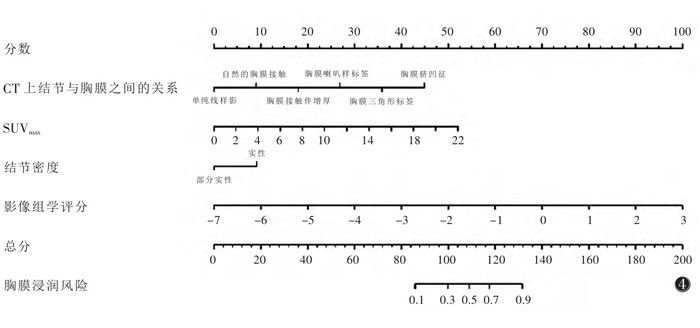 |
| 图 4 联合模型预测胸膜浸润的列线图 |
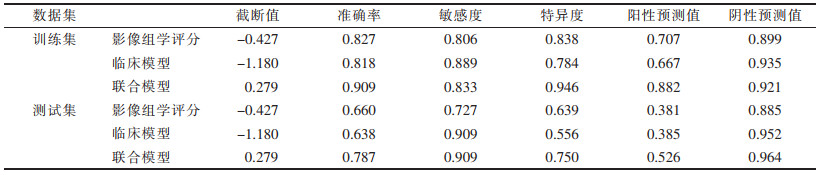
| 表 4 训练集和测试集中3个模型的预测性能 |
 |
2.4 模型验证
ROC曲线分析显示,联合模型相对于临床模型及单独的影像组学评分,具有更高的VPI诊断效能(图 5)。在训练集中,联合模型的AUC为0.944, 95%CI为0.901~0.988;在测试集中,联合模型的AUC为0.869, 95%CI为0.743~0.994。联合模型的截断值为0.279,训练集和测试集预测VPI的准确率、敏感度、特异度、阳性预测值、阴性预测值均明显高于临床模型和单独的影像组学评分。校准曲线分析结果表明,无论在训练集还是测试集,联合模型相较于其他2个模型,校准曲线更接近理想的灰色对角线(图 6)。在Hosmer-lemeshow检验中,3个模型均有较出色的拟合优度(均P > 0.05)。决策曲线分析说明,训练集及测试集中,采用联合模型相较于其他模型获益更高(图 7)。
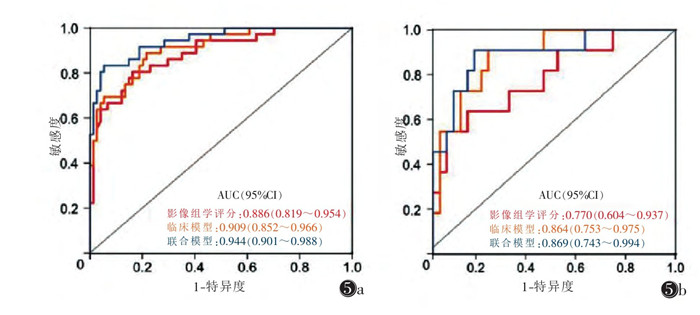 |
| 注:图 5a为训练集,图 5b为验证集 图 5 影像组学评分、临床模型、联合模型列线图的ROC曲线对比图 |
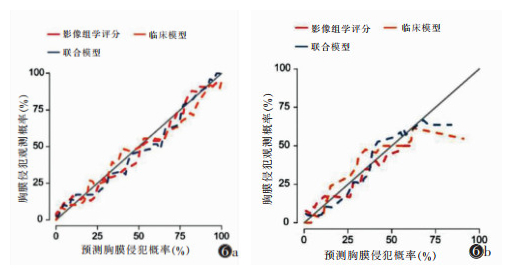 |
| 注:图 6a为训练集,图 6b为验证集 图 6 影像组学评分、临床模型和联合模型的校准曲线图 |
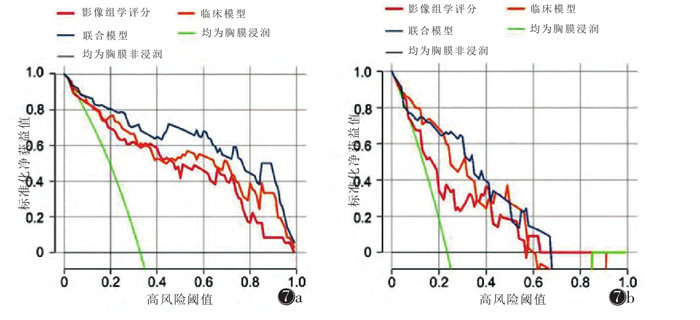 |
| 注:图 7a为训练集,图 7b为验证集 图 7 影像组学评分、临床模型和联合模型的决策曲线图 |
3 讨论
本研究开发并验证了基于HRCT图像的影像组学、临床特征与SUVmax的列线图,用于识别cT1N0M0期肺腺癌VPI。结果表明,该联合模型较临床模型与影像组学评分,具有更高的VPI诊断效能和校准能力;此外,决策曲线分析证明采用该联合模型预测VPI获益更高。
VPI是肺癌预后不良的主要因素[17],主要是因为脏层胸膜富含淋巴管,并在肺表面形成一个互通网络,该网络穿透肺实质,连接到支气管淋巴管并最终流入肺门淋巴结,这可能会导致肺癌转移[18]。因此,在第八版的分期系统[2]中,将VPI作为非小细胞肺癌T2期的标准之一。
多项研究表明,CT形态学特征与VPI具有相关性[4, 6-7, 19-20],且分叶征、空气支气管征、毛刺征不是诊断VPI的重要指标,与本研究结论一致。然而,Kim等[5]在对上述CT特征预测VPI的研究中发现,其准确率为62.7%~72.3%,阳性预测值仅44.0%~56.0%。有文献报道SUVmax可准确地预测肺癌VPI, Chen等[9]报道SUVmax是亚实性结节Ⅰ期肺腺癌VPI的独立预测因子。Tanaka等[8]报道,无论是单独使用SUVmax,还是使用包括SUVmax在内的多变量模型,均可准确预测肺腺癌VPI,且SUVmax越大,VPI发生的可能性越大。上述研究均侧重于肺结节的形态学和代谢情况。最近,有文献报道影像组学可通过量化CT纹理特征来评估肺癌VPI[11-13, 21]。Zuo等[11]开发了基于CT特征的列线图预测c T1N0M0期肺腺癌患者VPI,发现结节最大直径、偏度、球形度及慢性阻塞性肺疾病,可作为VPI的独立预测因子。但该模型仅基于影像组学模型区分VPI,而未纳入相关的临床特征参数。Choi等[21]提出术前基于CT的深度学习模型对早期肺癌VPI的预测准确率较高,但其AUC值仅0.75。Zha等[13]报道其开发和验证的基于影像组学特征的列线图模型可有效地预测肺腺癌患者的VPI。Wei等[12]研究表明,基于CT形态特征和纹理特征的联合模型术前预测早期非小细胞肺癌VPI的准确率更高。
本研究选择15个覆盖了一阶到高阶的最佳定量影像组学特征,可更好地反映病变的空间异质性。其中,峰度(Kurtosis)、低灰度强调(low gray level emphasis, LGLE)、最大相关系数(maximal correlation coefficient, MCC)和第九十百分位(90th percentile)占比最大。
本研究将影像组学评分、临床特征和SUVmax构建联合模型,预测cT1N0M0期肺腺癌VPI,其中,将SUVmax纳入临床特征模型内。影像组学评分聚焦于肿瘤内部的异质性,与临床特征模型可相互补充。有文献报道SUVmax预测VPI的能力较HRCT更强[8]。本研究临床模型的诊断性能高于影像组学评分,推测可能与将SUVmax纳入其中有关。但2种模型的组合可获得更高的诊断效能,训练集AUC为0.944,验证集为0.869。本研究的不足:仅包括cT1N0M0期肺腺癌,未能纳入其他病理类型的肺癌,可能会限制该模型的临床应用。
综上所述,基于HRCT图像的影像组学、临床特征与SUVmax的列线图可术前区分cT1N0M0期肺腺癌患者有无VPI,且具有强大的校准和辨别力,有望成为临床术前评估VPI的可靠工具,以指导肺癌的诊疗过程。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
DETTERBECK F C, BOFFA D J, KIM A W, et al. The eighth edition lung cancer stage classifification[J]. Chest, 2017, 151(1): 193-203. DOI:10.1016/j.chest.2016.10.010 |
| [3] |
KOIKE T, KOIKE T, YOSHIYA K, et al. Risk factor analysis of locoregional recurrence after sublobar resection in patients with clinical stage IA non-small cell lung cancer[J]. J Thorac Cardiovasc Surg, 2013, 146(2): 372-378. DOI:10.1016/j.jtcvs.2013.02.057 |
| [4] |
ONODA H, HIGASHI M, MURAKAMI T, et al. Correlation between pleural tags on CT and visceral pleural invasion of peripheral lung cancer that does not appear touching the pleural surface[J]. Eur Radiol, 2021, 31(12): 9022-9029. DOI:10.1007/s00330-021-07869-y |
| [5] |
KIM H, GOO J M, KIM Y T, et al. CT-defined visceral pleural invasion in T1 lung adenocarcinoma: lack of relationship to disease-free survival[J]. Radiology, 2019, 292(3): 741-749. DOI:10.1148/radiol.2019190297 |
| [6] |
EBARA K, TAKASHIMA S, JIANG B, et al. Pleural invasion by peripheral lung cancer: prediction with threedimensional CT[J]. Acad Radiol, 2015, 22(3): 310-319. DOI:10.1016/j.acra.2014.10.002 |
| [7] |
HSU J S, HAN I T, TSAI T H, et al. Pleural tags on CT scans to predict visceral pleural invasion of non-small cell lung cancer that does not abut the pleura[J]. Radiology, 2016, 279(2): 590-596. DOI:10.1148/radiol.2015151120 |
| [8] |
TANAKA T, SHINYA T, SATO S, et al. Predicting pleural invasion using HRCT and 18F-FDG PET/CT in lung adenocarcinoma with pleural contact[J]. Ann Nucl Med, 2015, 29(9): 757-765. DOI:10.1007/s12149-015-0999-x |
| [9] |
CHEN Z, JIANG S, LI Z, et al. Clinical value of 18F-FDG PET/CT in prediction of visceral pleural invasion of subsolid nodule stage I lung adenocarcinoma[J]. Acad Radiol, 2020, 27(12): 1691-1699. DOI:10.1016/j.acra.2020.01.019 |
| [10] |
蒋苏香, 元建鹏, 林显虹, 等. 18F-FDG PET/CT预测肺外周亚实性结节Ⅰ期肺腺癌脏层胸膜浸润的临床研究[J]. 影像诊断与介入放射学, 2020, 29(2): 112-118. |
| [11] |
ZUO Z, LI Y, PENG K, et al. CT texture analysis-based nomogram for the preoperative prediction of visceral pleural invasion in cT1N0M0 lung adenocarcinoma: an external validation cohort study[J]. Clin Radiol, 2022, 77(3): 215-221. DOI:10.1016/j.crad.2021.11.008 |
| [12] |
WEI S H, ZHANG J M, SHI B, et al. The value of CT radiomics features to predict visceral pleural invasion in≤3 cm peripheral type early non-small cell lung cancer[J]. J Xray Sci Technol, 2022, 30(6): 1115-1126. |
| [13] |
ZHA X, LIU Y, PING X, et al. A nomogram combined radiomics and clinical features as imaging biomarkers for prediction of visceral pleural invasion in lung adenocarcinoma[J]. Front Oncol, 2022, 12: 876264. DOI:10.3389/fonc.2022.876264 |
| [14] |
CASALI C, CUCCA M, ROSSI G, et al. The variation of prognostic significance of Maximum Standardized Uptake Value of [18F]-fluoro-2-deoxy-glucose positron emission tomography in different histological subtypes and pathological stages of surgically resected Non-Small Cell Lung Carcinoma[J]. Lung Cancer, 2010, 69(2): 187-193. DOI:10.1016/j.lungcan.2009.10.015 |
| [15] |
TRAVIS W D, BRAMBILLA E, RAMI-PORTA R, et al. Visceral pleural invasion: pathologic criteria and use of elastic stains: proposal for the 7th edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2008, 3(12): 1384-1390. DOI:10.1097/JTO.0b013e31818e0d9f |
| [16] |
VAN GRIETHUYSEN J J M, FEDOROV A, PARMAR C, et al. Computational radiomics system to decode the radiographic phenotype[J]. Cancer Res, 2017, 77(21): 104-107. DOI:10.1158/0008-5472.CAN-17-0339 |
| [17] |
SEOK Y, LEE E. Visceral pleural invasion is a significant prognostic factor in patients with partly solid lung adenocarcinoma sized 30 mm or smaller[J]. Thorac Cardiovasc Surg, 2018, 66(2): 150-155. DOI:10.1055/s-0036-1586757 |
| [18] |
KANG J H, KIM K D, CHUNG K Y. Prognostic value of visceral pleura invasion in non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2003, 23(6): 865-869. DOI:10.1016/S1010-7940(03)00119-2 |
| [19] |
AHN S Y, PARK C M, JEON Y K, et al. Predictive CT features of visceral pleural invasion by T1-sized peripheral pulmonary adenocarcinomas manifesting as subsolid nodules[J]. AJR Am J Roentgenol, 2017, 209(3): 561-566. DOI:10.2214/AJR.16.17280 |
| [20] |
HEIDINGER B H, SCHWARZ-NEMEC U, ANDERSON K R, et al. Visceral pleural invasion in pulmonary adenocarcinoma: differences in CT patterns between solid and subsolid cancers[J]. Radiol Cardiothorac Imaging, 2019, 1(3): 190071. DOI:10.1148/ryct.2019190071 |
| [21] |
CHOI H, KIM H, HONG W, et al. Prediction of visceral pleural invasion in lung cancer on CT: deep learning model achieves a radiologist-level performance with adaptive sensitivity and specificity to clinical needs[J]. Eur Radiol, 2021, 31(5): 2866-2876. DOI:10.1007/s00330-020-07431-2 |
 2023, Vol. 21
2023, Vol. 21


