| MRI在卵巢肿瘤诊断及鉴别诊断中的应用 |
卵巢恶性肿瘤在妇科恶性肿瘤中发病率较高,死亡率居首位,5年生存率仅30%[1],因此早期明确诊断对后期治疗和预后至关重要。超声是卵巢肿瘤首选的检查方法,但其受多种因素影响,检查具有局限性。MRI以高软组织分辨力和多方位、多序列的成像特点,可从立体形态上对肿瘤进行定位,准确显示肿瘤的部位、大小、形态、边缘、范围及与邻近组织的关系[2],并能对肿瘤内部出血、脂肪及黏液成分进行准确判断,对卵巢良恶性肿瘤的鉴别诊断有重要价值。本文通过对64例卵巢肿瘤患者的临床资料进行回顾性分析,探讨MRI对卵巢肿瘤的诊断及鉴别诊断价值,现报道如下。
1 资料与方法 1.1 一般资料选取我院2015年1月至2017年4月经手术病理证实的64例卵巢肿瘤患者,年龄22~76岁,平均(52.6±2.6)岁。临床表现为下腹疼痛、不规则阴道流血、月经失调、下腹部包块等。
1.2 仪器与方法64例术前均行MRI扫描。采用Siemens AVANTO 1.5超导MRI扫描仪及腹部相控阵线圈(TORSO),检查前适度充盈膀胱。扫描范围脐至耻骨联合。常规行轴位T1WI SE、T2WI FSE、T2WI脂肪抑制,矢状位、冠状位T2WI FSE,扫描参数:T1WI TR/TE 460 ms/10 ms,FOV 42 cm×42 cm;T2WI TR/TE 3 200 ms/105 ms,FOV 36 cm×36 cm,层厚5 mm,层距1 mm。增强扫描使用高压注射器经肘静脉注射对比剂Gd-DTPA 20 mL,流率2.0 mL/s。
2 结果 2.1 手术及病理结果64例术中共发现病灶80个,术前MRI检出73个,诊断敏感度91.2%(73/80)。病理证实良性48个,均为单侧发病,其中黏液性囊腺瘤12个,浆液性囊腺瘤14个(图 1),成熟畸胎瘤16个,巧克力囊肿2个,卵泡膜细胞瘤4个。MRI诊断良性44个,诊断准确率91.7%(44/48)。病理证实恶性肿瘤32个,均为双侧发病,其中浆液性囊腺癌8个,黏液性囊腺癌6个(图 2),子宫内膜样癌2个,未成熟畸胎瘤10个,卵巢转移癌4个,内胚窦瘤2个。MRI诊断恶性病灶29个,诊断准确率90.6%(29/32)。
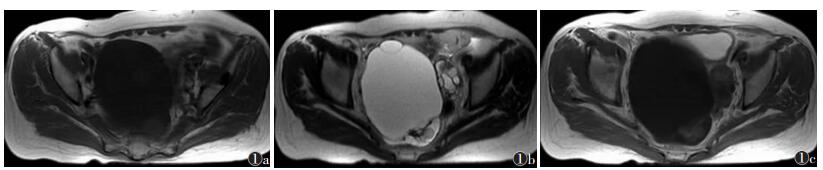 |
| 图 1 女,34岁,浆液性囊腺瘤 图 1a 平扫T1WI示盆腔内囊性占位性病变,囊内呈低信号、较均匀,可见分隔 图 1b 平扫T2WI呈高信号,边界光滑,与周围组织分界清楚 图 1c 增强扫描无明显强化 |
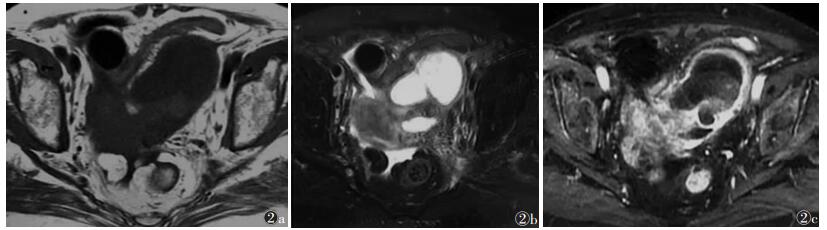 |
| 图 2 女,58岁,黏液性囊腺癌 图 2a 平扫T1WI示盆腔内囊实性占位性病变,囊内呈等低信号 图 2b 平扫T2WI压脂呈等高信号,囊壁厚薄不均,与周围组织分界模糊 图 2c 增强扫描实性成分明显不均匀强化 |
2.2 MRI表现
① 肿瘤成分及信号特征:囊性肿瘤24个,囊实性肿瘤42个,实性肿瘤14个。囊壁菲薄或厚薄不均,部分伴壁结节,囊内液体信号多样,表现为T1WI低信号、T2WI高信号的水样信号(图 1),或T1WI、T2WI均为高信号的脂液及蛋白含量高的黏稠液体。合并出血时T1WI、T2WI随时间变化呈高低不同信号。骨骼、钙化各序列呈均匀低信号。实性成分T1WI呈等或稍低信号、T2WI呈等或稍高信号(图 2a,2b)。增强扫描后,囊壁、壁结节及分隔无强化或不均匀强化,实性成分明显强化(图 2c)。②肿瘤周围改变及远处转移:22例伴盆腔淋巴结肿大,16例伴腹盆腔积液,相邻脏器受侵9例,3例伴远处转移。
3 讨论 3.1 概述卵巢肿瘤的病理分型复杂多样,其定性诊断有一定困难,以往临床诊断多依靠超声检查,但其组织分辨力较低,在卵巢良恶性肿瘤的鉴别诊断上有局限性。MRI具有较高的组织分辨力,可根据病变成分的信号特点初步判断肿块的性质,对卵巢肿瘤的定性具有优势[3]。卵巢良恶性肿瘤具有明显不同的生物学特征,是MRI诊断及鉴别诊断的基础[4]。本组64例80个病灶中,结合多序列成像及信号特点,与术后病理结果对照,MRI的诊断敏感度91.2%,对良性肿瘤的诊断准确率91.7%,对恶性肿瘤诊断准确率为90.6%,说明MRI对卵巢肿瘤的诊断及鉴别诊断具有较高的敏感性和准确性。这与国外文献[5-6]报道的MRI对卵巢良恶性肿瘤诊断的准确度为83%~93%相符。
3.2 卵巢良性肿瘤的MRI特点卵巢良性肿瘤多为膨胀性生长,生长缓慢,呈圆形或椭圆形,具有完整包膜。多单侧发病,以囊性多见,囊壁或囊内分隔厚薄均匀,囊液信号多样[7]。当肿瘤呈囊性或囊实性且伴脂液平面时,内部有T1WI、T2WI均呈高信号的脂肪组织是畸胎瘤的诊断依据;巧克力囊肿多伴出血,根据出血时间不同呈不同的T1WI、T2WI信号,脂肪抑制序列能鉴别肿块内部是出血还是脂肪,进而达到诊断目的;浆液性囊腺瘤常为壁薄均质的单囊或双囊,囊液以T1WI、T2WI高信号多见;黏液性囊腺瘤常为多囊,囊内分隔多较厚、可伴乳头状凸起,囊液因内容物不同而呈不同信号。增强扫描囊壁及壁结节无或轻度强化,囊液无强化。
3.3 卵巢恶性肿瘤的MRI特点卵巢恶性肿瘤多为浸润性生长,生长迅速,形态不规则,多双侧发病,以囊实性、实性多见。腹腔积液、腹膜增厚、邻近组织及淋巴结转移是诊断卵巢恶性肿瘤的可靠依据。原发性卵巢癌起源于上皮细胞、胚芽细胞或基质,其中80%~90%是上皮性的[8-9];囊腺癌以囊实性或实性为主,与子宫分界不清,囊壁见多发结节或乳头状突起,实性成分多呈中等信号,囊性部分T1WI呈低信号、T2WI高信号。增强扫描肿瘤实性成分明显不均匀强化[10],呈“棉絮样改变”,坏死部位无强化;卵巢子宫内膜样癌呈囊实性肿块,增强扫描明显强化,伴内膜异位征象;卵巢转移瘤多侵犯双侧卵巢,表现为大小不等的囊实性分叶状肿瘤,信号与原发卵巢癌相似,常见原发部位为结肠、胃、乳腺、胰腺等[11];内胚窦瘤是一种罕见的恶性程度极高的卵巢生殖细胞肿瘤,因其来源于原始卵黄囊,又名卵黄囊瘤,以儿童及年轻女性多发。肿瘤多巨大,MRI平扫呈不均匀混杂信号,增强扫描呈不均匀明显强化。
3.4 漏、误诊原因本组80个病灶,MRI漏诊7个,病灶直径均 < 1.0 cm且合并巨大子宫肌瘤。3例卵巢囊腺瘤诊断为囊腺癌,肿瘤均较大,增强扫描时囊壁及囊内结节均呈明显强化,未仔细询问病史故误诊,卵巢癌的强化更明显,多伴周围组织侵犯及转移。1例卵泡膜细胞瘤误诊为子宫肌瘤,该例因对肿瘤发生部位定位错误,且未能结合病史而误诊;卵泡膜细胞瘤因肿瘤本身可分泌激素,使子宫内膜增生,甚至发生子宫内膜癌,部分肿瘤黄素化时可出现男性化表现[12]。1例卵巢囊腺癌诊断为囊腺瘤,亦是对肿瘤实性部分的强化程度及周围组织情况未能很好区分。2例未成熟畸胎瘤因瘤体内部出血坏死部位较少,且呈轻度强化,故诊断为成熟畸胎瘤。
综上所述,MRI具有多方位扫查、软组织分辨力高、影像视野大等优点,不仅能初步判断卵巢肿瘤的形态学信息,还可通过增强扫描分析病变的血流动力学特征,间接反映肿瘤生物学信息,在卵巢肿瘤的检出中具有较高的敏感性,对良恶性鉴别也具有较高的准确率。
| [1] |
单军, 徐坚民, 龚静山. 早期增强MRI对良恶性卵巢肿瘤的鉴别诊断价值[J]. 中华放射学杂志, 2003, 37(11): 1001-1006. DOI:10.3760/j.issn:1005-1201.2003.11.009 |
| [2] |
刘彪. MRI在卵巢良、恶性肿瘤定性诊断中的临床应用[J]. 中国癌症防治杂志, 2012, 4(3): 298-300. |
| [3] |
袁晓春, 王夕富, 姚戈虹, 等. 3.0 T MRI对卵巢良恶性肿瘤定性的诊断价值[J]. 实用放射学杂志, 2011, 27(11): 1695-1698. DOI:10.3969/j.issn.1002-1671.2011.11.022 |
| [4] |
Bouic-Pages E, Perrochia H, Merigeaud S, et al. MR imaging of primary ovarian tumors with pathological correlation[J]. J Radiol, 2009, 90: 787-802. DOI:10.1016/S0221-0363(09)73210-X |
| [5] |
Sohaib SA, Sahdev A, Van Trappen P, et al. Characterization of adnexal mass lesions on MR imaging[J]. AJR Am J Roentgenol, 2003, 180: 1297-1304. DOI:10.2214/ajr.180.5.1801297 |
| [6] |
范正平, 饶德利. MRI对女性盆腔囊性病变的诊断与鉴别诊断价值[J]. 中华现代影像学杂志, 2009, 6(3): 150-152. |
| [7] |
Izumi I, Akihiko W, Yasushi K, et al. Developing an MR imaging strategy for diagnosis of ovarian masses[J]. Radiographics, 2006, 26: 1431-1448. DOI:10.1148/rg.265045206 |
| [8] |
李敏, 胡振民. 卵巢肿瘤的MRI诊断(附38例MRI、超声和病理对照)[J]. 中国临床医学影像杂志, 2003, 14(3): 184-187. |
| [9] |
霍华. 超声联合MRI诊断卵巢癌的价值分析[J]. 中国中西医结合影像学杂志, 2017, 15(4): 437-439. |
| [10] |
Takeuchi M, Matsuzaki K, Uehara H. Primary carcinoid tumor of the ovary:MR imaging characteristics with pathological correlat-ion[J]. Magn Reson Med Sci, 2011, 10: 205-209. DOI:10.2463/mrms.10.205 |
| [11] |
成启华, 李燕, 杨永贵, 等. 卵巢恶性肿瘤的MRI诊断与误诊原因分析[J]. 放射学实践, 2012, 27(1): 81-84. |
| [12] |
金艳, 赵庆, 王红梅. 卵巢卵泡膜细胞瘤的CT与MRI诊断[J]. 中国医药导报, 2010, 7(8): 70, 111. |
 2018, Vol. 16
2018, Vol. 16


