| VHL综合征的影像学表现 |
2. 山东省德州市宁津县中医院放射科,山东 德州 253400;
3. 山东中医药大学第一临床医学院,山东 济南 250014
Von Hippel-Lindau(VHL)综合征,又称希佩尔·林道综合征,是一种罕见的累及中枢神经系统(central nervous system,CNS)和腹部多器官的良恶性肿瘤症候群,呈家族性常染色体显性遗传,受累器官可同时或先后出现特征性病变,间隔时间最长可达数十年。充分认识VHL综合征各器官病变的影像学表现,有助于尽早发现可能患者,并及时治疗,以提高其治愈率,延长生存期。
1 资料与方法 1.1 一般资料回顾性分析2014年4月至2017年6月于山东中医药大学附属医院确诊的VHL综合征患者7例,其中男1例,女6例;年龄17~65岁,平均42.4岁。所有患者均行CNS及腹部影像学检查,其中3例进行随诊复查。7例中1例有明确血管母细胞瘤家族史,另1例父亲及弟弟因脑积水去世,具体病因未明;其余5例均否认家族遗传病史。5例为VHL-1型,2例为VHL-3型。
1.2 临床诊断标准根据Maher等[1]提出的标准进行VHL的诊断:①有明确视网膜或CNS血管母细胞瘤家族史患者,只要出现1个CNS或视网膜血管母细胞瘤,或1个脏器病变(肾脏、胰腺的囊肿或肿瘤,嗜铬细胞瘤,附睾或子宫阔韧带乳头状囊腺瘤等)即可诊断;②无家族史的散发患者,出现2个或以上CNS血管母细胞瘤,或1个血管母细胞瘤和1个(或以上)实质脏器病变即可诊断。少数VHL综合征患者具有腹腔脏器的全部常见病变,包括肾癌、肾囊肿、胰腺囊肿、胰岛细胞瘤、嗜铬细胞瘤。罕见有VHL全部表现的患者,约50%仅一项表现。临床表现不典型者,需行VHL基因检测。
1.3 临床分型美国国家癌症研究所将VHL综合征分为3种类型[2]:1型,包括视网膜和CNS血管母细胞瘤,肾囊肿、肾癌和胰腺囊肿,但无嗜铬细胞瘤;2型,包括视网膜和CNS血管母细胞瘤,另外存在嗜铬细胞瘤和胰腺的胰岛细胞瘤,无胰腺囊肿和肾脏肿瘤;3型不常见,包括视网膜和CNS血管母细胞瘤、嗜铬细胞瘤、胰腺和肾脏肿瘤(或囊肿)。
1.4 仪器与方法MRI检查采用Philips Achieva 3.0 T MRI扫描仪,患者取仰卧位头先进,扫描过程中保持静止。颅脑扫描序列包括:轴位T1WI、T2WI、FLAIR及DWI,脊髓扫描序列包括矢状位T1WI、T2WI,轴位T2WI,增强扫描均行T1WI三方位扫描。腹部MRI扫描序列包括冠状位T2WI、轴位T1WI、T2WI、FS-T2WI、Dual-Phase T1WI和DWI序列,增强扫描采用e-Thieve动态增强扫描,对比剂为Gd-DTPA;2例多发胰腺囊肿行MRCP序列扫描。腹部CT扫描采用Toshiba Aquilion ONE 320层CT扫描仪,扫描参数:120 kV,64 mAs,层厚7 mm,层距7 mm,增强扫描采用腹部常规动态增强扫描序列,对比剂均为优维显(碘浓度300 mg/mL),剂量75 mL,流率3.2 mL/s,后以同流率推注生理盐水45 mL。
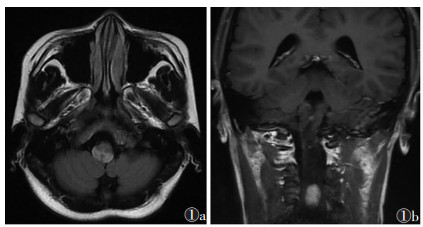
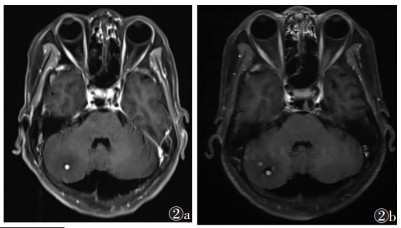
2 结果7例均出现CNS血管母细胞瘤(图 1,2),其中伴双肾多发囊肿6例(图 3),双肾多发肾癌4例,胰腺多发囊肿6例,嗜铬细胞瘤3例(图 4),胰腺占位性病变3例,1例胰腺占位性病变确诊为实性假乳头状瘤。CNS血管母细胞瘤在小脑内主要表现为大囊小结节型或明显强化的实性结节,在脊髓内表现为大小不等明显强化的实性结节,可伴发脊髓空洞;肾或胰腺囊肿表现为肾脏或胰腺实质内边界清晰无强化的液性密度或信号;肾癌表现为肾实质内异常密度或信号灶,增强扫描明显不均匀强化。
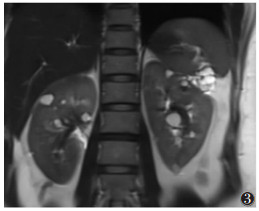 |
| 图 3 女,34岁,T2WI示双肾多发囊肿,呈局限性长T2液性信号 |
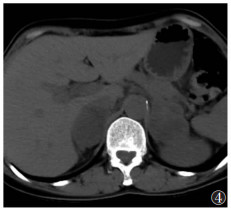 |
| 图 4 女,49岁,双肾上腺区占位性病变,CT平扫呈等低密度,考虑嗜铬细胞瘤 |
3 讨论 3.1 VHL综合征概况及基因致病学说
1964年,Melmon和Rosen首次将CNS血管母细胞瘤合并肾脏或胰腺囊肿、嗜铬细胞瘤、肾癌及外皮囊腺瘤等疾病命名为VHL综合征[1]。本病为常染色体显性遗传,其致病基因被称为VHL基因,位于第三号染色体短臂3p25~26上,是一种肿瘤抑制基因,其缺失或突变会导致正常的VHL蛋白不能合成而发生肿瘤。不同的突变形式和部位会导致不同的疾病表型及复杂多样的临床表现[2]。遗传外显率为不完全或有变异,4%~15%为偶发,无明确的家族遗传史[3]。
VHL综合征发病率约1/3.6万,平均发病年龄26.2~30.8岁,自然死亡年龄在50岁以前,CNS血管母细胞瘤破裂出血、肾癌和嗜铬细胞瘤引起的恶性高血压是主要死亡原因[2]。
3.2 受累器官主要病变及影像学表现VHL综合征具有多中心性、多肿瘤性特点,其中以CNS血管母细胞瘤、肾囊肿及肾癌、嗜铬细胞瘤、胰腺囊肿及囊腺瘤等最常见[4]。其诊断主要依靠临床表现、影像学表现及家族遗传病史,其中影像学检查是发现、诊断和随访的主要手段。腹腔内脏病变的首选方法是CT动态增强扫描,CNS病变的首选检查是高场强MRI增强扫描。
3.2.1 CNS血管母细胞瘤好发部位是小脑、延髓、脊髓,可多中心发病,以小脑血管母细胞瘤伴发脊髓血管母细胞瘤联合最常见。小脑血管母细胞瘤可以是VHL的首发表现,平均发病年龄30岁,与散发病灶相比,VHL相关性小脑血管母细胞瘤具有发病时间更早、病情更复杂、预后更差等特点[5];脊髓血管母细胞瘤是VHL综合征较特异的病变[6],以圆锥及颅颈结合部好发,可伴脊髓空洞症,也可多发或合并颅内血管母细胞瘤。
CNS血管母细胞瘤按病理学表现可分为3型:大囊小结节型、单纯囊型和实质型。最常见的是大囊小结节型,影像学表现为囊性病灶伴壁结节,壁结节在CT上常为等高密度,MRI呈等及稍长T1稍长T2信号,囊性部分为低密度及长T1、T2信号,增强扫描壁结节因血供丰富而明显强化,囊液不强化。实质型小脑血管母细胞瘤复发率比囊性病灶高,CT平扫呈等密度,MRI呈等长T1、T2信号,增强扫描明显强化[7]。对CNS多发血管母细胞瘤且为实性结节者,应高度怀疑VHL综合征可能。利用MRI增强扫描多方位成像显示小的壁结节、瘤周或瘤内血管流空、继发性脊髓空洞对CNS血管母细胞瘤的诊断及鉴别诊断有很大帮助。
3.2.2 视网膜血管母细胞瘤该病平均患病年龄为25岁,病灶常位于视网膜周围,也可直接累及视神经盘。组织学上其病灶与CNS发生的病灶相同。当病灶较大时可在CT及MRI上显示,晚期可钙化或骨化。MRI FLAIR和T1WI序列上病灶信号高于玻璃体,增强扫描病变轻度强化,病变较大时可明显强化。CT对钙化的显示优于MRI。
3.2.3 肾脏病变肾脏病变出现时间一般晚于CNS及眼底病变,平均发病年龄39岁。肾囊肿为薄壁液性病灶,CT呈低密度,MRI呈长T1、T2信号,增强扫描不强化。VHL综合征相关肾癌最大特点是同时或先后出现双侧多灶性囊实性病变(可能起于囊肿壁)呈侵蚀性生长,伴双侧多发囊肿。影像学上常表现为实性或囊性肾癌,后者表现为有壁结节的厚壁复杂囊性病变,CT平扫示病灶密度混杂,可伴囊变及钙化,脂肪成分罕见;增强扫描实性部分呈快进快出强化,囊性部分无强化。研究[8]认为:VHL综合征的肾脏病变在诊断明确之前均应怀疑恶性并给予严密观察,不应以影像学表现为依据,因VHL显微镜下的肾细胞癌非常常见,如出现肾静脉癌栓、淋巴结转移有助定性诊断。
3.2.4 嗜铬细胞瘤嗜铬细胞瘤是VHL综合征的表现之一,平均发病年龄20.2岁,多位于肾上腺内,少数发生于腹主动脉旁、肾门、肠系膜根部等,50%~80%为双侧发病。组织学表现类似于散发的嗜铬细胞瘤,但具有早发、双侧多灶、恶性率低的特点。CT平扫呈低密度,特征性CT表现为肿瘤囊性变和实性部分明显强化,但也可不强化,病灶较大时中心出现坏死液化(低密度)或出血及钙化(不同程度高密度);特异性表现为T2WI呈高信号,T1WI呈低信号,增强扫描显著强化,可与肾上腺腺瘤和转移癌相鉴别。
VHL也可并发副神经节瘤,好发部位有颈静脉球、颈动脉体、主动脉周围及脾周等,病理上与嗜铬细胞瘤相似。
3.2.5 VHL相关性胰腺病变主要包括囊肿、浆液性囊腺瘤、胰岛细胞瘤等。囊肿最常见,呈良性、单发或多发、大小不等,散布于胰腺实质内甚至布满整个胰腺呈蜂窝状改变,好发于20~40岁。浆液性囊腺瘤呈良性,表现为数目较多、小而成簇的葡萄串样囊性病灶,子囊直径多 < 2 cm,甚至可小至不能互相分辨,囊腔间有星状纤维瘢痕,可钙化,增强扫描实性部分及纤维瘢痕中度至明显强化。影像学检查很难鉴别成簇的囊肿和小囊腺瘤。胰岛细胞瘤为富血供肿瘤,CT增强扫描病灶通常呈结节样明显强化,可伴钙化。大多数表现为无功能,生长缓慢。少数胰岛细胞瘤可分泌一些激素,通常伴发嗜铬细胞瘤。
3.2.6 附睾(或子宫阔韧带)乳头状囊腺瘤VHL相关性附睾(或子宫阔韧带)乳头状囊腺瘤可单侧或双侧发生,双侧发生则对VHL的诊断具有特征性。病灶直径1~5 cm,最常见于附睾头部,可同时累及精索。由于可直接触摸,无需影像学检查,体检可发现阴囊内坚硬而光滑的“鹅卵石样”表现。组织学上在女性对等的子宫阔韧带可发生。
综上所述,VHL综合征罕见且具有家族遗传性、多中心性和多肿瘤性的特点,早期诊断及密切随诊可改善患者预后。临床医师应提高对该病的认识,当发现CNS血管母细胞瘤或内脏多发病变时,应考虑本病可能,同时详细询问病史、完善全身多系统影像学甚至基因学检查以排除VHL综合征。另外,由于该病为常染色体遗传,对已确诊患者家族成员可进行长期随访查体,以求尽早发现可能患者。
| [1] |
Maher ER, Iselius L, Yates JRW, et al. Von Hippel-Lindau dise-ase:a genetic study[J]. J Med Genet, 1991, 28: 443-447. DOI:10.1136/jmg.28.7.443 |
| [2] |
Maher ER, Neumann HP, Richard S. Von Hippel-Lindau disease:a clinical and scientific review[J]. Eur J Hum Genet, 2011, 19: 617-623. DOI:10.1038/ejhg.2010.175 |
| [3] |
江敦勤, 方卫华, 施浩强. Von Hippel-Lindau(VHL)病诊断与治疗(附3例报告)[J]. 安徽医学, 2007, 28(4): 368-369. |
| [4] |
李威, 伊慧明, 张媛媛, 等. 遗传性神经肿瘤综合征的影像学表现[J]. 中国现代神经疾病杂志, 2007, 7(4): 323-330. |
| [5] |
周宇浩, 出良钊. Von Hippel-Lindau综合征致病基因的研究进展[J]. 医学综述, 2017, 23(8): 1505-1509. |
| [6] |
Neumann HP, Lips CJ, Hsia YE, et al. Von Hippel-Lindau synd-rome[J]. Brain pathology. |
| [7] |
金讯波, 王刚刚, 王正, 等. VHL综合征[J/CD]. 泌尿外科杂志(电子版), 2014, 6(1): 48-53, 55.
|
| [8] |
Torreggiani WC, Keogh C, Al-Ismail K, et al. Von Hippel-Lindau disease:a radiological essay[J]. Clin Radiol, 2002, 57: 670-680. DOI:10.1053/crad.2002.0971 |
 2018, Vol. 16
2018, Vol. 16