| 胰腺浆液性微囊型囊腺瘤的影像学及病理对照分析 |
胰腺浆液性微囊型囊腺瘤(serous microcystic cystadenomas, SMCA)是胰腺少见的外分泌良性肿瘤, 约占胰腺肿瘤的1%, 但其术前正确诊断率不高, 易误诊和漏诊[1-2]。回顾性分析我院2016年1月至2018年1月收治的11例SMCA的影像及病理表现, 结合文献, 探讨、总结其影像学特征, 以提高该病诊断准确性, 帮助临床确定治疗方案。
1 资料与方法 1.1 一般资料本组11例, 男1例, 女10例; 年龄33~67岁, 平均53岁。主要临床症状表现:9例(81.8%)腹痛, 1例(9.1%)饱胀感, 1例(9.1%)无症状。术前3例(27.3%)诊断为胰腺囊腺瘤。
1.2 仪器与方法11例均行CT平扫及增强扫描, 2例加行MRI平扫及增强扫描。CT检查采用Siemens 64排双源螺旋CT扫描仪, 对比剂为优维显(非离子型对比剂, 100 mL), 通过高压注射器经肘静脉注入, 流率3 mL/s, 分别在25~30、45、120 s行动脉期、门脉期、延迟期扫描。MRI检查采用Achieva 3.0 T超导MRI扫描仪及体部相控阵表面线圈。扫描序列包括常规轴面和冠状面序列:①常规T2WI TSE序列, T1WI FFE列; ②脂肪抑制THRIVE序列; ③T1WI (FFE-SPIR)平扫和动态增强扫描, 对比剂为Gd-DTPA 12 mL, 通过高压注射器经肘静脉注入, 流率2.5 mL/s。层厚5 mm, 层距1 mm, 矩阵256×256。MRCP:采用呼吸触发, TR 2 521 ms, TE 760 ms, 矩阵300×225, 层数87层, 原始图像行MIP。
1.3 影像学分析由2名经验丰富的影像诊断医师共同分析CT及MRI图像, 评价并记录、分析影像学特征。
1.4 病理检查组织标本经甲醛液固定、常规脱水、石蜡包埋、4 μm切片、HE染色后光镜观察, 免疫组织化学染色采用SP或Envision两步法。
2 结果 2.1 基本情况11例共11个病灶, 均为单发; 位于胰头4个, 胰体尾7个。影像学显示肿瘤长径14~ 50 mm, 平均40 mm; 11例病灶与周围胰腺组织分界均清楚。临床病理诊断均为SMCA; 长径14~50 mm, 平均35 mm; 与手术病理对照, 术前影像诊断符合率为27.3%(3/11)。
2.2 影像学表现 2.2.1 CT检查SMCA均呈类圆形或分叶状, 边界清楚, 平扫呈水样密度, 其内为大小不等多发微小囊状结构, 囊腔直径数毫米至20 mm不等, 囊壁及纤维分隔呈等密度(图 1a)。增强扫描纤维分隔及囊壁中度强化, 门脉期持续强化, 囊壁边界清楚, 囊内容物未见强化。9例病灶见纤维分隔, 其中5例可见中央瘢痕(图 1b); 1例病灶边缘囊壁可见粗大钙化(图 2)。本组未见壁结节。
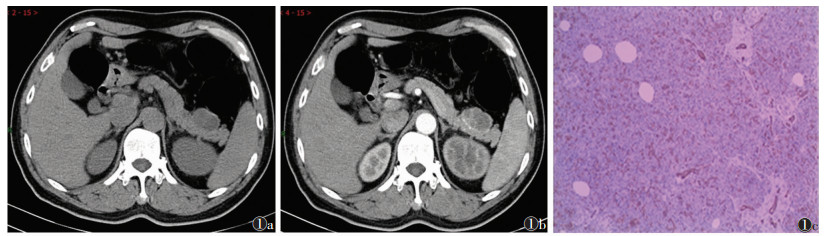 |
| 图 1 男, 59岁, 浆液性微囊型囊腺瘤(胰尾)图 1a CT轴位显示胰尾囊性肿块图 1b增强扫描动脉期, 病灶呈低密度(箭头), 内见中央瘢痕强化图 1c镜下病理见多个小囊及囊腔之间较厚的纤维分隔(HE×40) |
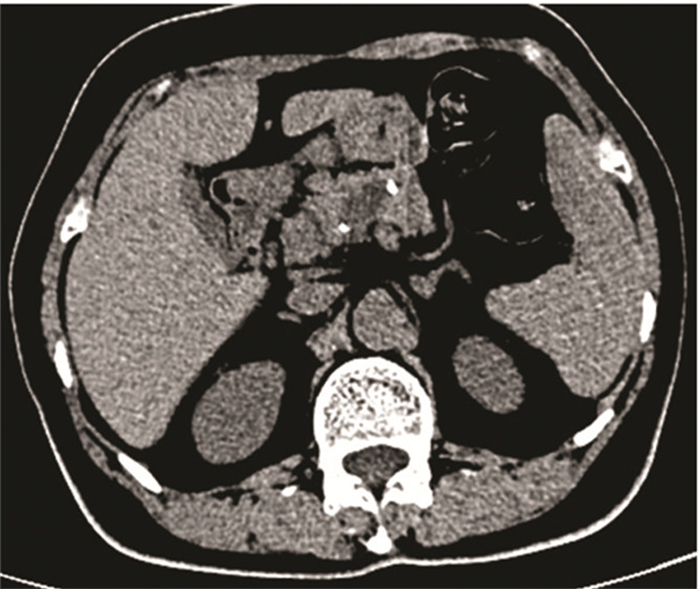 |
| 图 2 女, 67岁, 浆液性微囊型囊腺瘤(胰头), CT平扫示胰头肿块, 瘤体边缘见粗粒状钙化 |
2.2.2 MRI检查
病灶边界清楚, 内见大小不等的囊腔, 囊腔直径多 < 2 cm, 囊腔内呈均匀长T1长T2信号, 囊腔内见等或略低T1WI、T2WI信号的纤维分隔(图 3), 未见明显壁结节影, 纤维分隔中度强化。T2WI及MRCP显示瘤体内囊腔较CT更清楚。
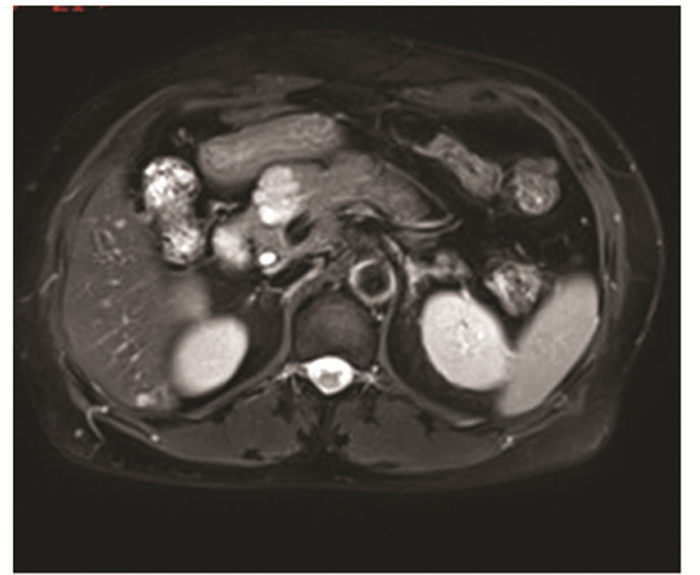 |
| 图 3 女, 54岁, 浆液性微囊型囊腺瘤(胰头), T2压脂序列示肿块呈分叶状, 多发小囊腔, 可见纤维分隔 |
2.3 病理结果
MSCN肉眼观察边界清楚, 切面灰白、湿润, 见清亮液体流出; 光镜下切面呈海绵状, 由许多大小不等的微小囊构成(图 1c), 直径0.5~ 5.0 mm, 囊内为水样液体, 瘤体内纤维组织丰富, 并常见纤维瘢痕, 纤维组织中可见玻璃样变及小血管增生。囊壁由扁平或立方上皮细胞组成, 细胞大小较一致, 胞质透明、红染, 细胞核无异型, 呈圆形、卵圆形。
3 讨论 3.1 临床与病理特点SMCA是胰腺少见的外分泌肿瘤[3], 约占胰腺肿瘤的1%, 在胰腺囊性肿瘤(pan鄄creatic cystic neoplasms, PCN)中较常见, 相较于其他恶变前或恶性PCN, SMCA常为良性, 恶性浆液性囊腺癌很少见[1, 4]。迄今为止, 仅约30例浆液性囊腺癌在文献[5]中报道, 发病率约占浆液性囊性肿瘤的1%~3%。
SMCA起源于导管细胞, 大多数学者[6]认为其为良性肿瘤。PCN术前模糊诊断常见、误诊率高, 术前精确到亚型的正确诊断率仅33.0%, 尤以SMCA最低(13.7%)[7]。一般认为术前诊断可能是决定手术方式的重要因素, 因此, 正确诊断可避免不必要的手术干预并排除其他恶性肿瘤[1]。
SMCA缺乏典型的临床症状, 当肿瘤生长较大、压迫邻近组织及器官时, 可出现上腹部不适和疼痛, 本组9例因腹痛、腹胀入院, 1例无临床症状于体检中发现。该病好发于中老年女性, 发病率是男性的3倍, 平均发病年龄53岁[1, 7], 本组也以女性患者为主, 且平均发病年龄与文献报道一致。
本组11例SMCA均为单发, 与周围组织分界清楚。均为多房, 显微镜下囊壁由扁平或立方上皮细胞组成, 囊壁间及分隔纤维组织丰富, 可见玻璃样变及小血管增生。本组病理切面呈海绵状, 由许多直径0.5~5.0 mm的微小囊构成, 囊内为清亮水样液体, 部分见纤维瘢痕。
3.2 SMCA的CT、MRI表现MRI与MSCT均能准确诊断胰腺囊性病变[8]。CT图像上SMCA边界清楚, 其内多发大小不等小囊呈蜂窝状, 囊腔直径多 < 20 mm[9], 部分囊腔分隔纤薄在影像上未能显示, 影像上测得的囊腔直径较病理增大。增强扫描纤维间质分隔结构中度强化, 强化程度低于胰腺组织, 囊液无强化, 在囊液衬托下分隔结构显示更加清晰, 但低于胰腺组织。10%~30%的SMCA中心可见星芒状瘢痕, 是其特征性表现[10]。本组5例可见中央纤维瘢痕。
SMCA的MRI典型表现为边界清楚肿块, 呈长T1长T2信号, 囊液、纤维分隔的信号及含量不同, 信号可不均匀。纤维瘢痕及分隔在T1WI、T2WI上为等或稍低信号, 中度强化。MRI较CT更能清楚显示纤维分隔和微囊结构, 以增强扫描更佳[11]。SMCA病变较大可压迫胰管, 引起胰管扩张。
典型SMCA由众多的小囊及纤维间质分隔构成, 囊壁内衬扁平或立方上皮细胞, 在影像上表现为多房囊性肿块; 因囊腔大小及肿块边缘生长速度不同, SMCA常呈分叶状。SMCA为良性肿瘤, 呈膨胀性生长, 对周围组织及器官产生推挤, 而不会侵犯, 其边界清楚。SMCA内含纤维分隔, 部分见中央瘢痕, 纤维分隔及中央瘢痕内镜下可见增生小血管和小囊腔, 丰富增生的小血管是其CT、MRI强化的基础, 增强扫描纤维组织中度强化, 门脉期及延迟期可见持续强化, 低于正常胰腺组织; 增生的小血管有完整的血管内皮细胞, 所以SMCA出血少见。中央瘢痕是较为密集的纤维组织, SMCA囊壁由扁平或立方上皮细胞组成, 部分增强扫描可表现为瘤体边缘薄壁强化, 囊内未见明显分隔, 这与病理显示瘤内纤维组织成分较少相吻合, 部分囊壁下纤维组织增生, 囊壁亦可见强化。
3.3 鉴别诊断SMCA与胰腺其他囊性病变的鉴别:①黏液性囊腺瘤, 多房性黏液性囊腺瘤的囊腔数量少, 囊腔较大, 囊壁较厚, 分隔粗细不均, 囊内可见壁结节[12]。②导管内乳头状黏液性腺瘤, 呈单房或多房性囊性, 主胰管或分支胰管不同程度扩张, 囊内常见条索状分隔、乳头样壁结节, 分隔及壁结节可见强化[13]。③实性假乳头状瘤, 好发于年轻女性, 通常表现为囊实性混合性肿块, 多有完整包膜, 囊内可见斑片状实性成分, 也可表现为囊实性, 囊壁可见壁结节、乳头状突起; 出血较常见, 增强扫描实性部分呈渐进性强化[14-16]。
综上所述, SMCA多表现为多囊分叶状低密度结节或肿物, 边界清楚, 具有多发囊腔, 囊腔之间可见分隔, 增强扫描纤维分隔可见强化, 低于胰腺组织, 常见纤维瘢痕, 分析其影像学特征, 可提高诊断准确率。
| [1] |
中华外科青年医师学术研究社胰腺外科研究组. 中国胰腺囊性肿瘤外科诊治现状分析:2251例报告[J]. 中华外科杂志, 2018, 56(1): 24-29. |
| [2] |
彭兵, 王昕, 廖波, 等. 美国外科医师学院第103届年会胰腺囊性肿瘤研究进展解析[J]. 中华消化外科杂志, 2018, 17(1): 43-46. DOI:10.3760/cma.j.issn.1673-9752.2018.01.012 |
| [3] |
Compagno J, Oertel JE. Mucinous cystic neoplasms of the pancreas with overt and latent malignancy(cystadenocarcinoma and cystadenoma):A clinicopathologic study of 41 cases[J]. Am J Clin Pathol, 1978, 69: 573-580. DOI:10.1093/ajcp/69.6.573 |
| [4] |
Zhang XP, Yu ZX, Zhao YP, et al. Current perspectives on pancreatic serous cystic neoplasms:Diagnosis, management and beyond[J]. World J Gastrointest Surg, 2016, 8: 202-211. DOI:10.4240/wjgs.v8.i3.202 |
| [5] |
Strobel O, Z'Graggen K, Schmitz-Winnenthal FH, et al. Risk of malignancy in serous cystic neoplasms of the pancreas[J]. Digestion, 2003, 68: 24-33. DOI:10.1159/000073222 |
| [6] |
Kimura W, Moriya T, Hirai I, et al. Multicenter study of serous cystic neoplasm of the Japan pancreas society[J]. Pancreas, 2012, 41: 380-387. DOI:10.1097/MPA.0b013e31822a27db |
| [7] |
石木兰. 肿瘤影像学[M]. 北京: 科学出版社, 2003: 119-123.
|
| [8] |
贾永, 赵玲玲, 肖红. 核磁共振与多层螺旋CT在诊断胰腺囊性病变中的临床价值比较[J]. 中国CT和MRI杂志, 2018, 16(5): 103-106. DOI:10.3969/j.issn.1672-5131.2018.05.032 |
| [9] |
尹英爱, 石素胜, 鲁海珍. 胰腺浆液性及黏液性囊性肿瘤35例临床病理分析[J]. 诊断病理学杂志, 2017, 24(10): 721-724. DOI:10.3969/j.issn.1007-8096.2017.10.001 |
| [10] |
刘文平, 崔凤. 胰腺浆液性微囊型腺瘤CT影像学特征分析[J]. 浙江临床医学, 2017, 19(6): 1141-1143. |
| [11] |
王慧慧, 赵心明, 鲁海珍, 等. 胰腺浆液性微囊性囊腺瘤CT和MRI表现[J]. 实用放射学杂志, 2017, 33(9): 1368-1370. DOI:10.3969/j.issn.1002-1671.2017.09.011 |
| [12] |
郝敬军, 赵林, 庄伟雄, 等. 胰腺浆液性囊腺瘤与黏液性囊腺瘤的CT诊断与鉴别[J]. 医学影像学杂志, 2017, 27(2): 273-276. |
| [13] |
汪毅, 宋希根. 胰腺导管内乳头状黏液性肿瘤的CT和MRI特征及诊断价值研究[J]. 河南医学研究, 2017, 26(18): 3292-3294. DOI:10.3969/j.issn.1004-437X.2017.18.011 |
| [14] |
余鸿鸣, 张庆雷, 朱斌, 等. 胰腺囊性病变的影像学诊断及鉴别诊断[J]. 中国中西医结合影像学杂志, 2016, 14(4): 458-460. DOI:10.3969/j.issn.1672-0512.2016.04.030 |
| [15] |
周英, 程东风, 韩庆森, 等. 胰腺囊实性病变的MSCT特征[J]. 中国中西医结合影像学杂志, 2013, 11(3): 295-298. DOI:10.3969/j.issn.1672-0512.2013.03.024 |
| [16] |
宋瑞娟, 关长旭, 张芳, 等. 胰腺实性-假乳头状瘤CT和磁共振诊断及鉴别诊断[J]. 实用医学影像杂志, 2018, 19(1): 26-28. |
 2019, Vol. 17
2019, Vol. 17


