| 经直肠实时剪切波弹性成像对前列腺癌的诊断效能及其与PSA、Gleason评分的相关性 |
前列腺癌是最常见的泌尿生殖系统恶性肿瘤之一,也是男性癌症死亡的第二大原因,近年来呈逐渐上升趋势[1]。前列腺癌早期临床症状不明显,部分患者确诊时多为中晚期。因此,提高诊断准确率和及时性对术前诊断及预后评估有重要价值。直肠指检、前列腺特异性抗原(porstate specafic artigen,PSA)、MRI、经直肠超声(transrectal of ultrasound,TRUS)引导下系统活检等是目前筛查前列腺癌的主要方法[2]。直肠指检对前列腺深部或较小病变不易触诊;受患者年龄、良性前列腺增生等因素的影响,血清PSA值可能高于正常值,影响诊断[3];MRI对前列腺癌诊断的特异度较高,但敏感度较低;TRUS引导下系统活检对前列腺癌诊断敏感度低,且因穿刺针数较多易诱发出血和感染[4]。前列腺癌早期病变组织即可出现硬度变化,高于周围正常腺体组织[5]。剪切波弹性成像(shear wave elastagraphy,SWE)作为全新的超声弹性量化技术,可无创量化病变组织硬度信息[6]。本研究探讨经直肠SWE结合弹性模量值在鉴别前列腺良恶性病变中的诊断效能,并分析不同水平弹性模量值[最大弹性模量值(Emax)、平均弹性模量值(Emean)、最小弹性模量值(Emin)]与PSA、Gleason评分的相关性。
1 资料与方法 1.1 一般资料选取2018年10月至2021年9月在我院就诊的121例前列腺病变患者;年龄39~87岁,平均(70.7±8.1)岁;血清PSA(18.91±9.16)μg/L。纳入标准:直肠指检触及结节/整个腺体僵硬,或TRUS检出1个或多个结节;行TRUS、经直肠SWE、前列腺穿刺活检或前列腺手术切除的患者;PSA≥4 μg/L。排除标准:经病理证实为其他恶性病变。本研究经医院伦理委员会审核,患者均豁免知情同意。
1.2 仪器与方法采用SuperSonic Imagine Aixplorer超声诊断仪,经直肠探头SE12-3,频率3~12 MHz。检查前1 d灌肠,排空肠道,经血清PSA检测后,行TRUS检查。患者保持左侧卧位屈膝,将探头插入直肠整体扫查2次,记录前列腺大小、是否存在异常回声,以及病灶大小、形态、回声、血流情况、是否侵犯包膜等。
切换至SWE模式,选择TRUS扫查可疑病灶,若无异常,则选择前列腺最大横切面进行检查,实时双幅显示弹性图像和灰阶图像,弹性成像量程调整为70~90 kPa。取样框分别放置于前列腺基、中、尖、两侧,并根据前列腺大小设置取样框,每个切面至少保持3~5 s后,获取弹性图像。操作时,注意探头轻触直肠壁,避免施加外力。开启Q-Box测量功能,取样框应包括ROI,测量Emax、Emean和Emin。常规超声与SWE图像均未显示病灶时,选取最大横切面腺体实质的弹性模量值。以上操作均由2名经验丰富的超声科主治医师进行。
1.3 统计学方法采用SPSS 22.0软件分析数据。符合正态分布的计量资料用x±s表示,2组间比较行独立样本t检验。以前列腺活检病理为金标准,绘制ROC曲线,计算AUC,采用DeLong检验比较不同参数的AUC。弹性模量值与血清PSA、Gleason评分的相关性行Pearson相关分析。不同Gleason评分组前列腺癌弹性模量值的比较采用方差分析,两两比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果121例中良性59例(良性组),其中前列腺增生49例、前列腺增生合并前列腺炎8例、结核性前列腺炎2例;恶性62例(恶性组),其中前列腺癌59例、尿路上皮癌2例、肉瘤样癌1例。
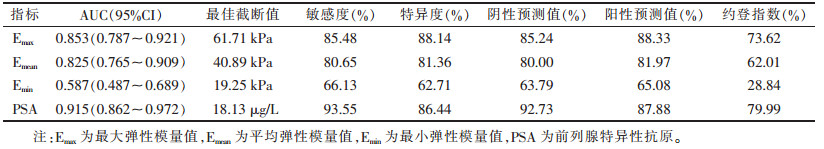
恶性组Emax、Emean、Emin均显著高于良性组(均P<0.05;表 1,图 1、2)。Emax、Emean、Emin、PSA对前列腺恶性病变的诊断效能见表 2、图 3。其中,Emax与Emean的AUC差异无统计学意义(Z=1.031,P=0.331),且均高于Emin(Z=6.708,6.096;均P<0.01);血清PSA与Emax的AUC差异无统计学意义(Z=1.856,P=0.589),而血清PSA的AUC与Emean及Emin差异均有统计学意义(Z=2.131,7.011;均P<0.05)。
| 表 1 良性组与恶性组的PSA水平及弹性模量值比较(x±s) |
 |
 |
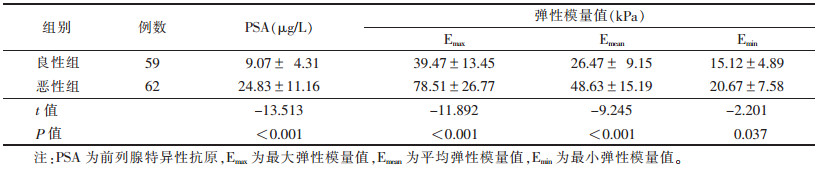
| 注:患者,男,58岁,前列腺特异性抗原(PSA)为4.6 μg/L,SWE图像上前列腺回声均匀分布,整体弹性低,最大弹性模量值(Emax)20.7 kPa,平均弹性模量值(Emean)17.7 kPa,最小弹性模量值(Emin)14.1 kPa,病理证实为前列腺炎 图 1 良性前列腺炎的剪切波弹性成像(SWE)图像 |
 |
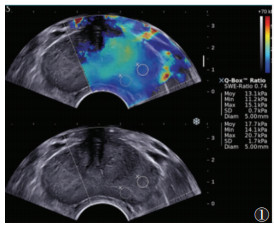
| 注:患者,男,57岁,PSA为26.62 μg/L,SWE图像上呈不对称分布,病灶处硬,Emax 55.1 kPa,Emean 54.0 kPa,Emin 51.8 kPa,病理证实为Gleason评分为7分的腺癌 图 2 前列腺癌的SWE图像 |
| 表 2 Emax、Emean、Emin及PSA对前列腺恶性病变的诊断效能比较 |
 |
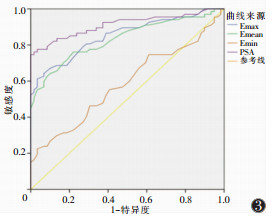 |
| 图 3 Emax、Emean、Emin、PSA诊断前列腺癌的ROC曲线 |
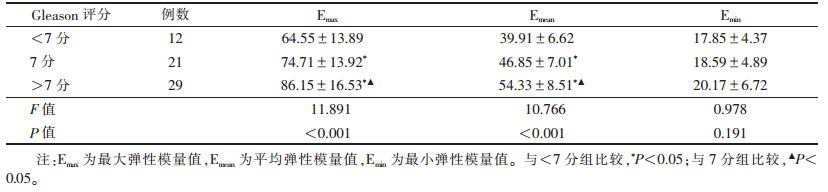
恶性组Emax、Emean和Emin与血清PSA水平呈正相关(r=0.781,0.632,0.517;均P<0.01)。Emax、Emean与Gleason评分呈正相关(r=0.695,0.587;均P<0.01),Emin与Gleason评分无相关性(r=0.163,P=0.191;表 3)。
| 表 3 不同Gleason评分前列腺恶性病变的Emax、Emean、Emin比较(kPa,x±s) |
 |
3 讨论
约67%的前列腺癌临床表现为多灶性或散发性,病灶沿前列腺包膜进展的特性,使其不同于其他表现为明确结节的恶性肿瘤;前列腺癌易受多种因素影响,超声表现复杂多变[7]。准确鉴别前列腺病变的良恶性,对临床治疗方式的选择及预后有重要价值。
Ageeli等[8]认为,前列腺癌病变区域组织硬度的改变可能早于形态学和血流分布的改变。Sharen等[9]研究表明,前列腺癌变组织比正常组织硬度高。因此,准确评估前列腺病变区域组织硬度对前列腺癌的诊断有一定价值。经直肠实时SWE可通过传感器传递辐射脉冲,并不断地聚焦于不同的组织深度,基于马赫锥原理产生的横波速率,获得弹性模量参数的绝对值。与应变弹性成像、声辐射力脉冲成像等其他弹性成像相比,SWE能自动分析组织硬度,且探头可自行产生高频声波,对同一组织多次的测量结果一致性较好,可减少因主观操作不稳定产生的误差[10]。
本研究在前列腺局灶性结节或回声异常区域的弹性变化基础上,采用SWE测量并计算前列腺弹性模量值,量化直肠指检所获得的信息。本研究发现,恶性组的前列腺弹性模量值Emax、Emean、Emin均显著高于良性组(均P<0.05);进一步行ROC曲线分析显示,Emax与Emean的AUC差异无统计学意义(P=0.331),且均显著高于Emin(均P<0.01)。说明当前列腺发生癌变时,其病变区域组织硬度高于周围正常组织区域,与Su等[11-12]研究结果一致,提示弹性模量值可能与前列腺癌变存在密切相关性。
本研究发现,恶性组前列腺弹性模量值(Emax、Emean、Emin)与血清PSA水平呈正相关;ROC曲线分析显示,Emax与血清PSA的AUC差异无统计学意义(P > 0.05),而血清PSA的AUC均高于Emean和Emin(均P<0.05)。原因是PSA作为前列腺癌筛查的重要指标,主要由尿道旁腺及前列腺腺泡细胞分泌,其在血液中表达水平通常较低,但随病变程度加重,前列腺组织逐渐失去腺体屏障,从而导致PSA水平升高,进一步验证了SWE结合弹性模量值对前列腺癌的诊断有较高的临床意义。
Gleason评分目前广泛应用于前列腺癌的组织病理学分级,评分越高代表肿瘤细胞分化越差,病变恶性程度越高[13]。多项研究证实,Gleason评分与前列腺癌病变程度密切相关,且不同分期或浸润程度的前列腺癌病变区域组织弹性和硬度存在差异[9, 14]。本研究显示,Gleason评分与恶性组前列腺的弹性模量值Emax和Emean呈正相关,Gleason评分 > 7分组Emax和Emean均高于其他2组,而Emin与Gleason评分无相关性(r=0.163,P=0191),进一步比较Emax、Emean和Emin对前列腺癌的诊断效能发现,Emin的AUC仅0.587,敏感度和特异度均较低,不同Gleason评分组前列腺癌的Emin差异无统计学意义。Emax、Emean和Emin对前列腺癌的诊断效能存在差异,可能与前列腺病变的病理基础有关,病灶区的肿瘤细胞合成并分泌大量蛋白酶,不断侵犯前列腺组织,破坏正常组织细胞结构,当癌组织替代正常腺体结构时,微血管密度及肿瘤周围胶质沉积增加,致使结构变致密,硬度明显增高。钙化、少数纤维化的良性病变等因素使部分良恶性病变组织硬度Emin区间重合,从而降低Emin对前列腺癌的诊断效能[15]。因此,Emax和Emean较Emin更能有效反映癌变组织硬度[5, 16],对前列腺癌的诊断价值更高。临床多使用Emax和Emean作为诊断前列腺癌的参考指标。本研究还存在一定的局限性:样本量较小,为单中心回顾性分析;前列腺癌常伴的前列腺增生、多灶性分布、肿瘤内部缺血坏死等因素会影响SWE定量分析的敏感度,后续可进行多中心、大样本的前瞻性研究。
综上所述,SWE结合弹性模量值可作为鉴别前列腺肿瘤良恶性的一个新方法,可提高前列腺癌的检出率,并为该病的术前诊断、临床治疗方案选择及预后判断提供依据。
| [1] |
DING Z, SONG D, WU H, et al. Development and validation of a nomogram based on multiparametric magnetic resonance imaging and elastography-derived data for the stratification of patients with prostate cancer[J]. Quant Imaging Med Surg, 2021, 11(7): 3252-3262. DOI:10.21037/qims-20-978 |
| [2] |
JI Y, RUAN L, REN W, e t, a l. Stiffness of prostate gland measured by transrectal real-time shear wave elastography for detection of prostate cancer: a feasibility study[J]. Br J Radiol, 2019, 92(1097): 20180970. DOI:10.1259/bjr.20180970 |
| [3] |
魏杰, 杨晓, 魏灿, 等. 超声剪切波弹性成像引导前列腺穿刺的应用及其在前列腺良恶性病变诊断中的价值[J]. 中华男科学杂志, 2019, 25(9): 792-796. |
| [4] |
刘培志, 刘水澎, 龚娥, 等. 常规超声、超声造影及剪切波弹性成像联合临床指标诊断前列腺癌的价值[J]. 临床超声医学杂志, 2021, 23(12): 905-909. |
| [5] |
KAMALOY A A, KADREV A V, MITKOVA M D, et al. Shear wave elastography guided targeted biopsy in the diagnosis of prostate cancer[J]. Urologiia, 2020, 12(6): 106-113. |
| [6] |
方毅, 王学梅. 经直肠超声剪切波弹性成像诊断外周带前列腺癌及与Gleason评分间关系[J]. 中国超声医学杂志, 2018, 34(12): 1122-1125. |
| [7] |
巫明钢, 卢漫, 何发伟, 等. 剪切波弹性成像在前列腺癌诊断中的价值[J]. 中国老年学杂志, 2021, 41(24): 5525-5528. DOI:10.3969/j.issn.1005-9202.2021.24.014 |
| [8] |
AGEELI W, WEI C, ZHANG X, et al. Quantitative ultrasound shear wave elastography (USWE)-measured tissue stiffness correlates with PIRADS scoring of MRI and Gleason score on whole-mount histopathology of prostate cancer: implications for ultrasound image-guided targeting approach[J]. Insights Imaging, 2021, 12(1): 96. DOI:10.1186/s13244-021-01039-w |
| [9] |
SHAREN G W, ZHANG J. Application of shear wave elastography and contrast-enhanced ultrasound in transrectal prostate biopsy[J]. Curr Med Sci, 2022, 42(2): 447-452. DOI:10.1007/s11596-022-2484-1 |
| [10] |
杨竹馨, 熊敏, 王宁, 等. 剪切波弹性成像测定弹性模量值与前列腺癌病变程度和Gleason评分的相关性分析[J]. 中国医学装备, 2021, 18(6): 43-46. |
| [11] |
SU R, XU G, XIANG L, et al. A novel scoring system for prediction of prostate cancer based on shear wave elastography and clinical parameters[J]. Urology, 2018, 121(1): 112-117. |
| [12] |
贾海云, 王佳强, 周晓莹, 等. 剪切波弹性成像联合多参数MRI对临床显著性前列腺癌的诊断价值[J]. 临床超声医学杂志, 2022, 24(8): 603-607. |
| [13] |
刘婉君, 方毅, 刘辉, 等. 经直肠超声造影和直肠超声剪切波弹性成像联合血清前列腺特异性抗原诊断早期前列腺癌的价值[J]. 中华实用诊断与治疗杂志, 2022, 36(6): 608-611. |
| [14] |
王引弟, 陈斌娟, 童明辉, 等. 剪切波弹性成像联合前列腺特异抗原密度在前列腺癌穿刺活检中的应用价值[J]. 国际泌尿系统杂志, 2020, 40(5): 816-818. |
| [15] |
吴凡, 张明博, 王一茹, 等. 经直肠剪切波超声弹性成像模式联合弹性模量在前列腺癌诊断中的应用价值[J]. 中国医学科学院学报, 2020, 42(1): 73-79. |
| [16] |
张超, 李晓琴, 壮健, 等. 经直肠剪切波弹性成像联合肿瘤标记物对早期前列腺癌的诊断价值研究[J]. 中国超声医学杂志, 2020, 36(12): 1126-1129. |
 2023, Vol. 21
2023, Vol. 21


