| 先天性肝内门-体静脉分流的彩色多普勒超声表现分析 |
2. 郑州大学附属儿童医院 河南省儿童医院 郑州儿童医院放射科,河南 郑州 450000
先天性肝内门-体静脉分流(intrahepatic portosystemic venous shunt,IPSVS)指肝内的门静脉分支与汇入下腔静脉的肝静脉主干或分支直接连通形成的异常分流,是门体静脉分流常见的类型[1],1793年Abernethy对该病进行了首次报道。根据引流部位不同可分为肝内型和肝外型,CIPSVS临床罕见,严重时可诱发肺动脉高压和肝性脑病。笔者回顾性分析我院2010年1月至2018年7月收治的8例CIPSVS患儿的资料,结合相关文献探讨该病的彩色多普勒超声图像特点,报道如下。
1 资料与方法 1.1 一般资料8例均经CT增强扫描证实,其中男3例,女5例;年龄20 d~2岁;肝功能异常6例,其中3例合并全身多发血管瘤;肺动脉高压2例。随访1例患儿全身血管瘤消失,血氨正常,未发生肝性脑病。
1.2 仪器与方法采用Philips IU22、日立阿洛卡Prosound F75超声诊断仪,探头频率5~17 MHz。患儿熟睡后对其肝脏各叶段行多切面连续动态扫查,二维超声观察病变部位、血管走行及图像特征,观察门静脉与肝静脉间是否有异常交通或瘤样扩张;根据彩色多普勒超声图像上血流方向判断供血静脉及引流静脉;频谱多普勒超声测定病变部位血管的血流速度参数,多次测量病变范围及分流口流速,并取平均值。
2 结果 2.1 二维超声表现病变均位于肝实质内近肝脏表面或叶段边缘,1例单发,7例多发,二维超声呈管型、囊状及不规则无回声,大小1.1 cm×2.4 cm~2.5 cm×3.4 cm。其中肝右叶1例,为门静脉右前叶支-肝右静脉分流;肝左叶3例,1例为门静脉左支-肝中静脉分流(图 1a),2例为门静脉左内叶支-肝左静脉分流;左、右叶均受累4例,2例为门静脉右前支-肝中静脉分流并门静脉左外叶下段支-肝左静脉分流,1例为门静脉右支-肝右静脉分流并门静脉左内支-肝中静脉分流,1例为门静脉右支-肝右静脉、肝中静脉分流并门静脉左内支-肝左静脉分流(图 2)。8例均伴肝内多发血管瘤。病变处门静脉端分流口内径范围0.07~0.26 cm,肝静脉端分流口内径范围0.12~0.22 cm。
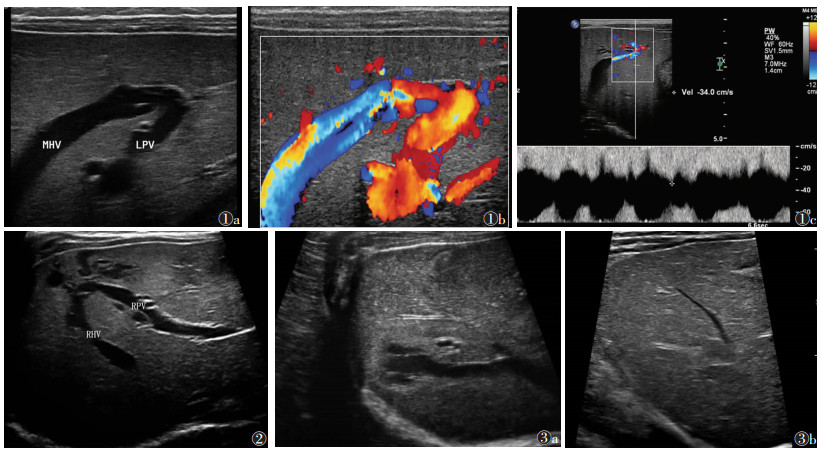 |
| 图 1 男,23 d 图 1a 二维超声示门静脉左支与肝中静脉直接相通 图 1b 彩色多普勒超声可见自门静脉流向肝静脉的血流信号 图 1c 频谱多普勒超声于肝静脉端录及连续静脉样血流频谱,最高流速34.0 cm/s 图 2 女,42 d,二维超声示门静脉右支与肝右静脉直接相通 图 3 女,22 d 图 3a 初次检查时肝右静脉远端呈囊状扩张 图 3b 6个月后复查,肝右静脉远端囊状扩张逐渐消失(MHV,肝中静脉;LPV,门静脉左支;RHV,肝右静脉;RPV,门静脉右支) |
2.2 彩色多普勒及脉冲多普勒超声表现
彩色多普勒超声检查可见自门静脉分支至肝静脉的红蓝交替的血流信号,无搏动性(图 1b),脉冲多普勒超声在分流门静脉探及连续性低速带状血流信号,在引流的肝静脉内可探及连续性单向血流频谱(图 1c),平均流速30.5 cm/s,最高流速65.0 cm/s。2例引流肝静脉内径增宽,分别为1.2、1.5 cm,1例呈囊状扩张。
2.3 随访结果随访1例,男,出生后34 d因头、面、颈、躯干、四肢、阴囊、会阴等全身皮肤多发血管瘤就诊,入院MSCT及超声诊断CIPSVS Ⅳ型。肝右静脉、肝中静脉远端扩张呈囊状(图 3a),门静脉右前支与肝中静脉分流并门静脉左外叶下段支与肝左静脉相通。患儿遵医嘱口服普萘洛尔1.5 mg·kg-1·d-1,分3次8 h口服,3 d后增至2.0 mg·kg-1·d-1,并分别于2、4、6个月后门诊复查,肝右静脉、肝中静脉远端囊状扩张逐渐缩小(图 3b),皮肤及肝内血管瘤逐渐消失,门静脉-肝静脉分流分支逐渐闭合,全身血管瘤消失。
3 讨论胚胎第4周,左、右卵黄静脉和脐静脉穿过原始膈漏入肝内窦状隙。当肝脏长入原始膈时,该静脉与肝相邻的一段均被包入肝内并在肝内分成许多分支与肝血窦相通,因此被肝分成输入和输出两段。输出段即自肝至静脉窦的一段,形成肝静脉和下腔静脉肝段,输入段形成门静脉的始基。胚胎8~12周肝内肝静脉和门静脉逐渐形成,CIPSVS是由于持续脐肠系膜静脉系统与静脉窦右角的静脉留存,或门静脉先天性静脉瘤破裂至肝静脉导致持续的静脉交通[2]。根据吻合部位不同,CIPSVS可分为肝外和肝内分流,肝外门-体静脉分流(congenital extrahepatic portosy- stemic shunt,CEPS),又称Abernethy畸形,分为Ⅰ型:门静脉血完全流入肝静脉,常合并其他多种先天畸形、肝脏结节样增生和肿瘤;Ⅱ型:门静脉血部分回流到肝脏,有门静脉灌注、门静脉和肝静脉侧-侧吻合。IPSVS是指肝内的门静脉分支与体循环的静脉分支直接连通形成的异常分流,包括门静脉分支与肝静脉或下腔静脉之间的异常交通(包括静脉导管)[3]。Park等[4]根据解剖形态将IPSVS分为4型:Ⅰ型为单一管状结构,连接于门静脉右支至下腔静脉;Ⅱ型是局限于肝脏某一段内门静脉、肝静脉分支间的单个或多个交通;Ⅲ型是外周肝静脉与门静脉分支通过一囊状结构交通;Ⅳ型是肝内2分叶以上分布的肝静脉、门静脉间弥漫交通。本组8例,超声诊断均为门静脉分支与肝静脉之间的分流,未见门静脉与下腔静脉分流者。静脉导管未闭的分流是IPSVS的特殊类型,静脉导管起源于门静脉左支,终止于下腔静脉第2肝区,出生后1~2 d关闭退化成静脉韧带。当静脉导管未能闭合时,门静脉血直接进入体循环,未经灭活的内毒素和细胞因子等缩血管物质对多系统均有影响,加重肺动脉高压时形成门静脉性肺动脉高压[5]。
CIPSVS可导致一些严重的并发症,如肺动脉高压、肺肝综合征、肝性脑病和肝脏肿瘤等[6]。肝脏具有解毒功能,由于门静脉血液通过异常血管绕过肝脏,这种分流可引起无肝性脑病的高氨血症。肝性脑病是由于循环毒素的脑作用,常首先在肝脏中通过代谢,在血浆中,有大量的半乳糖、胆汁酸、氨和其他含氨物质,其中一些会影响大脑。肿瘤的进展可能是由于肝脏过度动脉化、缺乏门静脉血流、增加了肝脏生长因子(如胰岛素、胰高血糖素、肝细胞生长因子)或这些因素的综合作用。Ohno等[7]报道,肺动脉高压、慢性胰腺炎是门体静脉分流的主要并发症,肺动脉高压源于肠系膜循环通过门静脉系统分流入肺部,微动脉栓塞进一步增加了肺动脉压力。胰腺炎可能是由于门静脉分流使血液中高锰水平导致胰液积聚,从而最终导致胰腺组织损伤,因此早期准确诊断是预防并发症的关键。经静脉导管分流的CIPSVS病情重、预后差,如合并动静脉瘘可进一步加大分流量,突出表现为门静脉高压与肺动脉高压。
由于异常交通的存在,CIPSVS时门静脉与肝静脉间存在较大压差,大量门静脉血进入肝静脉致肝静脉压力增高,二维超声表现为肝实质内囊状或迂曲管状的无回声,无搏动性;彩色多普勒超声示无回声区内呈红蓝相间的鱼钩样血流信号,血流方向自门静脉至肝静脉,分流量大时相连的肝静脉增宽及流速增快,表现为五彩花色血流束;频谱多普勒超声于静脉端表现为连续的带状多相频谱。由于CIPSVS临床罕见,部分临床医师对该病缺乏认识,易误诊为肝囊肿、肝内胆管扩张、肝内动静脉瘘等。因此在检查过程中应多切面连续扫查,认真分析血流频谱,准确确定血供来源及分型,避免误诊。CIPSVS早期可无临床症状,但晚期会出现肝功能异常及肝性脑病可能[8]。CIPSVS发展成肝性脑病或肝肿瘤的风险取决于分流的数量和持续的时间,彩色多普勒超声能够对分流口的分流率进行准确测量。当分流口分流率(分流量/门静脉总流量)<30%时不会出现神经系统症状;当分流率>30%时,肝性脑病可随时出现;当分流率>60%时,肝性脑病的发生率很高,此时即使未出现肝性脑病,也应进行合适的预防或治疗。小的肝内分流有时会在1、2岁时自行消失[9],大分流和肝外分流存在整个病程中,有并发症的风险。本组由于患儿发现较早且均为肝内分流,临床均无严重并发症。但随年龄增长,大脑对毒素的耐受逐渐降低,仍有并发肝性脑病的风险,因此应定期随访彩色多普勒超声,密切观察病变形态及血流动力学变化。
总之,虽然CIPSVS在2岁左右有自发性闭合的可能,但仍需密切观察患儿的精神症状和并发症。彩色多普勒超声能实时显示血管的内径、走行、血流方向、状态等信息,是诊断和随访CIPSVS的最佳检查手段。
| [1] |
谭石, 傅强, 刘士榕, 等. 超声造影在肝内门体静脉分流中的诊断价值[J]. 哈尔滨医科大学学报, 2018, 52(5): 484-487. DOI:10.3969/j.issn.1000-1905.2018.05.020 |
| [2] |
Stringer MD. The clinical anatomy of congenital portosystemic venous shunts[J]. Clin Anat, 2008, 21: 147-157. DOI:10.1002/ca.20574 |
| [3] |
傅强, 谭石, 崔立刚, 等. 先天性肝内门静脉-肝静脉分流的超声诊断[J]. 中华肝脏病杂志, 2013, 21(12): 940-943. DOI:10.3760/cma.j.issn.1007-3418.2013.12.013 |
| [4] |
Park JH, Cha SH, Han JK, et al. Intrahepatic portosystemic venous shunt[J]. AJR Am J Roentgenol, 1990, 155: 527-528. DOI:10.2214/ajr.155.3.2117349 |
| [5] |
谢恩萍, 张国庆, 步军. 新生儿先天性门体静脉分流合并髂动脉脐静脉瘘一例报告并文献复习[J]. 中华新生儿科杂志, 2017, 32(4): 287-290. DOI:10.3760/cma.j.issn.2096-2932.2017.04.011 |
| [6] |
季敏, 吴先胜, 龚英, 等. 并发消化道出血的先天性门体分流畸形8例影像学特征病例系列报告[J]. 中国循证儿科杂志, 2017, 12(2): 357-361. |
| [7] |
Ohno T, Muneuchi J, Ihara K, et al. Pulmonary hypertension in patients with congenital portosystemic venous shunt:a previously unrecognized association[J]. Pediatrics, 2008, 121: e892-e899. DOI:10.1542/peds.2006-3411 |
| [8] |
吴碧君, 谢佳佳, 周苏晋, 等. 彩色多普勒超声诊断肝内门一体静脉分流价值探讨[J]. 实用肝病杂志, 2015, 18(4): 391-394. |
| [9] |
Han BH, Park SB, Song MJ, et al. Congenital portosystemic shunts:prenatal manifestations with postnatal confirmation and follow-up[J]. J Ultr Med, 2013, 32: 45-52. DOI:10.7863/jum.2013.32.1.45 |
 2019, Vol. 17
2019, Vol. 17


