| 经皮耳穴迷走神经电刺激治疗难治性及非难治性抑郁症的脑效应比较 |
2. 中国中医科学院, 北京 100700
2. Chinese Academy of Traditional Chinese Medicine, Beijing 100700, China
抑郁症是临床常见的情感性精神障碍类疾病,主要表现为显著而持续的情绪低落、兴趣减退、思维迟缓、持续疲乏、意志活动减退等,具有较高的致残与自杀风险[1]。目前,抑郁症的治疗主要以药物和心理治疗为主,但临床仍有约30%的抑郁症患者在使用2种及以上不同化学结构的抗抑郁药物,足量、足疗程治疗后疗效欠佳,此类抑郁症被称为难治性抑郁症(treatment-resistant depression,TRD)[2-3]。因此,寻求有效治疗TRD的其他非药物疗法成为目前抗抑郁领域的重点研究方向。
经皮耳穴迷走神经电刺激(transcutaneous auricular vagus nerve stimulation,taVNS)作为一种新型的无创耳电针疗法,其主要是通过微电流刺激耳穴内脏代表区——耳甲区,以调节相应脏腑功能,其已被广泛应用于神经系统疾病、精神及行为障碍疾病等的治疗中[4]。研究发现,taVNS对轻中度TRD临床治疗有效[5-7],其治疗效应与默认网络[5]、突显网络[8]、视觉加工网络[9]、认知控制网络[10]等网络的调节有关,但缺乏taVNS治疗TRD与非难治性抑郁症(non-treatment-resistant depression,nTRD)脑效应机制比较的研究。因此,本研究在既往研究基础上,以静息态fMRI的低频振幅(amplitude of low-frequency fluctuation,ALFF)为切入点,初步探索taVNS治疗TRD与nTRD的疗效差异,为不同类型抑郁症的治疗机制提供科学依据。
1 资料与方法 1.1 一般资料纳入2018年1月至2021年11月就诊于中国中医科学院广安门医院心身医学科、北京市第一中西医结合医院精神科、清华大学玉泉医院精神科及首都医科大学宣武医院神经内科的24例TRD患者(TRD组)及31例nTRD患者(nTRD组)。所有患者均符合《精神障碍诊断与统计手册》第五版(DSM-5)[11]的抑郁症标准。
纳入标准:①17项汉密尔顿抑郁量表(17-item Hamilton rating scale for depression,HAMD-17)评分>17分;②右利手;③临床查体及实验室检查无明显异常。TRD组为经2种及以上不同化学结构的抗抑郁药物足量、足疗程治疗后仍无效的抑郁症患者[2]。nTRD组为服用1种抗抑郁药物后症状得到缓解(HAMD-17评分下降>50%),入组前复发,或首次发病且未接受过任何抗抑郁药物或其他物理疗法治疗的抑郁症患者。
排除标准:①患有严重的神经系统疾病及心、脑、肾等躯体疾病者;②有药物、毒品或酒精等滥用史者;③有自杀风险疾病患者;④存在MRI检查禁忌证;⑤孕妇及哺乳期妇女。
2组均在纳入前及治疗结束后行HAMD-17及冗思量表(ruminative response scale,RRS)评估。所有患者均签署知情同意书,本研究经中国中医科学院广安门医院伦理委员会批准(伦理号:2017-021-SQ),并于中国临床试验注册中心注册(注册号:ChiCTR1800014277)。
1.2 仪器与方法 1.2.1 MRI检查方法采用Magneton Skyra 3.0 T MRI扫描仪进行数据采集。扫描过程中嘱患者闭眼,保持清醒,避免主观思维活动。固定头部并戴耳塞降低噪音。BOLD参数:TE 30 ms,TR 2 000 ms,层距0.6 mm,层厚3.5 mm,32层,视野224 mm×224 mm,翻转角90°,矩阵64×64,扫描时间6 min 46 s。高清结构像:TE 2.98 ms,TR 2 530 ms,层距、层厚均为1.0 mm,128层,视野256 mm×256 mm,翻转角7°,矩阵64×64,扫描时间6 min 3 s。
1.2.2 taVNS治疗方法TRD组在维持原抗抑郁药物治疗至少稳定4周、自述症状无明确变化的基础上,行taVNS治疗。
先用75%酒精对耳部皮肤常规消毒,将耳夹夹在双侧耳甲腔、耳甲艇处,连接电子针疗仪(华佗牌SDZ-ⅡB型)行微电流刺激治疗。采用频率为4 Hz/20 Hz的疏密波,电流强度≤20 mA,患者自行调节电流强度,以电流无引起明显不适为度,每次治疗30 min,早晚各1次,间隔8 h,每周至少5 d,8周为1个治疗周期。
1.3 图像数据处理利用Matlab2021a的工具DPABI 7.0(http://www.rfmri.org/DPARSF)进行数据预处理:①将DICOM数据转换为NIFTI格式;②去除前10个时间点以保证数据稳定性;③时间层校正,并以中间层作为参考层;④头动校正,剔除在任意方向上移动>2 mm及转动>2°的数据;⑤用极线平面图像(epipolar plane image,EPI)方法进行空间标准化,将患者的功能像转换至蒙特利尔神经病学研究所(Montreal neurological institute,MNI)坐标中(重采样体素为3 mm×3 mm×3 mm);⑥采用半高全宽为6 mm的体素对图像进行平滑;⑦去线性漂移;⑧回归白质、脑脊液、全脑信号。
1.4 ALFF的计算采用DPABI 7.0工具包计算ALFF,以0.01~0.10 Hz行带通滤波,消除呼吸、心跳等生理信号产生的噪声,利用快速傅里叶变换将整个脑体素时间序列转换为频域,计算出表示不同频率下信号振荡强度的功率谱。在特定频率范围内取每个频率功率谱平方根的平均值,得到单个体素的ALFF值,将其除以全脑的平均ALFF值,得到标准化ALFF值。
1.5 统计学分析采用SPSS 26.0软件对数据进行分析。对于符合正态分布以及方差齐性的计量资料以x±s表示,组间比较行两样本t检验,组内比较行配对样本t检验;计数资料采用频数表示,组间比较行χ2检验。
2组治疗前后的全脑ALFF值行混合效应分析,将2组治疗前后的头动参数作为协变量,计算组别主效应、时间主效应,以及时间与组别的交互效应,差异脑区采用GRF矫正,以簇水平P<0.05、阈值体素水平P<0.005为差异有统计学意义。
2 结果 2.1 2组间一般资料比较(表 1)| 表 1 2组一般资料比较 |
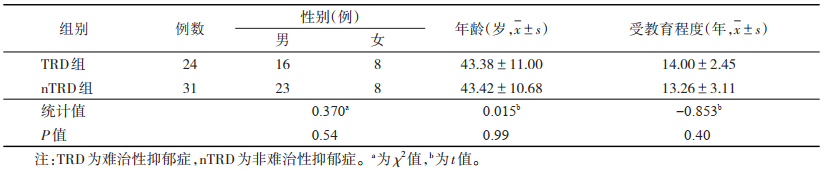 |
nTRD组与TRD组年龄、性别、受教育程度的差异均无统计学意义(均P>0.05)。
2.2 2组治疗前后临床量表评分比较(表 2)| 表 2 治疗前后2组内HAMD-17评分及RRS评分比较(分,x±s) |
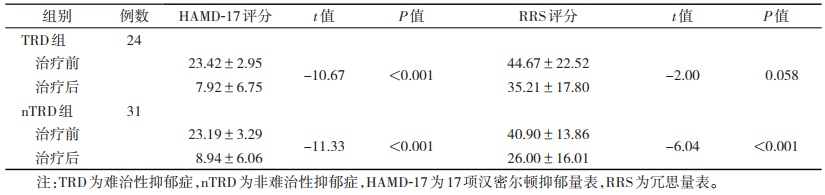 |
治疗8周后,2组的HAMD-17评分均显著下降(均P<0.001),nTRD组的RRS评分显著下降(P<0.001)。
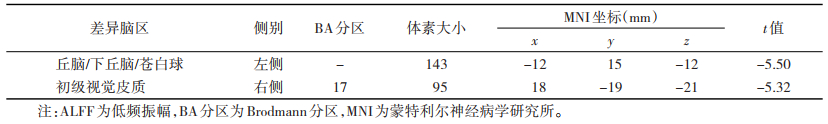
2.3 脑影像结果 2.3.1 治疗前2组ALFF值比较(表 3,图 1)| 表 3 2组治疗前ALFF值差异脑区 |
 |
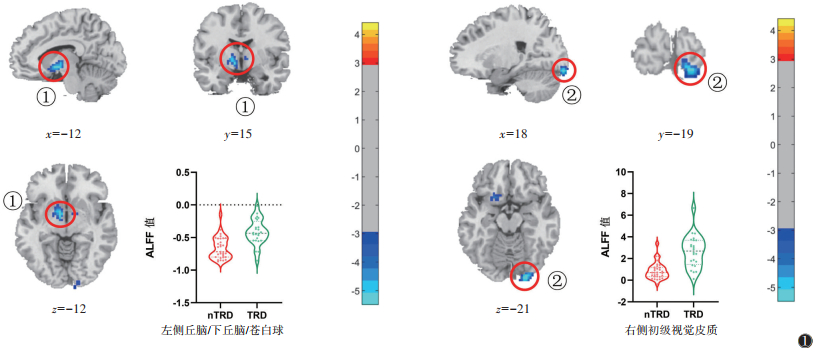 |
| 注:①左侧丘脑/下丘脑/苍白球(-12,15,-12);②右侧初级视觉皮质(18,-19,-21);颜色由蓝色到黄色表示ALFF值由低到高的程度(阈值体素水平P<0.001,簇水平P<0.05)。小提琴图分别表示2组在左侧丘脑/下丘脑/苍白球及右侧初级视觉皮质的ALFF值差异。TRD为难治性抑郁症,nTRD为非难治性抑郁症 图 1 2组治疗前低频振幅(ALFF)值有差异的脑区 |
以头动框架位移值作为协变量,nTRD组在左侧丘脑/下丘脑/苍白球及右侧初级视觉皮质ALFF值显著低于TRD组(t=-5.50,-5.32;均P<0.001)。
2.3.2 治疗8周后2组ALFF值比较(表 4,图 2)| 表 4 2组治疗8周前后ALFF值差异脑区 |
 |
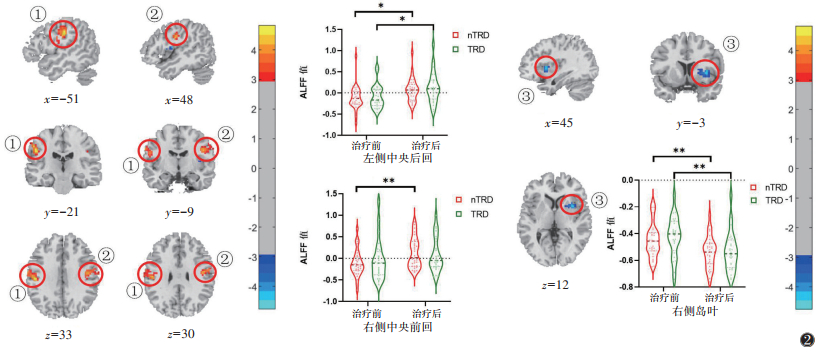 |
| 注:①左侧中央后回(-51,-21,33),②右侧中央前回(48,-9,30),③右侧岛叶(45,-3,12);颜色由蓝色到黄色表示ALFF值由低到高的程度(阈值体素水平P<0.005,簇水平P<0.05)。上述小提琴图分别表示2组在左侧中央后回、右侧中央前回、右侧岛叶的ALFF值差异,*P<0.005,**P<0.001。TRD为难治性抑郁症,nTRD为非难治性抑郁症 图 2 2组治疗8周后低频振幅(ALFF)值有差异的脑区 |
治疗8周后,时间主效应显示左侧中央后回、右侧中央前回ALFF值显著升高(t=4.82,4.23;均P<0.005),右侧岛叶ALFF值显著降低(t=-4.42,P<0.005)。事后分析显示nTRD组左侧中央后回ALFF值显著升高(t=3.94,P<0.005),右侧中央前回ALFF值显著升高(t=3.55,P<0.001),右侧岛叶ALFF值显著降低(t=-4.40,P<0.001),TRD组左侧中央后回ALFF值显著升高(t=3.11,P<0.005),右侧岛叶ALFF值显著降低(t=-5.17,P<0.001)。
2.3.3 2组时间与组别交互效应(表 5,图 3)| 表 5 2组时间与组别交互效应差异脑区 |
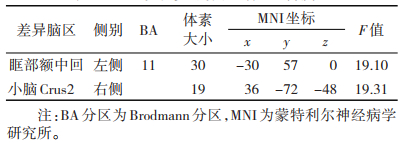 |
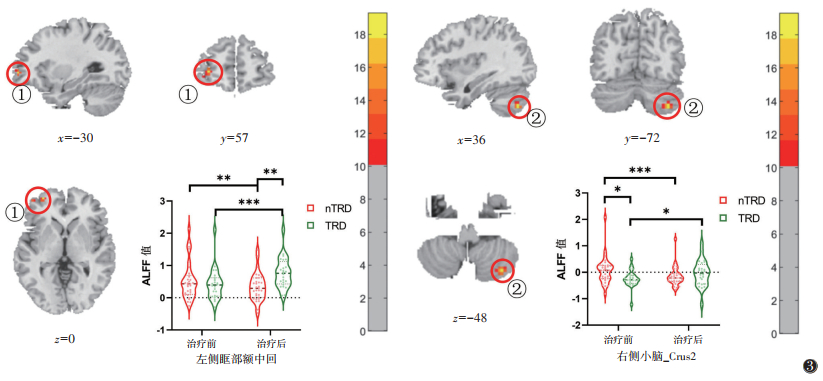 |
| 注:①左侧眶部额中回(-30,57,0);②右侧小脑Crus2(36,-72,-48);颜色由蓝色到黄色表示ALFF值由低到高的程度(阈值体素水平P<0.005,簇水平P<0.05)。上述小提琴图分别表示2组治疗前后在左侧眶部额中回与右侧小脑Crus2的ALFF值的差异,*P<0.05,**P<0.005,***P<0.001。ALFF为低频振幅,TRD为难治性抑郁症,nTRD为非难治性抑郁症 图 3 2组时间与组别交互效应差异脑区 |
2组时间与组别交互效应显示,左侧眶部额中回与右侧小脑Crus2是2组治疗前后比较的差异脑区(F=19.10,19.31;均P<0.005)。nTRD组治疗后左侧眶部额中回与右侧小脑Crus2的ALFF值显著降低(t=-2.60,-4.06;均P<0.001),TRD组治疗后左侧眶部额中回与右侧小脑Crus2的ALFF值升高(t=5.73,2.25;均P<0.05)。治疗后nTRD组左眶额中回ALFF值显著低于TRD组(t=-2.58,P<0.05)。
3 讨论 3.1 taVNS治疗抑郁症有效既往研究已证实针刺治疗抑郁症的有效性[5, 12-14]。高垣等[12]在一项随机对照试验中应用调气解郁法针刺治疗TRD 8周后,发现观察组(针刺联合用药)患者HAMD-24评分应答率显著高于对照组(常规用药组),表明传统手针可改善TRD患者抑郁及焦虑情绪。Rong等[13]运用taVNS对抑郁症患者行4周治疗后,发现真针组比假针组症状改善更明显,且临床症状改善一直持续到第12周。团队既往研究也发现,4周的taVNS治疗能有效降低抑郁症患者的HAMD-24评分[5],8周taVNS治疗可使TRD患者HAMD-17减分率达到76.87%[14]。本研究发现经8周taVNS治疗后,TRD组及nTRD组的HAMD-17评分均显著下降,这与团队前期的研究[14]结果一致,进一步证实taVNS对TRD及nTRD患者治疗的有效性,是抑郁症领域具有发展前景的治疗新方法。同时,nTRD组治疗后RRS评分显著下降,而TRD组治疗前后RRS评分差异无统计学意义,表明taVNS在改善TRD患者反刍思维方面疗效欠佳,提示TRD的治疗难度大于nTRD。
3.2 TRD与nTRD的脑机制存在差异ALFF是静息态fMRI研究常用的分析指标,其幅度的改变与病变程度相关。本研究发现,治疗前,相较于nTRD组,TRD组左侧丘脑/下丘脑/苍白球ALFF值更高,表明皮质—纹状体—苍白球—丘脑(cortico-striatal-pallidal-thalamic,CSPT)回路存在异常。CSPT回路以整合的方式连接前额叶皮质、基底神经节和丘脑,以支持不同的情绪、认知和运动过程[6],CSPT回路异常是抑郁症的病理生理学机制之一[15]。丘脑是CSPT回路中的一个重要节点,痛苦情绪的处理与丘脑活动有关,而自杀的情绪和想法通常是由情感痛苦驱动,因而抑郁症患者自杀风险可能与丘脑异常活动有关[16]。Yamamura等[17]在一项使用ALFF分析的静息态fMRI研究中发现,TRD患者的右丘脑比率低频振幅值高于nTRD患者。因此,TRD患者与nTRD患者在丘脑/下丘脑/苍白球的ALFF值差异表明CSPT回路可能是治疗TRD的关键回路。除此以外,视觉皮质的功能异常也是抑郁症的病理机制之一,且抗抑郁药可改变视觉皮质的电生理特征和神经递质[18]。Guo等[19]发现TRD患者小脑后叶和默认回路(前扣带回和内侧额回)ALFF值较高,在视觉识别回路(舌回和楔叶)ALFF值较低。Ding等[20]在一项包含了753例抑郁症患者和451例健康对照组的静息态fMRI数据研究中,发现抑郁症患者在默认模式网络、控制网络、注意网络,以及小脑和视觉皮质的大部分区域的非对称系数增加。本研究发现,相比于nTRD组,TRD组右侧初级视觉皮质的功能活动更高,表明抑郁症患者可能存在更广泛的视觉加工功能损伤[9, 21],且由2组患者初级视觉皮质功能活动的差异推测,抑郁症患者视觉加工功能损伤可能与其对抗抑郁治疗的反应程度有关。
3.3 taVNS可能通过躯体感觉运动皮质、岛叶调制抑郁症本研究发现,经过8周治疗后,nTRD组与TRD组左侧中央后回、nTRD组右侧中央前回ALFF值升高,2组右侧岛叶ALFF值降低。Williams等[22]在一项关于面部表情识别任务的任务态fMRI研究显示药物治疗1周后抑郁症患者左侧顶叶、中央前回和双侧岛叶的激活增加,与本研究发现的taVNS治疗后差异脑区有重叠。中央前回与躯体运动有关,Gordon等[23]通过fMRI技术,发现躯体运动皮质不仅包括直接控制肌肉运动的区域(效应区),还穿插着躯体-认知行动网络的整合区域,与全身行动计划相关。中央后回与躯体感觉有关[24],具有处理躯体各部位的感觉、触觉注意、感觉运动整合、痛苦刺激的处理、移情,以及情绪的产生与调节等功能。研究表明,双侧中央前回、双侧中央后回和左中央旁回ReHo和ALFF值的降低可能在抑郁患者躯体症状的发作中起作用[25]。本研究中2组患者经8周taVNS治疗后,右侧中央前回、左侧中央后回ALFF值升高,表明taVNS可能通过调制躯体运动、感觉皮质改善抑郁症患者相关躯体运动、认知、躯体感觉、痛苦情绪等症状。岛叶与认知、情感、视觉、感觉运动、高级注意力、决策等功能相关。岛叶前部被认为在情感体验和主观感觉中起关键作用,其在移情和社会认知中的作用已在病变研究中得到证实[26]。在一项关于同理心的meta分析中发现,右侧前岛叶与情感-知觉形式的同理心有关,而左侧岛叶与情感-知觉形式和认知-评估形式的同理心均有关[27]。岛叶的形态或功能的改变可能是抑郁症发生和抑郁症患者出现情感障碍或认知功能障碍的病理基础[28]。本研究taVNS治疗8周后2组患者右侧岛叶ALFF值降低,表明taVNS可能通过调制右侧岛叶改善抑郁症患者的情绪加工、社会认知等相关症状。
3.4 taVNS对TRD与nTRD的脑机制调节通路可能不同本研究发现,TRD组与nTRD组治疗前后的差异脑区是左侧眶部额中回与右侧小脑Crus2,但其调节方向不同,治疗8周后左侧眶部额中回与右侧小脑Crus2的ALFF值在TRD组升高,而在nTRD组降低。眶部额中回属于边缘系统的一部分,主要参与大脑情绪反应与调控,与奖赏、执行功能相关,这些功能与抑郁症的核心症状高度相关[29-30]。眶额皮质灰质体积减少与儿童抑郁症状呈负相关[31],且前额叶皮质和前扣带皮质厚度减少与TRD的病理生理学及TRD的认知障碍有关[32]。有研究表明,眶额回-海马通路在重复经颅磁刺激治疗缓解抑郁症方面起关键作用[33]。随着对小脑高级功能的深入研究,人们越来越关注小脑对认知、情绪处理等功能影响。Guo等[34]研究发现,nTRD患者相较于健康受试者,左侧小脑后叶、右侧梭状回、左侧海马旁的ReHo值明显降低,而他们团队的另外一项研究发现,与健康受试者相比,TRD患者小脑存在大面积的ReHo值升高或降低,且这种改变是否与小脑体积的变化有关尚不明确[35]。而本研究行8周taVNS治疗后,TRD与nTRD差异脑区ALFF值出现反方向变化,可能从侧面佐证了这2种不同类型抑郁症患者的脑机制异常。
综上所述,本研究初步发现:①taVNS治疗抑郁症有效,但对TRD患者反刍思维改善方面疗效欠佳;②TRD与nTRD的脑机制存在差异;③taVNS可调节抑郁症关键脑区,如岛叶、眶部额中回,这可能是其治疗TRD与nTRD的多个靶点,同时小脑可能与taVNS调节抑郁症的脑机制有关;④taVNS治疗TRD与nTRD可能存在不同的脑效应机制。本研究存在的不足:样本量相对较小,结果可能存在一定偏倚;仅关注ALFF一个指标,较单一;未考虑既往不同种类抗抑郁药物对TRD与nTRD患者的影响。今后需扩大样本量,采集局部一致性、功能连接、动脉自旋标记等多种脑功能指标,深入分析taVNS疗效的脑机制,尽可能控制其他因素对结果带来的影响,以提高研究的科学价值。
致谢: 感谢北京市第一中西医结合医院精神科、清华大学玉泉医院精神科和首都医科大学宣武医院神经内科在病例采集中的协作。感谢中国中医科学院科技创新工程项目(CI2021A03301);国家自然科学基金面上项目(82174282,81774433);中央高水平中医医院临床研究和成果转化能力提升项目(HLCMHPP2023072,HLCMHPP2023094)支持。[临床试验注册号] ChiCTR1800014277
[Trial registration] ChiCTR1800014277
| [1] |
Comprehensive mental health action plan 2013—2030[M]. Geneva: World Health Organization, 2021: 1-40.
|
| [2] |
GAYNES B N, LUX L, GARTLEHNER G, et al. Defining treatment-resistant depression[J]. Depress Anxiety, 2020, 37(2): 134-145. DOI:10.1002/da.22968 |
| [3] |
KVERNO K S, MANGANO E. Treatment-Resistant depression: approaches to treatment[J]. J Psychosoc Nurs Ment Health Serv, 2021, 59(9): 7-11. DOI:10.3928/02793695-20210816-01 |
| [4] |
孙继飞, 刘斌, 詹松华, 等. 针灸脑效应的影像学研究现状、挑战与机遇[J]. 中国中西医结合影像学杂志, 2022, 20(1): 1-4, 10. DOI:10.3969/j.issn.1672-0512.2022.01.001 |
| [5] |
FANG J L, RONG P J, HONG Y, et al. Transcutaneous vagus nerve stimulation modulates default mode network in major depressive disorder[J]. Biol Psychiatry, 2016, 79(4): 266-273. DOI:10.1016/j.biopsych.2015.03.025 |
| [6] |
SUN J F, MA Y, DU Z M, et al. Immediate modulation of transcutaneous auricular vagus nerve stimulation in patients with treatment-resistant depression: a resting-state functional magnetic resonance imaging study[J]. Front Psychiatry, 2022, 13: 923783. DOI:10.3389/fpsyt.2022.923783 |
| [7] |
MA Y, WANG Z, HE J K, et al. Transcutaneous auricular vagus nerve immediate stimulation treatment for treatment-resistant depression: a functional magnetic resonance imaging study[J]. Front Neurol, 2022, 13: 931838. DOI:10.3389/fneur.2022.931838 |
| [8] |
SUN J F, CHEN L M, HE J K, et al. A comparative study of regional homogeneity of resting-state fMRI between the early-onset and late-onset recurrent depression in adults[J]. Front Psychol, 2022, 13: 849847. DOI:10.3389/fpsyg.2022.849847 |
| [9] |
孙继飞, 陈丽梅, 何家恺, 等. 难治性与非难治性抑郁症后扣带回静息态功能连接的比较研究[J]. 精神医学杂志, 2022, 35(1): 1-7. |
| [10] |
SUN J F, GUO C L, MA Y, et al. Immediate modulatory effects of transcutaneous auricular vagus nerve stimulation on the resting state of major depressive disorder[J]. J Affect Disord, 2023, 325: 513-521. DOI:10.1016/j.jad.2023.01.035 |
| [11] |
美国精神医学学会. 精神障碍诊断与统计手册[M]. 5版. 张道龙译. 北京: 北京大学出版社, 2015: 27-31.
|
| [12] |
高垣, 童秋瑜, 马文, 等. 调气解郁法针刺治疗难治性抑郁症: 随机对照试验[J]. 中国针灸, 2023, 43(4): 417-421. |
| [13] |
RONG P, LIU J, WANG L, et al. Effect of transcutaneous auricular vagus nerve stimulation on major depressive disorder: a nonrandomized controlled pilot study[J]. J Affect Disord, 2016, 195: 172-179. DOI:10.1016/j.jad.2016.02.031 |
| [14] |
李小娇, 许可, 方继良, 等. 耳甲部电针治疗药物难治性抑郁症疗效观察及其静息态fMRI脑机制初探[J]. 磁共振成像, 2020, 11(2): 84-88. |
| [15] |
BORA E, HARRISON B J, DAVEY C G, et al. Meta-analysis of volumetric abnormalities in cortico-striatal-pallidal-thalamic circuits in major depressive disorder[J]. Psychol Med, 2012, 42(4): 671-681. DOI:10.1017/S0033291711001668 |
| [16] |
LAN M J, RIZK M M, PANTAZATOS S P, et al. Resting-state amplitude of low-frequency fluctuation is associated with suicidal ideation[J]. Depress Anxiety, 2019, 36(5): 433-441. DOI:10.1002/da.22888 |
| [17] |
YAMAMURA T, OKAMOTO Y, OKADA G, et al. Association of thalamic hyperactivity with treatment-resistant depression and poor response in early treatment for major depression: a resting-state fMRI study using fractional amplitude of low-frequency fluctuations[J]. Transl Psychiatry, 2016, 6(3): 754. DOI:10.1038/tp.2016.18 |
| [18] |
WU F, LU Q, KONG Y, ZHANG Z. A comprehensive overview of the role of visual cortex malfunction in depressive disorders: opportunities and challenges[J]. Neurosci Bull, 2023, 39(9): 1426-1438. DOI:10.1007/s12264-023-01052-7 |
| [19] |
GUO W B, LIU F, XUE Z M, et al. Alterations of the amplitude of low-frequency fluctuations in treatment-resistant and treatment-response depression: a resting-state fMRI study[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2012, 37(1): 153-160. DOI:10.1016/j.pnpbp.2012.01.011 |
| [20] |
DING Y D, YANG R, YAN C G, et al. Disrupted hemispheric connectivity specialization in patients with major depressive disorder: evidence from the REST-meta-MDD Project[J]. J Affect Disord, 2021, 284: 217-228. DOI:10.1016/j.jad.2021.02.030 |
| [21] |
孙继飞, 何家恺, 陈丽梅, 等. 耳甲电针治疗复发性抑郁症即刻脑效应的fMRI初步研究[J]. 中国中西医结合影像学杂志, 2022, 20(1): 11-15. |
| [22] |
WILLIAMS R J, BROWN E C, CLARK D L, et al. Early post-treatment blood oxygenation level-dependent responses to emotion processing associated with clinical response to pharmacological treatment in major depressive disorder[J]. Brain Behav, 2021, 11(8): 2287. DOI:10.1002/brb3.2287 |
| [23] |
GORDON E M, CHAUVIN R J, VAN A N, et al. A somato-cognitive action network alternates with effector regions in motor cortex[J]. Nature, 2023, 617(7960): 351-359. DOI:10.1038/s41586-023-05964-2 |
| [24] |
KROPF E, SYAN S K, MINUZZI L, et al. From anatomy to function: the role of the somatosensory cortex in emotional regulation[J]. Braz J Psychiatry, 2019, 41(3): 261-269. DOI:10.1590/1516-4446-2018-0183 |
| [25] |
LIU P, TU H, ZHANG A, et al. Brain functional alterations in MDD patients with somatic symptoms: a resting-state fMRI study[J]. J Affect Disord, 2021, 295: 788-796. DOI:10.1016/j.jad.2021.08.143 |
| [26] |
UDDIN L Q, NOMI J S, HÉBERT-SEROPIAN B, et al. Structure and Function of the Human Insula[J]. J Clin Neurophysiol, 2017, 34(4): 300-306. DOI:10.1097/WNP.0000000000000377 |
| [27] |
FAN Y, DUNCAN N W, DE GRECK M, et al. Is there a core neural network in empathy? An fMRI based quantitative meta-analysis[J]. Neurosci Biobehav Rev, 2011, 35(3): 903-911. DOI:10.1016/j.neubiorev.2010.10.009 |
| [28] |
SPRENGELMEYER R, STEELE J D, MWANGI B, et al. The insular cortex and the neuroanatomy of major depression[J]. J Affect Disord, 2011, 133(1-2): 120-127. DOI:10.1016/j.jad.2011.04.004 |
| [29] |
RUDEBECK P H, RICH E L. Orbitofrontal cortex[J]. Curr Biol, 2018, 28(18): 1083-1088. DOI:10.1016/j.cub.2018.07.018 |
| [30] |
ROLLS E T. The orbitofrontal cortex and emotion in health and disease, including depression[J]. Neuropsychologia, 2019, 128: 14-43. DOI:10.1016/j.neuropsychologia.2017.09.021 |
| [31] |
VANDERMEER M R J, LIU P, MOHAMED ALI O, et al. Orbitofrontal cortex grey matter volume is related to children's depressive symptoms[J]. Neuroimage Clin, 2020, 28: 102395. DOI:10.1016/j.nicl.2020.102395 |
| [32] |
CHEN M H, CHANG W C, TU P C, et al. Association of cognitive impairment and reduced cortical thickness in prefrontal cortex and anterior cingulate cortex with treatment-resistant depression[J]. Brain Imaging Behav, 2022, 16(4): 1854-1862. DOI:10.1007/s11682-021-00613-6 |
| [33] |
HAN S, LI X X, WEI S, et al. Orbitofrontal cortex-hippocampus potentiation mediates relief for depression: a randomized double-blind trial and TMS-EEG study[J]. Cell Rep Med, 2023, 4(6): 101060. DOI:10.1016/j.xcrm.2023.101060 |
| [34] |
GUO W B, LIU F, XUE Z M, et al. Abnormal neural activities in first-episode, treatment-naive, short-illness-duration, and treatment-response patients with major depressive disorder: a resting-state fMRI study[J]. J Affect Disord, 2011, 135(1-3): 326-331. DOI:10.1016/j.jad.2011.06.048 |
| [35] |
GUO W B, SUN X L, LIU L, et al. Disrupted regional homogeneity in treatment-resistant depression: a resting-state fMRI study[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2011, 35(5): 1297-1302. DOI:10.1016/j.pnpbp.2011.02.006 |
 2024, Vol. 22
2024, Vol. 22


