| 冷循环微波消融术治疗肺恶性肿瘤的临床疗效分析 |
2. 淄博矿业集团有限责任公司中心医院胸外科,山东 淄博 255120;
3. 淄博矿业集团有限责任公司中心医院消化科,山东 淄博 255120
肺癌是我国死亡率最高的恶性肿瘤[1],且发病率逐年上升,手术是目前公认的最佳治疗方法,但受众多因素影响,80%的患者确诊时已错失手术机会,而单纯放化疗治疗效果并不理想。近年来,影像引导下的微波消融治疗迅速发展,微波治疗器械及技术不断改良升级,特别是新式冷循环微波消融的应用,可通过消融针上的水气循环系统,降低针杆温度,使皮肤及穿刺消融周围组织不被灼伤,且可长时间传输较大功率,在保持微波治疗肿瘤优点的同时,解决了传统微波存在的问题,治疗效果得到明显提升,并发症亦得到有效控制。本研究回顾性分析我院2014年6月至2015年9月24例行经皮穿刺微波消融治疗的肺恶性肿瘤的治疗过程及疗效,对该项技术的具体操作及并发症预防进行探讨,以期进一步提高其治疗效果,降低并发症,提高患者生存质量。
1 资料与方法 1.1 一般资料24例中,男16例,女8例;年龄40~82岁,平均(58±0.63)岁。原发性肺癌20例(腺癌17例,鳞癌3例),转移瘤4例(肝癌肺转移3例,乳腺癌肺转移1例),共消融瘤体29个,均为周围型,左肺13个,右肺16个。瘤体直径1.5~5.5 cm,平均(2.60±0.41)cm,其中≥3 cm 4个,< 3 cm 25个。17例在消融同期实施化疗,2例实施放疗。
1.2 仪器与方法 1.2.1 仪器采用南京启亚医疗公司生产的MTC-3型冷循环微波治疗仪,2 450 MHz发射频率,输出功率0~100 W连续可调,微波电极外径为15 G;Siemens炫速Ⅱ代双源CT,Siemens TBA-664彩色多普勒超声诊断仪。患者取仰卧位或俯卧位,将CT定位坐标尺固定于肿瘤所在区域体表上。CT扫描后,在病变最大层面选择距肿瘤靶点最近处穿刺,注意避开大血管与气管,测定进针点与肿瘤靶点连线的距离、角度。2%利多卡因局部麻醉后,于皮肤表面切一约3 mm长度切口至皮下组织,在CT引导下将微波针插入肿瘤,针尖超出肿瘤远端0.5~1 cm,准确确认位置后,接通水冷循环系统,根据肿瘤形态、大小,设置功率40~85 W,时间5~15 min,消融操作时应保持微波针位置固定,防止因针位置改变影响消融效果。微波消融范围要求覆盖到肿瘤外缘5~10 mm。根据瘤体消融及邻近器官情况,随时调整功率及治疗时间。肿瘤 > 3 cm时,需多点多针进行消融,但消融局部控制率较差,易复发,应提前合理设计三维热场空间分布,在不伤及重要脏器情况下,达到对病灶的最大灭活。穿刺及消融过程中,患者全程进行心电、脉搏、血氧饱和度监护。
消融结束后,再次行CT扫描,观察瘤体及周围组织变化情况,确认周围正常肺组织发生磨玻璃样密度改变厚度 > 5 mm,同时观察有无出血、气胸(图 1)。术后嘱患者屏气,缓慢拔出微波针,同时辅助微波烧灼凝固针道,在止血的同时防止癌细胞延针道播散,后消毒,包扎伤口。
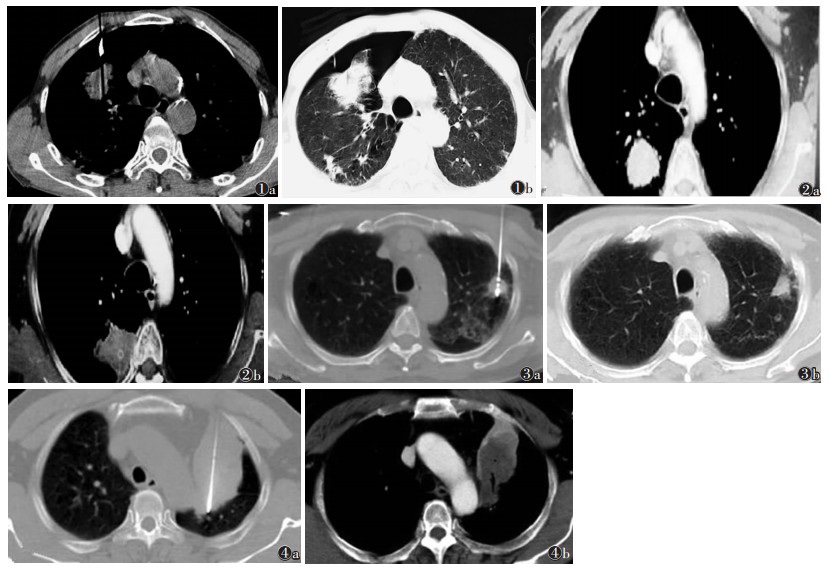 |
| 图 1 男,72岁,穿刺中出现气胸,肺压缩比例 > 20% 图 2 女,65岁 图 2a 右肺肿瘤消融术前CT表现 图 2b 术后6个月复查,病灶稳定,体积无增大,周边无强化 图 3 男,58岁 图 3a 左肺肿瘤消融术 图 3b 术后6个月复查,病灶部分缓解,较前缩小,周围纤维化 图 4 男,60岁 图 4a 左肺肿瘤消融术 图 4b 术后6个月复查,病灶进展、周边出现强化 |
1.2.2 方法
① 术前准备:提前向患者及家属详述消融术中注意事项及可能出现的并发症,训练患者呼气末闭气,并签署知情同意书,检查血常规、肝肾功能及凝血功能、心电图。参考CT、超声资料提前制订治疗计划,包括进针部位、方向、路径、深度、次数及点位,根据肿瘤大小及病灶周围组织情况初步选择微波治疗功率及时间。肺部感染患者,应给予抗生素、止咳等药物治疗,炎症有效控制3 d后进行,高血压患者应在血压控制平稳后进行。术前12 h禁食,术前30 min肌内注射吗啡10 mg、地西泮10 mg,口服可待因10 mg,以止咳、止痛。
1.3 术后处理术后常规应用3 d抗生素抗感染,服用奥美拉唑、铝碳酸镁预防应激性溃疡。根据患者个体情况酌情使用解热镇痛药及止血药。肿瘤直径 > 3 cm的患者消融术后,须多饮水,必要时静脉补液,防止肿瘤坏死导致的有毒物质沉积。所有患者消融术后3 d内行CT增强扫描复查,观察瘤体坏死情况、周围组织及并发症情况。并在术后第1、3、6个月行CT增强扫描复查判定肿瘤治疗效果。
1.4 疗效评价标准本研究采用改良的实体瘤疗效评价标准(RECIST)1.1版评价疗效,分为4级:完全缓解(CR)(图 2)、部分缓解(VR)(图 3)、疾病稳定(SD)和疾病进展(PD)(图 4)。总缓解率=(CR+VR)/总例数;临床获益率=(CR+VR+SD)/总例数。
2 结果24例均成功完成消融,术后72 h复查示瘤体内坏死,呈低密度改变。术后6个月复查有效缓解17例,总缓解率70.8%,总体获益20例,临床获益率83.3%。24例中术中出现不可耐受性疼痛8例;气胸9例(37.5%),其中2例大量气胸行胸腔插管闭式引流后痊愈,7例少量气胸未做特殊处理,3~7 d内自行吸收;胸腔积液7例(29.2%),咯血3例(12.5%),肺部感染1例(4.2%);消融后综合征9例,分别给予止血药物、抗生素、镇静止痛药等对症治疗后症状消失。
3 讨论 3.1 微波消融术治疗原理微波是一种正弦交流变化的高频电磁波,频率300~300 000 MHz,波长1 mm ~1 m,临床上常用2 450 MHz、12.25 cm波长[2]。微波可穿透除金属外的一切物体,止血效果好,加热快,能量集中,且加热程度、范围可控制[3]。
微波使极性分子随其频率摆动旋转、摩擦产生热量[4],从而使肿瘤细胞变性、坏死,产生新的溶酶体使其发生自溶。肿瘤细胞本身含水量高,升温较正常细胞快,两者温差常在5 ℃左右,且肿瘤细胞对热损伤敏感,多数细胞在43 ℃即可致死[5],而正常细胞安全温度界限为45 ℃。瘤体内血管走行紊乱,散热慢,更易被热损伤破坏,使肿瘤细胞在缺血坏死的同时,减少经血道转移的概率。
微波消融治疗在直接摧毁破坏瘤体的同时,可增加机体细胞免疫功能,原因为肿瘤坏死组织释放物质形成抗原,刺激机体免疫系统,形成自身抗体[6];同时肿瘤负荷减少,也使得机体功能得到恢复与提高。此外,微波治疗的热效应可使周围组织代谢增强,局部血液与淋巴循环增加,改善组织营养,加速组织再生与修复能力。
3.2 肺恶性肿瘤微波消融术疗效分析随着新一代冷循环微波消融针的开发应用,通过冷循环可使针杆温度 < 30 ℃,凝固范围大,活体单针消融范围可达4~5 cm,呈规则圆形,明显降低了术后复发率及转移率。肺癌的微波消融可分为根治性治疗与姑息性治疗,对分期T1-4N0M0的局限性肺癌,外科手术是疗效最肯定的首选治疗方式,但对失去手术时机或不愿手术患者,微波消融治疗仍是较好的治疗方式。文献[7-9]报道,直径 < 3 cm的肺部恶性肿瘤,微波根治治疗与外科手术的2年生存率无明显差异。对一些生物学特性显示预后较好的转移性肺肿瘤(如结直肠癌、乳腺癌、肾癌),如一侧病灶 < 3个,病灶最大直径 < 5 cm,则可考虑微波消融治疗。姑息性治疗的目的是最大程度减轻肿瘤负荷,减少机体负担,多应用于直径 > 5 cm的原发性肺癌,需多针多点消融。但多数 > 5 cm的肿瘤形态不规则,边缘与周围组织器官多有粘连,治疗后复发率较高,如何提高其消融疗效是一大难点。
3.3 肺癌微波消融术的禁忌证包括晚期患者卡氏评分(Karnovfsky performance status,KPS)评分 < 70分;有严重出血倾向,凝血系统功能紊乱者;病灶同侧伴大量胸腔积液,胸膜粘连及感染性或放射性肺炎不能很好控制者;肝、肾、心、肺、脑功能严重不全,严重营养不良、贫血,短期内无法纠正者;肿瘤距离肺门 < 1 cm,无安全有效穿刺通道者。以往无法手术的晚期肺癌患者,单纯行放化疗第1、2、3年的生存率分别为45%、25%、10%[10],而肺癌微波消融术后第1、2、3年的生存率分别为65%、35%、20%[11-12],如在消融基础上综合应用其他微创治疗与放化疗,可进一步提高其生存率。
3.4 影响消融术疗效的因素主要有肿瘤的数目、大小、部位、周围相邻器官情况、微波治疗功率及消融时间,医师的操作水平,穿刺部位、路线的设定和多点多针的布局。本组穿刺均选在患者呼气末屏气时进针,此时肺内残气量最少,可最大程度减少病变移位,避免重复穿刺,降低血气胸及肿瘤种植转移的概率。消融开始时保证消融针与肿瘤靶点误差 < 5 mm,消融过程中,如条件允许,可在超声实时监控下进行消融,根据肿瘤消融及周围组织情况随时调整治疗功率及时间。消融结束后,行CT扫描观察肿瘤周围肺组织磨玻璃样密度灶是否 > 5 mm,以确认消融治疗是否完全,术后分别在第1、3、6个月行CT增强扫描复查,观察疗效。文献[13-14]报道,肺癌消融术后6个月的总体缓解率约72%,总体收益率约80%,本研究分别为70.8%与83.3%,与文献报道相符。
3.5 肺癌微波消融术并发症少量气胸、胸腔积液、皮下气肿、胸痛、咯血多可自愈;大量气胸、胸腔积液、肺感染、消融后综合征等,相应对症处理后均可痊愈;肿瘤种植、非靶区热灼伤随着消融器械及技术的不断改进,已很少发生;其他少见并发症包括支气管胸膜瘘、空气栓塞,发生率低于2%[13]。气胸为最常见并发症,多因操作者手法不熟练,反复穿刺,损伤胸膜所致,其中消融针穿过肺组织长度 > 2.6 cm或直接穿过较大叶间裂也是其影响因素之一。本组2例出现大量气胸,行胸腔插管闭式引流后痊愈。3例咯血,考虑为穿刺中发生少量出血所致,给予止血对症处理后,症状消失;1例慢性支气管炎发生肺部感染,抗生素对症治疗后炎症消退;消融后综合征主要表现为低热、恶心、呕吐、全身乏力,主要由坏死物质吸收及炎性分子释放引起。本组9例发生消融后综合征,经对症治疗后症状消失。本研究不足:例数偏少,随访时间短,多点多针消融的肿瘤结节数量少。
综上所述,冷循环微波消融术治疗肺恶性肿瘤操作简单,靶向性强,对正常组织损伤小,并发症少,已成为肺癌综合性治疗的一种重要方法。
| [1] |
Jabangeer S, Forde P, Soden D, et al. Review of current thermal ablation treatment for lung cancer and the potential of electroch-emotherapy as a means for treatment of lung tumours[J]. Cancer Treat Rev, 2013, 39: 862-871. DOI:10.1016/j.ctrv.2013.03.007 |
| [2] |
Belfiore G, Ronza F, Belfiore MP, et al. Patients survival in lung malignancies treated by microwave ablation:our experience on 56 patients[J]. Eur J Radiol, 2013, 82: 177-181. DOI:10.1016/j.ejrad.2012.08.024 |
| [3] |
叶欣, 范卫君. 热消融治疗原发性和转移性肺部肿瘤的专家共识(2014年版)[J]. 中国肺癌杂志, 2014, 17(4): 294-301. DOI:10.3779/j.issn.1009-3419.2014.04.01 |
| [4] |
仲楼, 丁怀银, 曹飞, 等. CT引导经皮穿刺微波消融治疗周围型肺癌27例临床分析[J]. 海南医学, 2015, 26(7): 988-991. |
| [5] |
关利君, 贾广志, 崔宇, 等. 肺部肿瘤CT引导下射频消融治疗及近期疗效分析[J]. 中华介入放射学电子杂志, 2013, 1(2): 114-118. |
| [6] |
Eckardt J, Licht PB. Thoracoscopic or open surgery for pulmonary metastaseetomy:an observer blinded study[J]. Ann Thorac Surg, 2014, 98: 466-470. DOI:10.1016/j.athoracsur.2014.04.063 |
| [7] |
Liu Y, Li S, Wan X, et al. Efficacy and safety of thermal ablati-on in patients with liver metastases[J]. Eur J Gastroenterol He-patol, 2013, 25: 442-446. DOI:10.1097/MEG.0b013e32835cb566 |
| [8] |
李慎江, 肖湘生, 范丽, 等. 周围型肺癌微波消融术后半年CT随访变化[J]. 临床放射学杂志, 2015, 34(11): 1753-1758. |
| [9] |
Singh S, Kalra MK, Ali Khawaja RD, et al. Radiation dose opti-mization and thoracic computed tomography[J]. Radiol Clin North Am, 2014, 52: 1-15. DOI:10.1016/j.rcl.2013.08.004 |
| [10] |
Meulepas JM, Ronckers CM, Smets AM, et al. Leukemia and brain tumors among children after radiation exposure from CT scans:design and methodological opportunities of the Dutch Pe-diatric CT Study[J]. Eur J Epidemiol, 2014, 29: 293-301. DOI:10.1007/s10654-014-9900-9 |
| [11] |
黄伟, 马幸生, 刘勇恩. 微波消融术在肺癌中的应用[J]. 中国胸心血管外科临床杂志, 2015, 22(3): 265-269. DOI:10.7507/1007-4848.20150071 |
| [12] |
宋泽, 李虹, 齐翰, 等. CT导向下微波消融治疗肝癌肺转移瘤的疗效[J]. 实用医学杂志, 2015, 31(1): 57-61. |
| [13] |
Baisi A, De Simone M, Raveglia F, et al. Thermal ablation in the treatment of lung cancer:present and future[J]. Eur J Car-diothorac Surg, 2013, 43: 683-686. DOI:10.1093/ejcts/ezs558 |
| [14] |
Ierardi AM, Floridi C, Fontana F, et al. Microwave ablation of liver metastases to overcome the limitations of radiofrequeney ablation[J]. Radiol Med, 2013, 118: 949-961. DOI:10.1007/s11547-013-0968-1 |
 2018, Vol. 16
2018, Vol. 16


