| 儿童胰母细胞瘤的超声诊断与病理分析 |
胰母细胞瘤(pancreatoblastoma,PBL)又称为儿童性胰腺癌,是极少见的胰腺恶性肿瘤,占全部胰腺肿瘤的0.5%[1]。临床对PBL的报道较少,本文对郑州儿童医院2010年1月至2018年5月收治的6例PBL患儿的超声及临床资料进行回顾性分析,报道如下。
1 资料与方法 1.1 一般资料6例中,男4例,女2例;年龄8个月~11岁,病程20 d~9个月,其中4例因上腹部触及包块就诊,2例因黄疸进行性加重就诊。4例均经活检或手术切除病理证实。
1.2 仪器与方法应用Hitachi-Vision Ascendus、Philips IU22超声诊断仪,探头频率3.5~5.0 MHz。患儿取仰卧位,对上腹部行横、纵、斜切面连续动态扫查,必要时饮水后检查,重点观察上腹部包块的位置、大小、形态、内部回声、血供情况,以及是否有邻近脏器与淋巴结转移。将标本经10%甲醛溶液固定、常规脱水、石蜡包埋、切片和HE染色,采用免疫组化法进行角蛋白(rcytokeratin,CK)、α1抗胰糜蛋白酶(α1 antitrypsin,AACT)、嗜铬素A(chromogranin A,CgA)、突触素(synaptophysin,Syn)、癌胚抗原(carcinogenic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)检测。
2 结果 2.1 超声检查胰头部2例,表现为胰头区域实性肿块,形态不规则,内部回声不均匀,可伴沙砾样或斑片状钙化,胆总管及肝内胆管均扩张(图 1a);肿瘤内部丰富血流信号(图 1b)。体尾部3例,表现为体尾部囊实混合回声肿块,以实性为主伴钙化及少许液化,肿块包绕主胰管致主胰管扩张,其中1例包绕腹主动脉,胃及部分结肠受侵犯。胰尾部1例,表现为中等回声的实性团块,内部回声欠均匀,血流信号较丰富,肿块侵犯左肾动、静脉,与左肾上腺及左肾粘连。
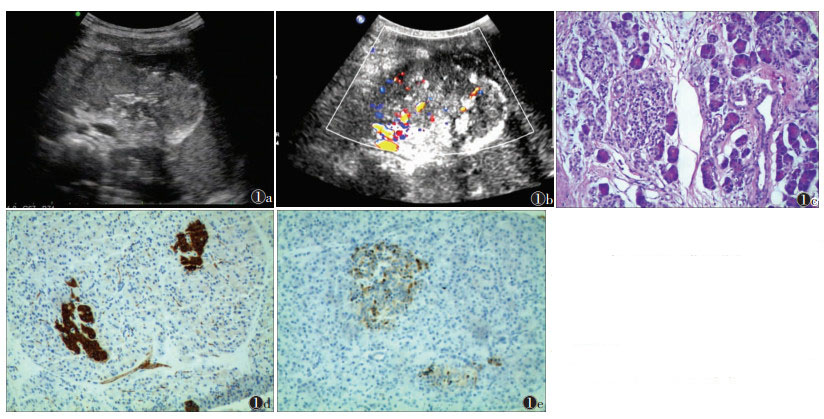 |
| 图 1 男,7岁 图 1a 超声示胰腺正常结构消失,胰腺位置见实性肿块,大小8.3 cm×6.2 cm,内部回声不均匀,可见点状及斑片状钙化 图 1b 彩色多普勒超声示肿块内可见较丰富血流信号 图 1c 镜下示较深染部分为肿瘤胰腺腺泡成分(HE×10) 图 1d 免疫组化显示突触素(+) 图 1e 免疫组化显示嗜铬素(+) |
2.2 病理结果
4例行包块穿刺活检,术中病理示瘤细胞由上皮和间叶成分组成,瘤细胞呈多角形或巢状排列,梭形细胞围绕成鳞状上皮小岛(图 1c);免疫组化:4例Syn(+)或(灶+)(图 1d),4例CK(+),3例AACT(+),3例导管分化的细胞表达CEA阳性,3例AFP(-),1例AFP(灶+),2例CD56(+)或(灶+)。2例行外科手术,术中发现肿瘤与周围组织黏连紧密,无法切除,仅切除淋巴结行病理检查,镜下检查:瘤细胞由多边形上皮细胞和间叶成分组成,瘤细胞呈条索状,无核分裂象。2例Syn(+)或(灶+),2例CK(+),1例AACT(+),1例CD56(+)。术后放弃化疗1例,正规化疗5例,随访3年,失访1例,死亡5例。
3 讨论PBL为罕见的胰腺恶性肿瘤,以儿童多见,发病年龄常小于10岁,发病中位年龄为5岁[2],成人亦可发病。PBL可发生于胰腺各个部位,有文献[3]报道2/3患儿发生于胰头部,且多为胰头腹侧,恶性程度高,具有恶性肿瘤局部浸润、转移和复发的特性,局部浸润多发生在腹膜、网膜、脾脏、肾上腺等邻近部位[4],可出现远处转移,常见的转移部位为肝脏、周围淋巴结、胰周邻近脏器等,亦可包绕肝静脉等血管[5],肺、脑、骨骼及纵隔淋巴结转移少见,本组1例侵犯胃及部分结肠,1例侵犯左肾动静脉。肿块位于胰头可压迫胆管造成肝内外胆管扩张出现黄疸,压迫胰管可出现腹痛、恶心、呕吐等症状,压迫十二指肠可引起上消化道梗阻。由于PBL临床罕见且缺乏特异性症状,多因腹部无痛性包块、黄疸就诊,易误诊为胰腺癌、畸胎瘤、肝癌、腹膜后肿瘤等,故术前诊断符合率较低。
PBL的超声表现:肿块可位于胰头、胰体或胰尾部,表现为胰腺区域的实性肿块,内部回声不均匀,可伴钙化和少许液化。肿块包绕胰管或压迫周围组织,造成胰管、肝内外胆管扩张,肿块较小时超声检查看见肿瘤来源于胰腺,残留少许正常胰腺组织,肿块较大时正常胰腺组织消失,部分可伴灶状出血或液化坏死,表现为不规则的液性暗区。位于体尾部的肿瘤可包绕腹主动脉或肾动脉,周围血管受压,静脉迂曲扩张,彩色多普勒超声示肿块内部可见较丰富血流信号。
PBL的病理表现:肿瘤多为边界清晰的实性肿块,有完整包膜,呈分叶状,质地柔软,肿瘤较大时正常胰腺结构消失,部分瘤体可伴出血或液化坏死。镜下:PBL的肿瘤细胞由上皮和间叶成分排列成实性的片状或巢状,混有分化良好的腺泡结构,并偶见扩张的导管。有鳞状小体和含有酶原颗粒的细胞结构[6],鳞状小体是PLB形态学特征之一,与周围细胞比较核更大,多为卵圆形,由于生物素堆积可见到透亮的核[7]。儿童PBL富含间质细胞,罕见异源性间质成分。PBL的免疫组化特点:由于瘤细胞由多源性胰腺细胞组成,表现为腺样分化、内分泌分化和腺管分化,超过2/3的患者上皮成分多表达CK和EMA,内分泌标记Syn、CgA、NSE等,有腺泡分化方向的细胞PAS和消化后,AAT、胰蛋白酶及脂肪酶等标记物可呈阳性。本组Syn和CK表达均呈阳性,4例AACT、3例CEA、3例CD56表达呈阳性,对胰母细胞瘤的诊断有重要的价值。
总之,PBL治疗首选外科手术,手术方式应根据肿瘤大小、位置及其与周围组织关系及转移情况选择,儿童预后较成人好,生存率为5~22年。由于本组均发现较晚且有周围组织转移,无法完整地切除肿瘤。术后随访除1例失访外,余5例均已死亡。因此早期发现和治疗,是提高预后治疗的关键。
| [1] |
Bien E, Godzinski J, Dall'igna P, et al. Pancreatoblastoma:a rep ort from the European cooperative study group for pediatric rare tumours (EXPeRT)[J]. Eur J Cancer, 2011, 47: 2347-2352. DOI:10.1016/j.ejca.2011.05.022 |
| [2] |
Gu WZ, Zou CC, Zhao ZY, et al. Childhood pancreatoblastoma:clinical features and immunohistochemistry analysis[J]. Cancer Lett, 2008, 264: 119-126. DOI:10.1016/j.canlet.2008.01.026 |
| [3] |
徐畅, 陈后平, 钟麟, 等. 儿童胰母细胞瘤诊治分析[J]. 临床小儿外科杂志, 2010, 9(2): 126-127. |
| [4] |
奚政君, 张忠德, 吴湘如, 等. 儿童胰母细胞瘤7例临床与病理分析[J]. 上海交通大学学报(医学版), 2008, 28(10): 1295-1297. DOI:10.3969/j.issn.1674-8115.2008.10.025 |
| [5] |
Klimstra DS. Nonductal neoplasms of the pancreas[J]. Mod Pa thol, 2007, 20: S94-S112. DOI:10.1038/modpathol.3800686 |
| [6] |
何巍, 王家祥, 杨合英, 等. 儿童胰母细胞瘤6例报道[J]. 河南医学研究, 2017, 26(3): 386-389. |
| [7] |
苏保宁, 阿尔巴拉特. 小儿胰母细胞瘤2例报告及文献复习[J]. 临床医学, 2010, 30(12): 42-43. |
 2019, Vol. 17
2019, Vol. 17


