| 基于胰腺CT的影像组学在预测糖耐量受损人群胰岛素抵抗中的应用价值 |
2. 新疆医科大学研究生院, 新疆 乌鲁木齐 830054
2. Graduate School, Xijiang Medical University, Urumqi 830054, China
糖尿病前期指的是从血糖失稳态过渡到糖尿病的高血糖代谢综合征[1],包括空腹血糖受损、葡萄糖耐量降低、空腹血糖受损合并葡萄糖耐量降低。目前认为,糖尿病前期的发病机制包括糖调节功能受损、胰岛素抵抗(insulin resistance,IR)和糖脂代谢紊乱等[2]。可通过干预IR改变糖尿病临床指标,在一定程度上降低2型糖尿病的发生率,预防并发症[3]。影像组学作为人工智能领域的新工具,在肿瘤诊疗中应用较多[4-5],而在评价糖尿病胰腺结构及功能方面应用较少,因此本研究基于CT平扫的影像组学特征构建预测模型来预测糖耐量受损人群的IR,为临床提供新思路。
1 资料与方法 1.1 一般资料回顾性分析2013年7月至2021年7月在新疆维吾尔自治区人民医院首次确诊的糖耐量受损患者381例,其中男214例,女167例;年龄16~86岁,平均(57.03±13.37)岁。
纳入标准:①通过相关实验室检查确诊为糖耐量受损者(空腹血糖 < 7.0 mmol/L,且75 g标准口服葡萄糖耐量试验后2 h血糖为7.8~11.0 mmol/L);②腹部CT平扫图像资料完整。排除标准:①CT图像质量差,影响诊断者;②合并其他慢性疾病或肿瘤者;③服用影响胰岛素敏感性药物者(如胰岛素制剂、噻唑烷二酮类、双胍类、磺脲类、DPP-4抑制剂、多靶点降糖药及降糖中药等[6])。
稳态模型胰岛素抵抗指数(HOMA-IR)是目前评估IR程度最常用的一种方法[7],计算公式:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5(校正因子)。取总样本IR的中位数(2.57)作为诊断标准[8],分为高IR组191例,低IR组190例;记录2组性别、年龄、身高、体质量、BMI、体表面积、心率、收缩压、舒张压、饮酒及吸烟史等基本信息。
381例按8∶2的比例随机分为训练集304例及测试集77例,其中训练集中低IR组145例,高IR组159例;测试集中低IR组45例,高IR组32例。体表面积计算公式:S男(m2)=0.005 7×身高(cm)+0.012 1×体质量(kg)+0.088 2;S女(m2)=0.007 3×身高(cm)+0.012 7×体质量(kg)-0.210 6。
1.2 仪器与方法使用GE Lightspeed 64层螺旋VCT或Siemens Somatom Flash双源CT机。扫描参数:120 kV,200~300 mAs,球管旋转速度0.5 s/r,螺距1.375∶1,准直64×0.6 mm,探测器宽度40 mm,视野36 cm×36 cm,矩阵512×512,层厚、层距均为5 mm。患者取平卧位,单次深屏气时行腹部CT扫描。扫描范围自膈肌上缘至髂前上棘或耻骨联合下缘。窗位、窗宽分别为50、250 HU。
1.3 ROI勾画及组学特征提取所有图像均为DICOM格式并导出为NII格式。图像经标准化及重采样处理后提取特征。由2位具有10年以上工作经验的放射科医师采用ITK-SNAP软件(http://www.itksnap.org)对全胰腺行3D手工勾画(图 1),并提取特征。采用组内相关系数(intraclass correlation coefficient,ICC)评估2位医师勾画一致性,ICC≥0.75为一致性高[9]。通过使用Python v3.67中的PyRadiomics v3.0.1软件包从勾画的ROI中提取组学特征,包括一阶特征、形态学特征和纹理特征。
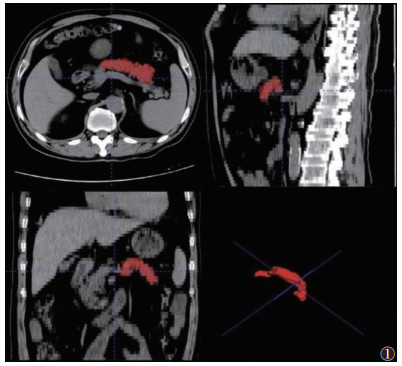 |
| 图 1 ITK-SNAP软件勾画出来的胰腺结构(红色区域) |
1.4 影像组学特征的筛选及模型的建立
在特征降维过程中使用Pearson相关系数、最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法,保留权重系数不为0的影像组学特征,并与其加权系数相乘构成影像组学评分,纳入组学模型的构建。共选取8种模型,分别为逻辑回归(LR)、朴素贝叶斯模型(NaiveBayes)、支持向量机(SVM)、邻近K(KNN)、随机森林(RF)、极度随机树(Extratrees)、自适应提升算法(AdaBoost)、多层感知机(MLP)。绘制ROC曲线,筛选出训练集AUC > 0.8的模型。构建相应的影像组学预测模型。通过独立的内部测试集验证预测模型的效果。
1.5 统计学方法使用Python(版本3.67)语言软件对数据信息统计学分析,因HOMA-IR不符合正态分布,取其自然对数并转化为正态分布数据后进行分析。符合正态分布的计量资料以x±s表示,组间比较行两独立样本t检验或Mann-Whitney U检验。使用scikit-learnv1.0.2软件包进行特征降维和模型构建。采用ROC曲线、校准曲线评价不同模型的预测效能,并计算敏感度、特异度。采用DeLong检验分别对训练集和测试集中4种模型的AUC进行比较。以P < 0.05为差异有统计学意义。
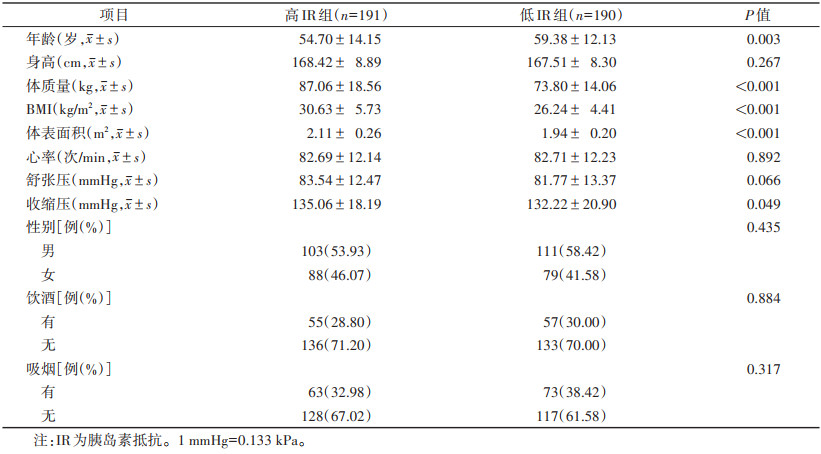
2 结果 2.1 高、低IR组的临床资料2组的年龄、体质量、BMI、体表面积、收缩压差异均有统计学意义(均P < 0.05)。2组性别、身高、心率、舒张压、有无吸烟及饮酒史等方面差异均无统计学意义(均P > 0.05)。
| 表 1 高、低IR组的临床资料比较 |
 |
2.2 一致性评价及CT影像组学特征筛选
2位观察者间ICC为0.786~0.928,一致性高。共提取1 834个组学特征,通过t检验或Mann-Whitney U检验及Pearson相关系数分析数据维度,筛选出189个特征,使用LASSO算法和5折交叉验证进一步筛选,根据最优λ值0.022 2,最终获得23个主要特征(图 2)。
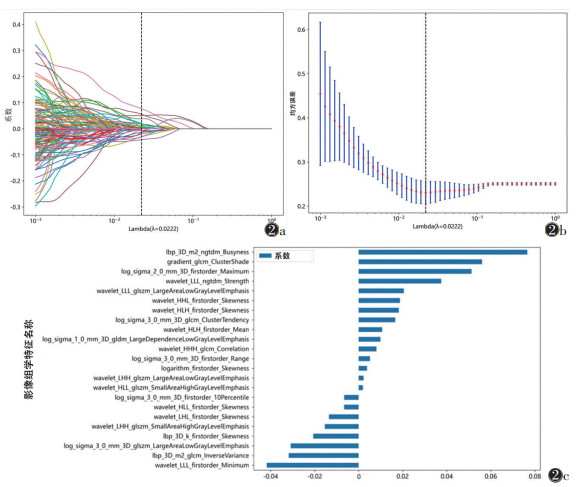 |
| 注:图2a中曲线表达个自变量系数的变化,垂线对应于图2b的最优λ值;图2b为最小绝对收缩和选择算子(LASSO)算法及5折交叉验证筛选出的特征,虚线代表均方误差最小时的λ值;图2c为特征权重条形图 图 2 影像组学特征筛选流程 |
2.3 建立与比较预测模型
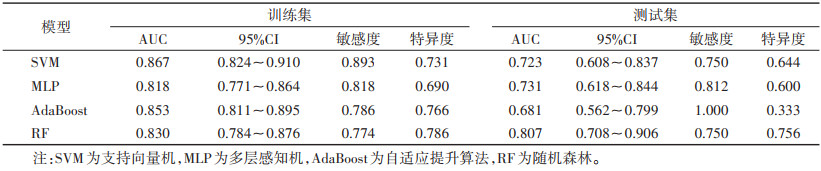
8种模型中最终筛选出4种模型, 分别为SVM、RF、AdaBoost、MLP模型。在训练集中SVM的AUC优于MLP(P < 0.05),其他模型两两比较,差异均无统计学意义(均P > 0.05)。测试集中仅RF模型AUC > 0.8,明显优于其他3个模型,差异均有统计学意义(均P < 0.05);RF模型在训练集与测试集中均有较好的预测效能(图 3,4)。
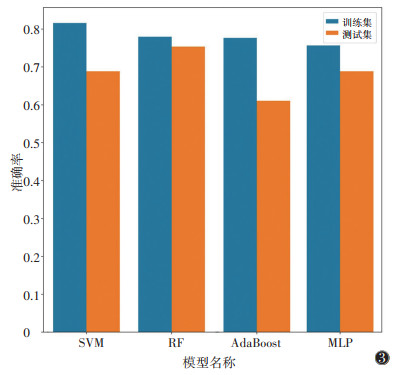 |
| 注:4种机器学习模型分别为支持向量机(SVM)、随机森林(RF)、自适应提升算法(AdaBoost)和多层感知机(MLP) 图 3 4种机器学习模型的整体准确率柱状图 |
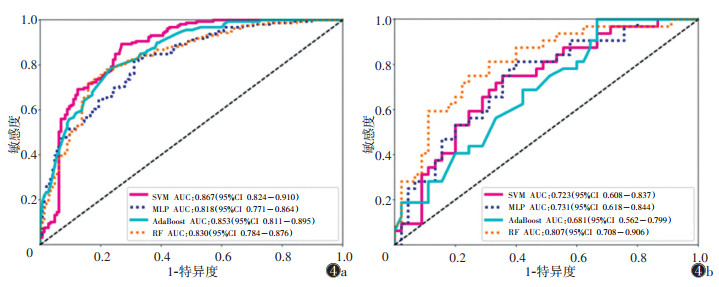 |
| 注:图4a为训练集,4种模型均有较高的AUC;图4b为测试集,RF模型具有较高的AUC。SVM为支持向量机,MLP为多层感知机,AdaBoost为自适应提升算法,RF为随机森林 图 4 训练集及测试集中4种模型对应的ROC曲线 |
| 表 2 4种机器学习模型预测效能比较 |
 |
3 讨论
2型糖尿病是以IR开始的一种慢性代谢性终身性疾病[10-11]。前期如出现IR,可导致胰岛细胞功能紊乱,进而引发葡萄糖耐量降低,病情持续发展,胰腺胰岛细胞功能衰竭,导致组织器官损伤,最终导致2型糖尿病的发生。因此,2型糖尿病前期胰腺功能诊断尤为重要。
目前,高胰岛素正糖钳夹技术是评价IR的金标准,但操作复杂,价格昂贵;IR及糖尿病的确诊主要依赖于空腹血糖、空腹葡萄糖耐量及糖化血红蛋白等实验室检测结果[12],不能满足大规模的筛查需求,且仅依赖血糖检测,不足以全面描述内分泌功能及其他特性。根据WHO建议,IR可定义为低于非糖尿病受试者胰岛素钳夹评估的葡萄糖利用率的最低四分位数(25th),或高于非糖尿病受试者HOMA-IR的最高四分位数(75th)[13]。然而,因种族、性别、研究对象等不同,且胰岛素测定尚未标准化,文献报道的切点值差别很大。本研究参照既往文献[14],以HOMA-IR中位数为界值,将患者分为高IR组和低IR组;并采用影像组学从图像中提取人眼难以察觉的高维度抽象纹理特征,进行量化分析,建立疾病分类和鉴别模型[15]。LU等[16]比较了胰腺、肝脏、腰大肌影像组学特征在早期糖尿病筛查和2型糖尿病风险预测中的效能,发现胰腺的预测模型在3年糖尿病发生率方面表现最佳,AUC、敏感度和特异度均 > 0.8,表明胰腺的影像组学模型在早期糖尿病筛查和糖尿病发病率预测方面性能较好;但ROI仅包含最大横截面,未覆盖胰腺整体实质。另一项研究使用KNN、SVM和LR模型对健康人群、糖耐量受损患者和2型糖尿病患者的胰腺CT图像进行鉴别;结果显示SVM和LR模型具有最佳预测效能;此外,2型糖尿病患者胰腺组织存在强度不均匀、外观比其他2组患者的胰腺外观更暗淡等现象。这些病理学变化可能与胰腺组织的纤维化有密切关系,且其能导致纹理模式的改变,表现为2型糖尿病患者较糖耐量受损患者和健康人群的胰腺纹理模式质地更粗,灰度强度水平更亮;因此,胰腺实质的纹理分析可间接反映胰腺功能状态,影像组学模型在鉴别糖尿病、糖耐量受损患者和健康人群的胰腺功能中具有较好的价值[17],但其未对糖耐量受损患者IR水平评估进行研究。本研究中RF模型在糖耐量受损者的IR程度预测方面效能较好。RF模型包含多个决策树分类器,通过引入随机性,避免过拟合,对缺失数据不敏感[15]。
肥胖可增加IR发生的风险,导致机体糖耐量异常,因此肥胖在2型糖尿病发生发展中起促进作用[18]。2型糖尿病患者IR与BMI呈正相关[19]。BMI≥28 kg/m2表示肥胖。本研究中体质量和BMI均与IR相关。但目前还无法证明IR与肥胖之间的相关性。适量饮酒能防治/改善IR、降低IR相关性疾病的发生率,但具体机制尚未完全清楚[20]。文献报道,IR程度与血压升高程度相关,空腹血糖受损伴高血压患者与血压正常的空腹血糖受损患者相比,降压治疗后,IR仍出现的更早,且糖化血红蛋白水平升高,更易进展为2型糖尿病。说明血压越高,IR越严重,胰岛素敏感性越低。另外,空腹血糖受损伴高血压患者可能存在血脂异常、BMI水平变化等其他因素,这些因素也可能共同影响IR的程度[21]。因此,IR与血压的相关性需进一步探讨。有学者对不同糖耐量受损程度的受试者进行了分析,以确定在糖代谢中是否存在性别和年龄差异;研究发现,将50岁作为更年期/雄激素状态的阈值,对糖代谢异常受试者或2型糖尿病患者,与健康人比较后发现,糖代谢异常受试者的IR并未显示出随年龄变化的相关性,而早期胰岛素释放却有所增加,且女性的这种变化更显著;而2型糖尿病男性患者则表现出与年龄相关的糖代谢恶化现象[22]。但现有数据,无法确定IR与性别之间是否存在相关性。
本研究的局限性:①为单中心回顾性分析,样本量相对小,可能导致模型过拟合,需增加例数以减少样本选择偏差,此外,本研究缺少外部验证组,模型的真实效能有待进一步证实;②以CT平扫图像进行勾画,胰腺边缘模糊,与周边的其他组织及血管分界不清,可能导致误差,特别是对胰腺萎缩明显的患者,会降低精确度;③未严格限制入组人群的血压、血脂用药情况,可能对结果造成干扰;④仅对IR高低状态进行了研究,缺乏与正常人群及糖尿病患者的对比研究,后期可进一步增加相关人群的研究;⑤未对临床指标进行联合模型的构建分析,有待进一步探讨。
综上所述,本研究初步表明4种机器学习模型在预测糖耐量受损人群IR程度方面应用前景良好,其中RF模型预测效能最高,有助于临床对糖尿病前期人群进行有效地诊断和管理。但模型的临床应用价值及稳定性需进一步探索改进,以期获得更好的结果。
| [1] |
吴元虹, 王晓辉, 许惠靖, 等. 糖尿病患者心理性胰岛素抵抗的概念分析[J]. 中华护理教育, 2023, 20(8): 986-990. DOI:10.3761/j.issn.1672-9234.2023.08.016 |
| [2] |
石康乐, 刘晓玉, 胡影, 等. 试用临界慢化原理探讨常见未病状态——血糖失稳态[J]. 北京中医药大学学报, 2023, 46(8): 1037-1047. DOI:10.3969/j.issn.1006-2157.2023.08.001 |
| [3] |
李丽, 毛拥军, 胡松, 等. 糖尿病前期人群管理的循证医学证据总结[J]. 中国临床研究, 2022, 35(7): 943-947. |
| [4] |
李晶晶, 黎玉莹, 石海峰, 等. 影像组学分析在胰腺癌诊疗中的应用及研究进展[J]. 磁共振成像, 2022, 13(8): 150-153. |
| [5] |
邓展昊, 左立平, 张玉婷, 等. 影像组学在胰腺癌诊断及评估中的应用进展[J]. 中国中西医结合影像学杂志, 2022, 20(2): 188-190, 194. DOI:10.3969/j.issn.1672-0512.2022.02.020 |
| [6] |
涂珺, 许文华. 糖尿病临床分型及治疗药物的研究进展[J]. 中药新药与临床药理, 2022, 33(4): 557-564. |
| [7] |
BASSEL M, ANDREAS S, THOMAS K, et al. Distribution of HOMA-IR in a population-based cohort and proposal for reference intervals[J]. Clin Chem Lab Med, 2021, 59(11): 1844-1851. DOI:10.1515/cclm-2021-0643 |
| [8] |
中华医学会糖尿病学分会胰岛素抵抗学组(筹). 胰岛素抵抗评估方法和应用的专家指导意见[J]. 中华糖尿病杂志, 2018, 10(6): 377-385. DOI:10.3760/cma.j.issn.1674-5809.2018.06.001 |
| [9] |
宋泽. 磁共振T2WI联合ADC图的机器学习模型预测前列腺癌骨转移的研究[D]. 兰州: 甘肃中医药大学, 2022.
|
| [10] |
萨出拉. 2型糖尿病的蒙医辩证分型与胰岛素抵抗的相关性研究[D]. 通辽: 内蒙古民族大学, 2023.
|
| [11] |
Ogurtsova K, Guariguata L, Barengo N C, et al. IDF Diabetes Atlas: Global estimates of undiagnosed diabetes in adults for 2021[J]. Diabetes Res Clin Pract, 2022, 183: 109-118. |
| [12] |
赵维纲. 《中国老年2型糖尿病病防治临床(2022年版)》解读[J]. 协和医学杂志, 2022, 13(4): 574-580. |
| [13] |
ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J]. Diabet Med, 1998, 15(7): 539-553. DOI:10.1002/(SICI)1096-9136(199807)15:7<539::AID-DIA668>3.0.CO;2-S |
| [14] |
崔灿. 基于腹部CT影像组学对2型糖尿病人群的胰岛素抵抗状态价值研究[D]. 南京: 南京中医药大学, 2020.
|
| [15] |
鲁慧民, 薛涵, 王奕龙, 等. 机器学习在影像组学分析中的应用综述[J]. 计算机工程与应用, 2023, 59(17): 22-34. |
| [16] |
LU C Q, WANG Y C, MENG X P, et al. Diabetes risk assessment with imaging: a radiomics study of abdominal CT[J]. Eur Radiol, 2019, 29(5): 2233-2242. DOI:10.1007/s00330-018-5865-5 |
| [17] |
苏丽平, 陈杭, 唐苏丹, 等. 基于CT图像影像组学模型在糖尿病患者胰腺功能分析中的应用[J]. 中国医学影像学杂志, 2022, 30(1): 60-65, 71. |
| [18] |
QIANG Z, NAISHI L, XIONGFEI P, et al. Clinical management and treatment of obesity in China[J]. Lancet Diabetes Endocrinol, 2021, 9(6): 393-405. DOI:10.1016/S2213-8587(21)00047-4 |
| [19] |
萧丽军, 缪珩, 吴小梅, 等. 2型糖尿病患者胰岛素抵抗与体表测量指数的相关性分析[J]. 现代医学, 2012, 40(5): 541-545. |
| [20] |
李小平, 陈敏. 慢性饮酒与胰岛素抵抗的相关性研究进展[J]. 医学综述, 2016, 22(15): 2957-2960. |
| [21] |
郎博. 空腹血糖受损患者胰岛素抵抗与血压的相关性研究[D]. 重庆: 中国人民解放军陆军军医大学, 2021.
|
| [22] |
TURA A, PACINI G, MORO E, et al. Sex- and age-related differences of metabolic parameters in impaired glucose metabolism and type 2 diabetes compared to normal glucose tolerance[J]. Diabetes Res Clin Pract, 2018, 146: 67-75. |
 2024, Vol. 22
2024, Vol. 22


