| 骨化性肌炎的多模态影像学表现 |
骨化性肌炎又称异位骨化,是指正常软组织内出现异常骨化组织,是一种良性、自限性的非肿瘤性病变。骨化性肌炎随病程演变,病理组织成分也发生相应变化,增加了影像学确诊的难度[1]。目前常用的影像学检查方法有X线、CT、MRI及SPECT/CT等,可从疾病的形态结构及功能改变来诊断疾病,各有优缺点[2-4]。本研究旨在分析各期骨化性肌炎的X线、CT、MRI、SPECT/CT特征表现,探讨多模态影像学对该病的诊断价值。
1 资料与方法 1.1 一般资料收集2017年1月至2019年6月我院确诊的骨化性肌炎患者56例,男24例,女32例;年龄15~67岁,平均(38.0±3.2)岁;15例经病理证实,41例经6个月以上的影像学随访证实。41例有明确外伤史或手术史,15例无明显外伤史。56例均表现为局部可触摸的肿块,可伴疼痛或功能障碍,病程2周至8年。
1.2 仪器与方法56例均行X线检查,其中43例行CT检查,29例行MRI检查,19例行SPECT/CT检查。X线检查采用Siemens DR系统或锐科公司生产的DR系统摄病灶正侧位片。CT检查采用Siemens 64排螺旋CT扫描仪,扫描参数:120 kV,145 mAs,准直器宽度1 mm,螺距1,重建层厚4.0 mm,重建层距3.0 mm,行横轴位扫描及矢状位、冠状位重建。MRI平扫采用Philips Ingenia 3.0 T MRI仪,常规扫描横轴位、冠状位、矢状位的SE T1WI和T2WI序列,脂肪抑制序列为T2WI STIR。SPECT/CT检查采用Siemens Symbia-T6成像系统,亚甲基二磷酸盐(MDP)由江苏省原子医学研究所江原制药厂提供,99Mo-99mTc发生器由北京原子高科股份有限公司提供,扫描前3~4 h静脉注射99mTc-MDP 740~1 110 Mbq,采集能峰140 keV,窗宽20%,采用随机软件进行图像融合。
1.3 影像学分析主要观察病灶部位、大小、边界、骨化部位及程度。将骨化性肌炎分为早、中、晚3期[5]。SPECT/CT主要观察显像剂摄取的部位及程度。
2 结果56例中,位于髋关节23例,肘关节18例,膝关节6例,大腿3例,踝关节及小腿各2例,手及肩关节各1例。
早期病变12例,X线、CT、MRI阳性率分别为25.0%(3/12)、75.0%(9/12)、100.0%(6/6)。X线或CT表现为软组织肿胀或肿块,其内未见明显骨化影,5例伴相邻骨骼的骨膜反应。MRI表现为软组织内边界不清楚的混杂信号,2例病灶呈类圆形,余4例呈梭形分布、沿肌肉走行;病灶以T1WI呈高或等信号,T2WI呈高信号为主,3例T1WI呈低信号,T2WI呈高信号(出血),周围软组织呈弥漫性水肿影。
中期病变23例,X线(23例)、CT(16例)、MRI(12例)及SPECT/CT(4例)阳性率均为100.0%。X线或CT表现为软组织肿块周边高密度骨化影,14例呈絮状、片状或点状(图 1,2a,3a),9例呈蛋壳样骨化,肿块中央密度较低(图 4)。MRI示肿块呈分层状改变,最外侧(外层)呈条带状T1WI高信号、T2WI低信号(骨化);中间区(中间层)T1WI呈等信号、T2WI呈高信号;中心区域(内层)T1WI、T2WI均呈高信号;肿块外围呈边界不清的T2WI和STIR脂肪抑制高信号(水肿)(图 2b,2c)。SPECT/CT表现为病灶整体显像剂摄取,病灶中央摄取程度高于周围(图 3b)。
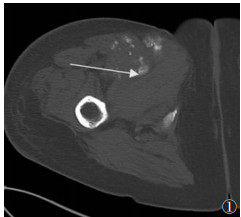 |
| 图 1 女,55岁,右侧大腿骨化性肌炎(中期)。CT横轴位扫描图像,显示右侧大腿前侧软组织内呈絮状、片状骨化,沿肿块周围分布(箭头) |
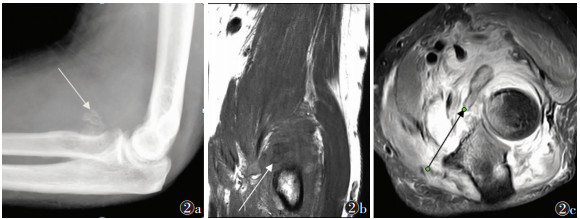 |
| 图 2 男,32岁,右侧肘关节骨化性肌炎(中期) 图 2a DR侧位图像,显示肘关节前侧环形骨化(箭头处) 图 2b,2c 分别为MRI T1WI冠状位、T2WI STIR横轴位图像示肘关节前侧软组织内双低信号影,呈环形分布(箭头),周围软组织弥漫性水肿信号影 |
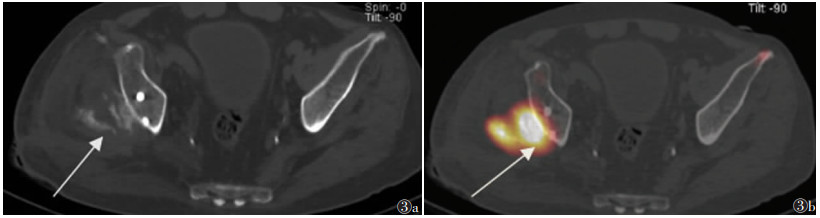 |
| 图 3 男,56岁,右侧髋关节骨化性肌炎(中期) 图 3a CT横轴位扫描图像,显示右侧髋臼后侧软组织内絮状、片状骨化影(箭头) 图 3b SPECT/CT横轴位融合图像,显示病灶区整体显像剂异常摄取,中央摄取程度高于周围(箭头) |
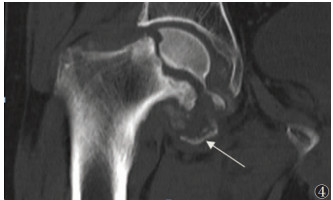 |
| 图 4 男,52岁,右髋关节骨化性肌炎(中期)。CT冠状位扫描图像,显示右侧髋关节内下缘软组织内呈弧形蛋壳样骨化(箭头),肿块中央密度较低 |
晚期病变21例,X线(21例)、CT(15例)、MRI(11例)及SPECT/CT(15例)阳性率均为100.0%。X线或CT表现为软组织内团状密度增高影,边界清晰,其中9例与相邻骨骼相连,与皮质分界不清,但髓腔不受累。MRI表现为肿块内广泛的T1WI高信号、T2WI低信号(骨化),9例病灶内含T1WI等信号、T2WI高信号、STIR低信号影(脂肪)(图 5)。SEPCT/CT显像15例,其中3例病灶中央及周围均未见显像剂摄取(图 6);6例病灶中央显像剂不均匀摄取(图 7);6例病灶周围显像剂不均匀摄取(图 8)。
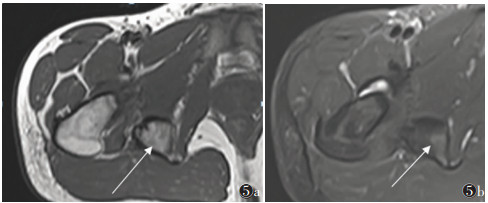 |
| 图 5 男,16岁,右侧髋关节骨化性肌炎(晚期) 图 5a,5b 分别为MRI T1WI横轴位、T2WI STIR横轴位图像,显示右侧髋关节后侧骨化肿块,其内含脂肪信号(箭头) |
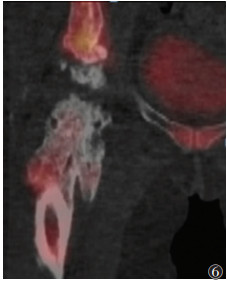 |
| 图 6 女,50岁,右髋关节骨化性肌炎(晚期)。SPECT/CT冠状位融合图像,显示右侧髋关节骨化性肌炎病灶中心及周缘均未见明显显像剂摄取 |
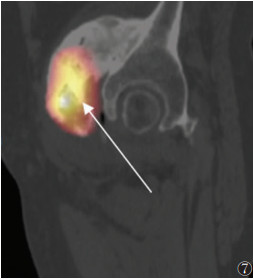 |
| 图 7 男,48岁,右髋关节骨化性肌炎(晚期)。SPECT/CT矢状位融合图像,显示右侧髋关节骨化性肌炎病灶中央显像剂异常摄取,周围未见明显摄取(箭头) |
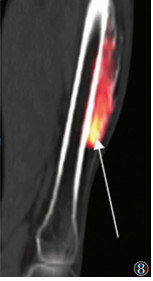 |
| 图 8 男,37岁,右侧股骨前缘骨化性肌炎(晚期)。SPECT/CT矢状位融合图像,显示右侧大腿前侧骨化性肌炎病灶末端显像剂异常摄取(箭头) |
3 讨论
骨化性肌炎为骨质结构沉积于肌肉、结缔组织内而引起正常软组织骨化的一种疾病,常发生于髋、肘及膝等大关节,其病因不明,一般认为创伤、手术、神经损伤和炎症等为诱发因素,这种损伤可很轻微。骨化性肌炎是肌肉或软组织损伤后常见的继发症,也是关节功能障碍的重要原因[1, 5]。
骨化性肌炎的骨化是一个渐近发展的过程,病程长短不一,可数周到数年,本研究患者病程2周至8年。该病的病理改变、临床症状及影像学表现基本同步,可大致分为3期[2, 6-8]。
3.1 早期外伤后3~4周,病理改变为细胞变性、出血、机化及结缔组织增生;临床表现为局部软组织肿块,伴疼痛及关节功能活动受限,可伴发热;影像表现为边界不清的局部软组织肿胀,无骨化,可伴相邻骨骼骨膜反应,此期影像学诊断相对困难,尤是DR或CT表现无明显特征,易漏诊或误诊。MRI表现为软组织内边界不清、信号混杂的肿块,可呈类圆形,但多呈梭形分布、沿肌肉走行,周围软组织内弥漫性水肿信号影,此时易与恶性肿瘤及炎性病变混淆,外伤手术等特殊病史及梭形肿块可为鉴别诊断提供参考依据。
3.2 中期外伤后5~8周,病理上出现骨化,从病灶外周向中央发展,呈蛋壳样表现,可呈典型的3层表现,但较少见;临床表现为发热、局部肿块及压痛;影像表现为肿块周围逐渐出现骨化。本研究中此期患者X线、CT、MRI及SPECT/CT显像均为阳性。有研究[9]显示蛋壳样骨化是其特征影像表现,但本研究仅39.1%(9/23)出现此特征。MRI可呈典型3层表现,外层为骨化层,中间为萎缩肌纤维层,内层为出血层。关于核医学在骨化性肌炎的应用报道,多为个案报道,且病例均为中期,病灶显像剂异常摄取[10-13]。本研究中期骨化性肌炎SPECT/CT表现为病灶整体显像剂摄取,病灶中央摄取程度高于周围,提示骨化性肌炎是一种渐进的成骨过程,且从周围向中央进展。
3.3 晚期外伤后5~6个月,肿块开始收缩,周围水肿减轻乃至消失,此期影像学诊断相对容易。X线或CT表现为边界清晰的团块状骨化,可与相邻骨骼相连,与皮质分界不清,但髓腔不受累;MRI表现为肿块内广泛的双低信号,其内可含脂肪信号。但本研究中晚期患者的SPECT/CT特征不一致,可表现为病灶完全无显像剂摄取或病灶中央显像剂高摄取而周围无摄取,也可能表现为中央无显像剂摄取而周围高摄取。提示骨化性肌炎的骨化可能是一个复杂的过程,具体机制有待进一步研究。
总之,骨化性肌炎病程不同,影像学特点也不同,早期缺乏影像学特征,诊断较困难;中期肿块蛋壳样骨化是其特征表现,SPECT/CT图像表现为病灶整体显像剂异常摄取;晚期软组织肿块完全骨化,诊断容易,但SPECT/CT图像融合可表现为不同形式的显像剂摄取;综合应用各种影像学检查方法可显著提高该病的诊断水平,提供更有参考价值的临床信息。
| [1] |
郭振业, 段王平, 卫小春. 骨化性肌炎的研究新进展[J]. 实用骨科杂志, 2013, 19(7): 629-632. DOI:10.3969/j.issn.1008-5572.2013.07.015 |
| [2] |
张斌青, 杨静, 郭会利, 等. 局限性骨化性肌炎45例影像学分析[J]. 实用放射学杂志, 2014, 30(8): 1348-1350, 1372. DOI:10.3969/j.issn.1002-1671.2014.08.026 |
| [3] |
BRUGGEN W V D, HIRSCHMANN M T, STROBEL K, et al. SPECT/CT in the postoperative painful knee[J]. Semin Nucl Med, 2018, 48(5): 439-453. DOI:10.1053/j.semnuclmed.2018.05.003 |
| [4] |
VANDER WYNGAERT T, PALLI S R, IMHOFF R J, et al. Cost-effectiveness of bone SPECT/CT in painful total knee arthroplasty[J]. J Nucl Med, 2018, 59(11): 1742-1750. DOI:10.2967/jnumed.117.205567 |
| [5] |
熊元, 陈明, 郑琼, 等. 直视复位结合经皮骶髂关节螺钉固定治疗难复性骶髂关节脱位[J]. 中华创伤骨科杂志, 2018, 20(3): 193-198. DOI:10.3760/cma.j.issn.1671-7600.2018.03.003 |
| [6] |
章建新, 谢伟, 吴向科, 等. 肘关节创伤性骨化性肌炎的中西医结合疗法[J]. 浙江医学教育, 2015, 14(3): 55-57. |
| [7] |
王国杰, 张作君, 张川, 等. 红外热成像技术在指导肘关节骨化性肌炎松解术后康复锻炼中的应用[J]. 中医正骨, 2018, 30(10): 49-53. DOI:10.3969/j.issn.1001-6015.2018.10.010 |
| [8] |
DEVILBISS Z, HESS M, HO G W K. Myositis ossificans in sport: a review[J]. Curr Sports Med Rep, 2018, 17(9): 290-295. DOI:10.1249/JSR.0000000000000515 |
| [9] |
顾翔, 白荣杰, 屈辉, 等. 骨化性肌炎的X线、CT及MRI表现[J]. 中华放射学杂志, 2009, 43(9): 982-985. DOI:10.3760/cma.j.issn.1005-1201.2009.09.021 |
| [10] |
GUPTA N, PRUTHI A, KUMAR S. Fibrodysplasia ossificans progressive-a rare genetic disorder and the role of technetium-99m methylene diphosphonate bone scan[J]. Indian J Nucl Med, 2019, 34(3): 209-212. DOI:10.4103/ijnm.IJNM_57_19 |
| [11] |
MAKIS W, LAMBERT R. Myositis ossificans mimics an osteoid osteoma: a pitfall for Tc-99m MDP planar and SPECT scintigraphy[J]. Clin Nucl Med, 2010, 35(3): 175-177. DOI:10.1097/RLU.0b013e3181cc6292 |
| [12] |
康满云, 欧阳林. 骨化性肌炎SPECT/CT骨显像一例[J]. 中华核医学与分子影像杂志, 2017, 37(11): 716-717. DOI:10.3760/cma.j.issn.2095-2848.2017.11.010 |
| [13] |
汪太松, 邢岩, 乔文礼, 等. 进行性骨化性纤维发育不良99Tcm-MDP SPECT/CT显像一例[J]. 中华核医学与分子影像杂志, 2019, 39(4): 231-232. |
 2021, Vol. 19
2021, Vol. 19


