| 胰腺转移癌的CT诊断 |
2. 温州医科大学附属慈溪医院放射科,浙江 宁波 3153003;
3. 复旦大学附属中山医院放射科,上海 200032
胰腺转移癌(pancreatic metastases,PM)临床罕见,仅占胰腺恶性肿瘤的3%[1],因发病率较低,且缺乏特异的临床症状及实验室检查指标,误诊率较高[2-3]。笔者收集2010年2月至2016年9月经上海金山区中西医结合医院、温州医科大学附属慈溪医院及复旦大学附属中山医院经手术或穿刺活检病理证实的11例PM的CT资料,探讨其CT表现及诊断价值。
1 资料与方法 1.1 一般资料11例中,男7例,女4例;年龄49~68岁,中位年龄62岁。原发肿瘤中肾脏透明细胞癌4例,肺癌3例,大肠癌2例,胃癌、乳腺癌各1例。转移时间0~10年,平均35.8个月,其中1例肾透明细胞癌最长,10年;1例肺癌同时发现PM。11例临床表现均无明显特异性,7例上腹隐痛不适,伴腹胀、食欲不振及消瘦,2例可扪及腹部包块,1例轻微黄疸及轻度肝功能损害,3例无明显相关症状,因原发癌定期复查时超声发现胰腺病灶。肿瘤标志物4例CEA升高(7.4~12.9 ng/mL),3例CA19-9轻度升高(69~107 kU/L),1例伴AFP轻度升高(46 μg/L)。11例中4例经手术病理确诊,7例经粗针穿刺病理证实。
1.2 仪器与方法采用GE Lightspeed 64排CT机或Siemens definition AS 64排CT机。扫描参数:120 kV,300 mA,层厚5 mm。所有患者均行全腹部平扫及3期增强扫描。增强扫描经肘静脉团注对比剂碘海醇(350 mgI/mL),剂量1.5 mL/kg体质量,流率3.5 mL/s。动脉期延迟25 s,胰腺期延迟45~50 s,延迟期180~240 s。
1.3 图像分析由3位高年资CT医师共同对图像进行分析,主要观察病灶的部位、数目、形态、大小、边界及平扫密度特点,动态增强扫描的强化特征、周边结构的改变,腹腔有无积液、肿大淋巴结及其他结构的改变、有无其他转移等。根据PM主体低于、接近或高于正常胰腺组织而分为低、等和高密度;强化程度低于正常胰腺为轻度强化,接近胰腺组织为中度强化,高于正常胰腺为明显强化;强化方式分为均匀强化、环状强化及不规则强化。
2 结果 2.1 病灶的数目、部位、形态及大小11例共发现15个病灶,其中8例1个病灶,2例2个病灶,1例3个病灶。位于胰头部6个,胰体、颈部7个,胰尾部2个。最大直径0.4~6.9 cm,< 1 cm 2个,1~5 cm 11个,>5 cm 2个,平均3.5 cm。12个呈较规则圆形或类圆形;3个较大者形态欠规则,呈浅分叶状。1个最大者位于胰尾部,主体突出胰腺轮廓并侵犯脾脏、脾门血管;14个肿瘤主体均位于胰腺内,其中5个局限于胰腺轮廓内部,9个不同程度突出胰腺轮廓。
2.2 CT平扫4个较小肿瘤为实性,平扫呈等密度,CT值48.6~57.5 HU,接近正常胰腺,与之分界欠清(图 1a,2a);11个呈不均匀低及较低混杂密度,CT值19.3~36.2 HU,肿瘤外周为较低密度,低于胰腺正常结构,分界欠清,内部见大小不等的密度更低区域(图 3a)。1例原发肿瘤为结肠黏液腺癌病灶见小斑点钙化。
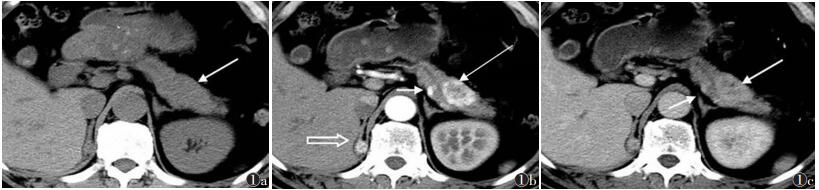 |
| 图 1 男,58岁,右肾透明细胞癌来源胰腺转移癌 图 1a CT平扫示胰体部稍膨大(箭),未见明显异常密度结节或肿块 图 1b 增强扫描动脉期见胰体部背侧点状转移灶明显均匀强化,呈高密度,边界清晰(短箭);胰体腹侧见不均匀明显强化的结节,外周明显,边界清晰(长箭),相应主胰管稍增宽;右侧肾上腺见明显环状强化转移灶(空箭) |
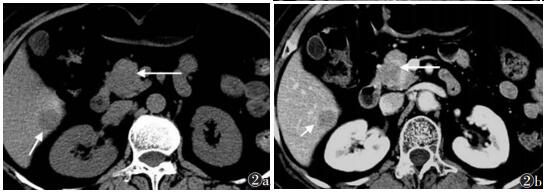 |
| 图 2 女,49岁,肺癌来源胰腺转移癌 图 2a CT平扫示胰头单发类圆形等密度结节,边界不清(长箭),肝脏右叶见类圆形低密度结节(短箭) 图 2b 增强扫描静脉期见胰头部结节不规则中度强化,周边见假包膜明显强化,边界较清晰(长箭),周边轮廓较规则,未见局限侵犯及浸润,肝脏转移灶呈环形强化(短箭) |
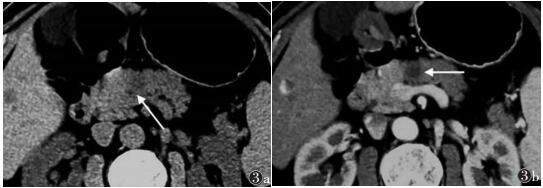 |
| 图 3 CT平扫示胰颈部单发类圆形稍低密度结节,轮廓欠规则而边界不清(箭) 图 3b 增强扫描动脉期见胰颈部结节轻度环状强化,较平扫边界清晰(箭),轮廓较规则,病灶周边未见局限侵犯,主胰管未见增宽,腹膜后结构较清晰 |
2.3 CT增强扫描
15个病灶增强扫描边界均较平扫清晰,2个直径 < 1 cm者较均匀强化(图 1b短箭);6个不规则强化,强化欠均匀(图 1b长箭),未见明显坏死区;7个呈不均匀环状强化(图 3b),内部见大小不等的囊变坏死区。9个边缘轮廓较光整,其中4个周边见假包膜延迟强化,轮廓较光滑锐利(图 2b);余6个边缘较毛糙。6个病灶明显强化,增强扫描各期均超过胰腺组织而呈“富血供”的高密度,以动脉期最明显,原发灶均为肾脏透明细胞癌,静脉期及延迟期强化减弱但仍稍高于胰腺组织(图 1c);2个动脉期、静脉期及延迟期不均匀中度强化,强化程度接近胰腺,分别来源于肺癌及乳腺癌;7个呈不均匀轻度强化,呈现“乏血供”,动脉期、静脉期及延迟期均弱于正常胰腺组织,以静脉期周边强化稍明显(图 4)。
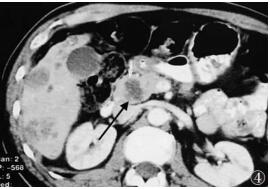 |
| 图 4 男,68岁,大肠癌来源胰腺转移癌,CT增强扫描静脉期见胰头部病灶不均匀环状强化,周边较明显(黑箭),轮廓欠规则,但未见明显局限侵犯及破坏,肝脏多发转移灶呈环状强化 |
2.4 继发征象
11例中1例胰头部肿瘤压迫胆总管导致上端胆总管轻度增宽(9~12 mm);2例分别位于胰头及胰体部的肿瘤出现主胰管轻度增宽(3~4 mm)。2例分别位于胰体、尾部的肿瘤见胰腺周边血管局限侵犯,以1例胰尾部巨大病灶明显,见脾门胰尾部血管局部包埋并直接侵犯脾脏;其余9例肿瘤周缘结构尤其腹膜后结构均较清晰,未见肿瘤的局部侵犯及浸润。7例合并胰腺外转移,包括肝脏(图 2,5)、肺、脾脏、肾上腺(图 1b)、脊椎、腹腔及腹膜后淋巴结(图 5)等。3例见腹腔少量积液。
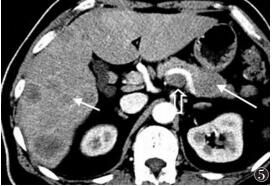 |
| 图 5 男,67岁,大肠癌来源胰腺转移癌,CT增强扫描动脉期胰体部病灶中度不均匀强化,周边稍明显(长箭),邻近胰周血管受压移位,腹膜后见肿大淋巴结(空箭),肝脏多发转移灶呈环状强化(短箭) |
3 讨论
PM原发肿瘤以消化道肿瘤居多[2-3],肾细胞癌、肺癌、乳腺癌及黑色素瘤也可发生[2, 4],也有文献[5]认为原发肿瘤以肾细胞癌最多。转移途径有淋巴转移、血行转移、直接侵犯和种植播散。既往该病少见,但随着医疗水平的提高,近年来其检出率有增加趋势[2, 6]。不同肿瘤的转移时间不同,多数PM的检出距原发肿瘤的检出间隔较长,文献[1]报道肾脏透明细胞癌转移至胰腺的最长转移时间达32.7年。本组1例转移时间达10年。该病临床表现一般无特异性,多表现为腹痛、腹泻、食欲减退、体质量减轻等,肿瘤累及胆总管时可见黄疸,部分无症状[2, 7]。本组3例无明显症状,因原发肿瘤定期复查时发现。
PM可发生于胰腺任何部位,胰头、颈、体、尾部无显著差异[8],本组以胰头部最多(6/15,40.0%),可能与样本较小有关。文献[6-8]报道肿瘤以单发结节最常见,占50%~73%,其次为多发结节,弥漫性病变少见。本组11例共发现15个转移灶,8例单发,占72.7%,2例2个病灶,仅1例见3个病灶,未见弥漫性病变,与文献相符。CEA、CA125及CA19-9部分患者可升高,但无特异性[3-4],因该病相对罕见,临床易误诊。
PM多表现为胰腺较规则的圆形或类圆形较低密度结节或肿块,CT平扫一般边界欠清晰且密度不均匀,内部发生囊变、坏死时,可表现为较外周更低的密度区域[8]。少数肿瘤可见斑点钙化灶,可能与原发肿瘤的病理类型有关。增强扫描强化程度及方式不一,可明显强化、轻度或中度强化,主要与原发肿瘤类型及血供有关,多数呈环形强化,类似肝脏转移瘤的“牛眼征”,也可见不规则强化及较均匀一致强化但相对少见[1, 7]。增强扫描边界较平扫清楚,部分轮廓较光整,与周围正常胰腺组织分界清晰锐利,并可见假包膜,轮廓不光整者与正常胰腺分界也较平扫清楚。
本组1例胰头部肿瘤出现相邻胆总管侵犯导致上端胆总管轻度增宽,2例分别位于胰头及胰体部肿瘤出现病灶上游主胰管轻度增宽,余均未见胆胰管梗阻增宽征象;15个均未见肿瘤上游胰腺组织明显萎缩,与胰腺导管癌不同,后者即使较小也可导致胰胆管梗阻及上游胰腺萎缩。此外,本组转移瘤周边结构侵犯少见,15个中仅2个出现胰腺外局限侵犯并包绕血管,周边脂肪间隙均较清晰,而胰腺导管癌由于具有围管性浸润及噬神经生长的特性,较小肿瘤即可出现腹膜后血管、神经等结构的侵犯导致结构不清[9]。上述PM的表现可能与其恶性程度相对较低及肿瘤体积较小有关,但本组样本较小,需扩大样本进一步研究。另外,因PM原发肿瘤的病程一般较长,多数患者可见胰腺外的转移灶[2, 7-8]。本组7例合并胰腺外转移。
综上所述,PM虽罕见,但其CT表现具有一定特征性,平扫多表现为边界不清的胰腺单或多发的较低密度结节或肿块,内部可见更低密度的囊变坏死区,增强扫描边界变清晰,强化方式多样,类似于原发灶,以不均匀的环状强化多见,肿瘤周边结构相对较清晰,而胰、胆管梗阻及病灶局限侵犯少见,结合有原发恶性肿瘤病史,应考虑到PM可能;如合并胰腺外转移灶及CA19-9升高不明显,更应倾向于PM的诊断。
| [1] |
马玉腾, 陈玉国, 刘书含, 等. 胰腺多发转移性肾透明细胞癌1例报告[J]. 临床肝胆病杂志, 2016, 32(8): 1598-1599. |
| [2] |
李鹏, 孙备. 胰腺转移癌的研究进展[J]. 中华外科杂志, 2012, 50(1): 79-81. |
| [3] |
Moussa A, Mitry E, Hammel P, et al. Pancreatic metastases:a mu-lticentric study of 22 patients[J]. Gastroenterol Clin Biol, 2004, 28: 872-876. DOI:10.1016/S0399-8320(04)95151-2 |
| [4] |
De Moura DT, Chacon DA, Tanigawa R, et al. Pancreatic metas-tases from ocular malignant melanoma:the use of endoscopic ul-trasound-guided fine-needle aspiration to establish a definitive cytologic diagnosis:a case report[J]. J Med Case Rep, 2016, 10: 332. DOI:10.1186/s13256-016-1121-2 |
| [5] |
Boussios S, Zerdes I, Batsi O, et al. Pancreatic resection for renal cell carcinoma metastasis:an exceptionally rare coexistence[J]. Int J Surg Case Rep, 2016, 27: 198-201. DOI:10.1016/j.ijscr.2016.08.039 |
| [6] |
范智慧, 严昆, 王延杰, 等. 胰腺转移癌超声造影表现探讨[J]. 中华超声影像学杂志, 2014, 23(11): 948-951. DOI:10.3760/cma.j.issn.1004-4477.2014.11.008 |
| [7] |
苗永兴, 陈忠达, 于骞, 等. 胰腺转移癌:CT表现及临床分析[J]. 肝胆胰外科杂志, 2014, 26(3): 218-221. |
| [8] |
Loannis T, Aglaia D, Michael M, et al. Pancreatic Metastases:CT and MRI findings[J]. Diagn Interv Radiol, 2010, 16: 45. |
| [9] |
陆勇, 石义志, 刘伟, 等. 无功能性胰腺神经内分泌肿瘤的MSCT表现[J]. 中国中西医结合影像学杂志, 2017, 15(1): 72-75. |
 2018, Vol. 16
2018, Vol. 16


