| 隆突性皮肤纤维肉瘤的超声表现 |
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是位于皮肤的中低度恶性肿瘤,起源于真皮层,多见于中青年,生长缓慢,较少发生转移,但易局部复发[1]。由于不具备典型临床特征,该病术前诊断多倾向良性病变。回顾性分析2013年1月至2018年12月我院19例经病理确诊的DFSP的超声表现,以提高对该病的认识,为临床诊断提供更准确的信息,现报道如下。
1 资料与方法 1.1 一般资料19例中,男5例,女14例,男女比例0.36:1;年龄22~69岁,平均42岁;病程6个月~30年。1例为胸壁肿瘤术后原位复发,余均为原发,因发现体表肿物进行性缓慢增大就诊。
1.2 仪器与方法采用Philips IU22及Affinit70仪器,L12-5线阵探头。观察病灶部位、大小、形态、边界、内部回声、后方回声,以及内部彩色血流信号分布情况。彩色多普勒血流信号分布按照Adler半定量分析法分级:0级,病灶内无血流信号;Ⅰ级,病灶内少量血流信号,星点状血流或1条血流;Ⅱ级,中等量血流,2~3条血流;Ⅲ级,丰富血流,4条及以上血流向病灶延伸交织成网。
2 结果19例均为单发,1例位于颞部;18例位于躯干,其中1例位于背部,9例位于胸壁,8例位于腹壁。查体均可见局部皮肤隆起,局部触及皮下结节,无明显压痛,2例表面皮肤红紫,其余表面肤色与周围无异。
19例超声均表现为位于皮下的单发结节,最大径1.7~6.0 cm;18例(94.7%)病灶呈椭圆形,纵横比0.32~0.71;1例(5.3%)呈类圆形,纵横比为0.94;2例可见小分叶,其余无明显分叶征象;病灶边界清楚,内部均呈不均匀低回声,可见条状高回声穿行于低回声区内,后方回声增强(图 1),周边及内部均可见血流信号(图 2),1例(5.3%)为Ⅰ级血流,3例(15.8%)为Ⅱ级血流,15例(78.9%)为Ⅲ级血流,可测及低速低阻力动脉频谱,峰值流速15.4~27.6 cm/s,RI 0.46~0.68(图 2)。所有患者均未发现转移病灶。
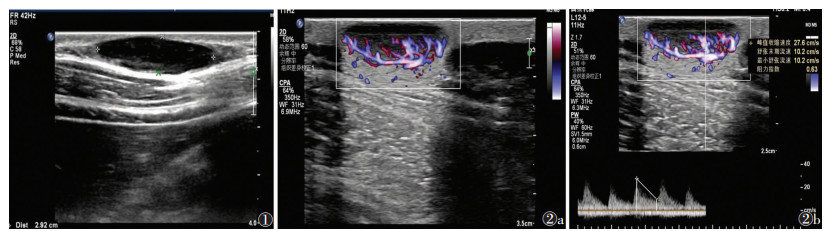 |
| 图 1 女,22岁,左胸壁肿物6个月。超声检查示左胸壁皮下低回声占位性病变,边界清楚,轻微分叶,内部呈不均匀低回声混杂条状高回声,后方回声增强 图 2 女,24岁,右腰部肿物6个月 图 2a,2b 超声检查示肿瘤周边及内部可见丰富条状血流信号,内部血流呈低速低阻力动脉频谱 |
5例门诊手术病理确诊后行二次扩大手术;14例一次性完整切除病灶,其中6例术中冰冻病理诊断为梭形细胞肿瘤而扩大手术范围。19例均为单发结节,最大径2.2~8.0 cm,组织学上表现为皮下梭形细胞肿瘤,肿瘤细胞呈席纹状排列,免疫组化示CD34(+)、Vimentin(+)。
3 讨论DFSP是发生于真皮层和皮下间叶组织的低度恶性肿瘤,于1925年由Hoffman正式命名为“DFSP”[2],其病理学主要表现为真皮层内的梭形细胞肿瘤,可向皮下组织侵袭,肿瘤细胞形成致密的编席状排列结构,免疫组化通常表达为CD34阳性;融合基因COL1A1/PDGFB被认为是DFSP的特异性基因,在诊断中有重要意义。临床上DFSP多见于20~50岁,儿童患者亦有报道[3],与性别无明显相关,可发生于全身皮肤,但更常见于躯干和四肢,且倾向于向心分布,局部皮肤隆起,部分患者表皮红紫。肿瘤生长缓慢,病程较长,较少发生远处转移,但易局部复发。一经确诊,首选手术治疗,如病灶局限,切缘应大于肿瘤边界2 cm[4],近年有研究[5-6]认为采用伊马替尼化疗有效。
由于该病的临床特征不典型,多数在术前诊断为良性病变导致手术切除不彻底而进行二次扩大手术。因此,术前影像学检查的准确性对指导临床有重要意义。以往研究[7-9]认为MRI优于超声检查,而超声检查具有便捷廉价的优势,常作为浅表软组织肿物的首选检查方式。多项研究[10-12]认为,DFSP的超声表现为位于皮下的低回声肿物,边界清楚,形态规则,内部血流丰富。结合本研究和相关报道发现DFSP临床与超声表现具有一定特点:①好发部位为躯干,本组除1例发生于头部皮肤外,其余均发生于躯干。②女性多于男性,本组男女比例为0.36:1,与以往研究[12-13]相近,但研究样本量较小,需更大样本的研究验证。③病灶位于皮肤层向皮下生长,可于体表触及肿物。④病灶大小不一,本组病灶大小与病程长短无明显正相关,另外本研究发现术前超声测量的病灶范围较肿块实际尺寸偏小,提示普通超声检查可能无法完全显示病灶的范围。但由于本病侵袭性生长的特点,术前准确标识肿瘤真实边界十分重要,近年有报道[14]利用超声造影检查所测量的病灶大小与术后病理所测数据十分接近,或许能为临床提示更准确的病灶范围。⑤肿瘤形态规则,有时可见小分叶,本组多数肿块呈椭圆形,仅1例呈类圆形肿块,大部分病灶纵横比0.32~0.71,表明肿瘤倾向于水平方向生长趋势。⑥肿瘤边界清楚,虽病理上该病呈侵袭性生长但是进展极为缓慢,易在病灶周边形成假包膜,所以大部分病灶声像图表现为边界清楚。⑦内部回声表现为不均匀低回声,主要是由于其内部成分包括了细胞和部分纤维成分而呈现以低回声为基础并混以条状稍高回声;多数病灶后方回声增强,纤维成分较少时,后方回声增强更明显,未发现后方衰减病灶。⑧肿瘤内部血流丰富,多表现为Ⅱ~Ⅲ级血流,并可测量到中低阻力动脉频谱。
DFSP需与以下病变进行鉴别:①浅表部位表皮样囊肿,可能表现为皮下边界清楚的低回声结节且后方回声增强,但内部无血流信号分布[15],与DFSP明显不同;②皮下脂肪瘤,同样可能表现为皮下边界清楚的低回声结节且后方回声增强,而其血流信号稀少甚至不可探及[16],与DFSP可鉴别;③部分DFSP患者表皮红紫,临床易误诊为血管瘤,但血管瘤超声多表现为蜂窝状的低回声结构,内可见条状无回声,CDFI可显示丰富血流信号,测及静脉频谱[17],其声像图特征与DFSP有一定差别,可与之鉴别。
综上所述,DFSP的超声表现有一定的特征性,可为临床诊断提供重要证据,但普通超声检查可能无法准确描述肿瘤的侵袭范围,需其他影像学检查的支持。
| [1] |
Bogucki B, Neuhaus I, Hurst EA. Dermatofibrosarcoma protuberans:a review of the literature[J]. Dermatol Surg, 2012, 38: 537-551. DOI:10.1111/j.1524-4725.2011.02292.x |
| [2] |
Karanian M, Gaelle Pérot, Coindre JM, et al. Fluorescence in situ hybridization analysis is a helpful test for the diagnosis of dermatofibrosarcoma protuberans[J]. Mod Pathol, 2014, 28: 230-237. |
| [3] |
Goyal P, Sehgal S, Singh S, et al. Dermatofibrosarcoma protuberans in a child:a case report[J]. Case Rep Dermatol Med, 2012, 2012: 796818. |
| [4] |
Hong JY, Liu X, Mao M, et al. Genetic aberrations in imatinibresistant dermatofibrosarcoma protuberans revealed by whole genome sequencing[J]. PLoS One, 2013, 8: e69752. DOI:10.1371/journal.pone.0069752 |
| [5] |
Ugurel S, Mentzel T, Utikal J, et al. Neoadjuvant imatinib in advanced primary or locally recurrent dermatofibrosarcoma protuberans:a multicenter phase Ⅱ DeCOG trial with long-term followup[J]. Clin Cancer Res, 2014, 20: 499-510. DOI:10.1158/1078-0432.CCR-13-1411 |
| [6] |
Fu Y, Kang H, Zhao H, et al. Sunitinib for patients with locally advanced or distantly metastatic dermatofibrosarcoma protuberans but resistant to imatinib[J]. Int J Clin Exp Med, 2015, 8: 82888294. |
| [7] |
Torreggiani W, Al-Ismail K, Munk P, et al. Dermatofibrosarcoma protuberans:MR imaging features[J]. AJR Am J Roentgenol, 2002, 178: 989-993. DOI:10.2214/ajr.178.4.1780989 |
| [8] |
Thornton SL, Reid J, Papay FA, et al. Childhood dermatofibrosarcoma protuberans:role of preoperativeimaging[J]. J Am Acad Dermatol, 2005, 53: 76-83. DOI:10.1016/j.jaad.2004.11.071 |
| [9] |
Lee SJ, Mahoney MC, Shaughnessy E. Dermatofibrosarcoma protuberans of the breast:imaging features and review of the literature[J]. AJR Am J Roentgenol, 2009, 193: W64-W69. DOI:10.2214/AJR.08.2141 |
| [10] |
Shin YR, Kim JY, Sung MS, et al. Sonographic findings of der-matofibrosarcoma protuberans with pathologic correlation[J]. J Ultrasound Med, 2008, 27: 269-274. DOI:10.7863/jum.2008.27.2.269 |
| [11] |
沈文佳, 刘艳萍, 陈卉, 等. 隆突性皮肤纤维肉瘤的超声表现[J]. 中国超声医学杂志, 2013, 29(10): 947-950. DOI:10.3969/j.issn.1002-0101.2013.10.024 |
| [12] |
赵海娜, 骆洪浩, 彭玉兰. 隆突性皮肤纤维肉瘤的高频超声表现[J]. 临床超声医学杂志, 2016, 18(6): 412-414. |
| [13] |
薛勤, 汪娟, 陈昱, 等. 隆突性皮肤纤维肉瘤的超声表现及临床病理分析[J]. 中国超声医学杂志, 2013, 29(8): 723-725. DOI:10.3969/j.issn.1002-0101.2013.08.017 |
| [14] |
Ma C, Sun Y, Yang X, et al. Improving precision of resection by pre-surgery inspections with contrast-enhanced ultrasound for de-rmatofibrosarcoma protuberans[J]. Dermatol Ther, 2016, 29: 473-475. DOI:10.1111/dth.12401 |
| [15] |
黄海, 任玉君, 任芳, 等. 28例浅表组织表皮样囊肿的高频彩超诊断结果分析[J]. 中国医药指南, 2012, 11(33): 469-470. DOI:10.3969/j.issn.1671-8194.2012.33.368 |
| [16] |
熊华花, 李泉水, 许晓华, 等. 浅表脂肪瘤的超声分型及与病理对照的研究[J]. 临床超声医学杂志, 2009, 11(7): 450-452. DOI:10.3969/j.issn.1008-6978.2009.07.006 |
| [17] |
张蓉, 余音. 彩色多普勒超声对周围浅表血管瘤的诊断价值[J]. 上海医学影像, 2005, 14(2): 131-132. DOI:10.3969/j.issn.1008-617X.2005.02.017 |
 2019, Vol. 17
2019, Vol. 17


