引用本文 |
马雯雯, 蒋常琴, 冯强, 徐芹艳, 张文轩, 范振, 姬国敏, 王锡臻. 基于CT的影像组学对胃癌不同站点正常大小淋巴结转移的预测价值[J]. 中国中西医结合影像学杂志, 2024, 22(3): 262-266, 277. DOI:
10.3969/j.issn.1672-0512.2024.03.004 
MA Wenwen, JIANG Changqin, FENG Qiang, XU Qinyan, ZHANG Wenxuan, FAN Zhen, JI Guomin, WANG Xizhen. Prediction of normal-sized lymph node metastasis at different sites of gastric cancer based on CT radiomics[J]. Chinese Imaging Journal of Integrated Traditional and Western Medicine, 2024, 22(3): 262-266, 277. DOI:
10.3969/j.issn.1672-0512.2024.03.004 
| 基于CT的影像组学对胃癌不同站点正常大小淋巴结转移的预测价值 |  [PDF全文] [PDF全文] |
马雯雯1
,
蒋常琴2
,
冯强2
,
徐芹艳1
,
张文轩1
,
范振1
,
姬国敏3
,
王锡臻1


1. 山东第二医科大学附属医院影像中心, 山东 潍坊 261031;
2. 山东省潍坊市益都中心医院影像科, 山东 潍坊 262550;
3. 河北省故城县医院影像科, 河北 故城 253800
收稿日期: 2024-01-19
基金项目: 潍坊市卫生健康委员会科研项目(WFWSJK-2023-037);河北省卫生健康委医学科学研究项目(20211406)
摘要:目的: 探讨基于CT的影像组学对胃癌不同站点正常大小淋巴结转移的预测价值。方法: 回顾性分析233例胃癌患者共303个符合纳入标准的胃周正常大小淋巴结,将其分为两区,一区为胃周第一站淋巴结(175个),二区为胃周第二、三站淋巴结(128个)。两区淋巴结分别按照7∶3的比例分为训练集和验证集。筛选临床独立危险因素及影像组学特征,并分别放入决策树、LinearSVC、支持向量机(SVM)、logistic回归4个分类器中,对两区淋巴结分别构建临床-影像组合模型。通过AUC评估组合模型的性能,通过决策曲线分析模型的临床价值。结果: 在两区淋巴结分别建立4个临床-影像组合模型,一区淋巴结的SVM模型显示出最佳的鉴别效能,其在训练集和验证集中的AUC分别为0.960(95%CI 0.925~0.995)和0.731(95%CI 0.556~0.905)。二区淋巴结的SVM模型亦显示出最佳的鉴别效能,其在训练集和验证集中的AUC分别为0.998(95%CI 0.993~1.000)和0.959(95%CI 0.924~0.994)。决策曲线分析提示,两区淋巴结SVM模型在临床决策中的应用均有较大效益。结论: 基于CT的影像组学特征建立的临床-影像组合模型可对胃癌不同站点正常大小的转移淋巴结进行术前预测。
关键词:胃肿瘤 正常大小淋巴结转移 影像组学 术前预测 体层摄影术,X线计算机
Prediction of normal-sized lymph node metastasis at different sites of gastric cancer based on CT radiomics
MA Wenwen1
,
JIANG Changqin2
,
FENG Qiang2
,
XU Qinyan1
,
ZHANG Wenxuan1
,
FAN Zhen1
,
JI Guomin3
,
WANG Xizhen1


1. Imaging Center, Affiliated Hospital of Shandong Second Medical University, Weifang 261031, China;
2. Department of Imaging, Yidu Central Hospital of Weifang, Weifang 262550, China;
3. Department of Imaging, Gucheng County Hospital, Gucheng 253800, China
Abstract: Objective: To investigate the predictive value of CT-based radiomics in the prediction of normal-sized lymph node metastasis at different sites of gastric cancer. Methods: A retrospective analysis was performed for 303 normal-sized lymph nodes in 233 patients with gastric cancer that met the inclusion criteria, and the lymph nodes were divided into two zones, Zone 1 (the first station lymphnode, 175 lymph nodes) and Zone 2 (the second and third station lymphnode, 128 lymph nodes), and the lymph nodes of the two zones were divided into the training and validation cohorts at a ratio of 7∶3, respectively. The clinical-imaging combination model was constructed for the lymph nodes in the two zones, by screening the clinical independent risk factors and radiomics characteristics, and using four different classifiers, decision tree, LinearSVC, SVM and logistic regression. The performance of the combination model was evaluated by AUC, and the clinical value of the model was analyzed by DCA. Results: Four clinical-imaging combination models were established in the two zones, and the SVM model of Zone 1 showed the best discrimination performance with the AUCs of 0.960(95%CI 0.925~0.995) and 0.731(95%CI 0.556~0.905)in the training and validation cohorts, respectively. The SVM model of Zone 2 also showed the best discrimination performance with the AUCs of 0.998(95%CI 0.993~1.000) and 0.959(95%CI 0.924~0.994) in the training and validation cohorts, respectively. DCA showed that the application of the SVM combination models of the two zones in clinical decision-making achieved great benefits. Conclusion: The clinical-imaging combination model based on CT radiomics can predict the normal-sized lymph node metastasis at different sites of gastric cancer before surgery.
Key words:
Stomach neoplasms Normal-sized lymph node metastasis Radiomics Preoperative prediction Tomography, X-ray computed
胃癌居全球最常见恶性肿瘤的第5位,是我国常见的消化道肿瘤,也是与癌症死亡相关的第三大原因[1]。淋巴结转移是胃癌最常见的转移形式,准确评估术前多个站点淋巴结转移状态对胃癌的治疗和预后至关重要。对无淋巴结转移的早期胃癌,首选胃镜下黏膜切除术或黏膜下清扫术,可提高患者生活质量,减少术后并发症,降低死亡率[2],但大多数患者不能接受。虽然胃切除D1或D2手术被公认为胃癌的标准手术,但有关最佳淋巴结清扫范围仍存在争论[3]。过度切除可能会增加手术创伤和并发症,而保守切除可能会忽略阳性淋巴结,导致癌症复发。因此,术前准确评估不同站点淋巴结的状态、确定合理的淋巴清扫范围非常必要。
近几年的研究已表明,影像组学在胃癌等癌症N分期和预后评估中具有一定的应用前景[4]。但其仅关注有无整体淋巴结转移,而未评估不同站点的淋巴结转移,尤其是正常大小淋巴结的转移。因此,本研究拟基于术前CT图像的影像组学特征,建立临床-影像组合模型,以预测胃周不同站点正常大小淋巴结转移状态,为胃癌患者的个体化术前诊断和治疗提供新方法。
1 资料与方法
1.1 一般资料
回顾性分析2020年9月至2023年6月行手术治疗的233例胃癌患者的303个符合标准的胃周淋巴结。纳入标准:①患者初次经病理确诊为胃癌且行胃周淋巴结切除术;②术前行腹部CT平扫和增强扫描;③胃周淋巴结CT图像清晰且病理信息完整、解剖分区明确;④淋巴结在CT横断面图像中的短径为0.5~1.0 cm;⑤每例患者每区仅纳入1个淋巴结。排除标准:①临床资料不全;②合并其他恶性疾病;③术前已行治疗。
将纳入的淋巴结分为两区,一区为胃周第一站淋巴结(175个175例),二区为胃周第二、三站淋巴结(128个128例),两区淋巴结分别按照7∶3的比例随机划分为训练集和验证集。一区训练集123个(阳性64个,阴性59个),验证集52个(阳性28个,阴性24个);二区训练集89个(阳性43个,阴性46个),验证集39个(阳性18个,阴性21个)。对淋巴结进行编号,确保病理淋巴结与CT图像淋巴结一一对应。
记录患者的临床资料,包括性别、年龄、淋巴结短径、TNM分期、癌胚抗原(CEA)、糖类抗原72-4(CA72-4)和糖类抗原19-9(CA19-9)。
1.2 仪器与方法
采用GE Discovery HD 750 CT扫描仪。扫描参数:120 kV,自动管电流,层厚、层距均为1.25 mm,矩阵512×512,螺距0.984,准直器宽度40.0 mm。平扫后经肘静脉注射优维显(碘浓度370 mg/mL,拜耳医药),剂量1.2~1.5 mL/kg体质量,流率3.0~3.5 mL/s,分别于25~30、60~65、160~170 s行动脉期、门脉期、延迟期扫描。
1.3 图像分析
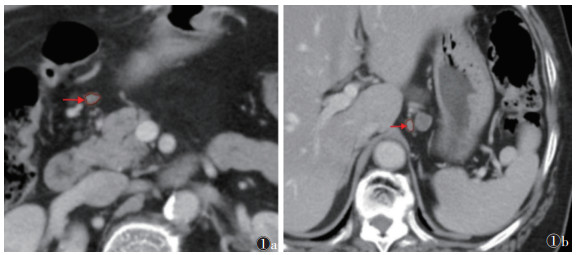
选取每例患者靶淋巴结横轴位门脉期图像(图 1),由1位影像科主治医师勾画ROI,再由另外1位主治医师在两区内各随机选取30个淋巴结勾画ROI,并与第1位主治医师勾画的ROI所提取的影像组学特征行一致性分析,筛选一致性系数≥0.85的稳定特征行后续分析。
1.4 影像组学特征提取与筛选
利用深睿平台对每个ROI进行特征提取,过滤掉高共线性和低方差的特征,后利用最小绝对收缩和选择算子算法进行降维,并通过5折交叉验证法筛选出对淋巴结转移最有预测价值的影像组学特征。
1.5 特征选择和模型构建
两区淋巴结的临床资料先行单因素分析,后行多因素logistic回归分析,筛选出与淋巴结转移具有显著相关性的独立危险因素,最后将筛选出来的独立危险因素及影像组学特征分别纳入决策树、LinearSVC、支持向量机(support vector machine,SVM)和logistic回归4种分类器中。两区分别生成4个门脉期临床-影像组合模型,在验证集对模型性能进行评价并分析模型的临床价值。
1.6 统计学方法
采用R软件(version 3.5.3)进行数据分析。不符合正态分布的计量资料以M(QL,QU)表示,2组间比较采用Wilcoxon独立秩和检验。计数资料以例(%)表示,2组间比较采用χ2检验。采用ROC曲线评估临床-影像组合模型的预测效能,决策曲线分析AUC最高的模型净获益阈值概率。以P < 0.05为差异有统计学意义。
2 结果
2.1 胃癌淋巴结转移临床危险因素分析
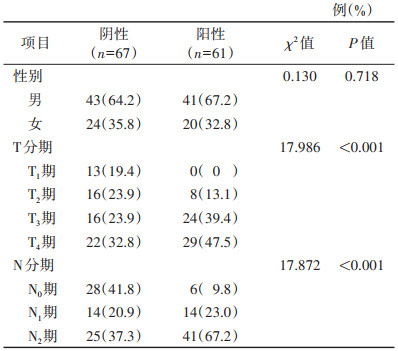
单因素分析显示,一区淋巴结转移阴性和阳性患者的N分期及淋巴结短径差异均有统计学意义(均P < 0.05);而患者性别、年龄、CEA、CA72-4、CA19-9、T分期差异均无统计学意义(均P > 0.05)(表 1,2)。单因素分析显示,二区淋巴结转移阴性和阳性患者的CA19-9、淋巴结短径、T分期、N分期差异均有统计学意义(均P < 0.05);而患者性别、年龄、CEA、CA72-4差异均无统计学意义(均P > 0.05)(表 3,4)。
表 1
|
表 1 一区影响胃癌淋巴结转移的计量资料的单因素分析[M(QL,QU)] |
表 1 一区影响胃癌淋巴结转移的计量资料的单因素分析[M(QL,QU)]
| 项目 |
阴性(n=83) |
阳性(n=92) |
W值 |
P值 |
| 年龄(岁) |
58.000(52.000,68.000) |
61.500(54.250,68.000) |
1 790.0 |
0.439 |
| CEA(μg/L) |
2.500(1.810,4.900) |
3.200(2.163,4.930) |
1 674.5 |
0.179 |
| CA19-9(μg/L) |
13.840(6.275,24.755) |
10.245(7.268,26.352) |
1 937.5 |
0.964 |
| CA72-4(μg/L) |
1.920(1.000,6.655) |
2.900(1.475,6.242) |
1 754.5 |
0.342 |
| 淋巴结短径(mm) |
5.200(4.200,5.650) |
5.850(5.300,6.500) |
1 091.5 |
< 0.01 |
| 注:CEA为癌胚抗原,CA72-4为糖类抗原72-4,CA19-9为糖类抗原19-9。 |
|
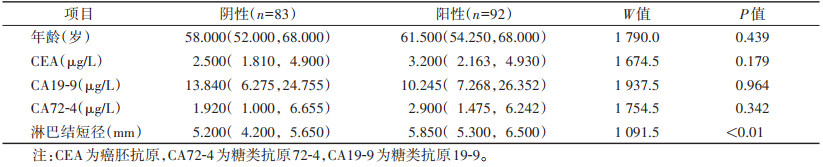 |
表 2
|
表 2 一区影响胃癌淋巴结转移的计数资料的单因素分析 |
表 2 一区影响胃癌淋巴结转移的计数资料的单因素分析
| 例(%) |
| 项目 |
阴性(n=83) |
阳性(n=92) |
χ2值 |
P值 |
| 性别 |
|
|
2.092 |
0.148 |
| 男 |
59(71.1) |
74(80.4) |
|
|
| 女 |
24(28.9) |
18(19.6) |
|
|
| T分期 |
|
|
7.015 |
0.071 |
| T1期 |
11(13.2) |
4(4.3) |
|
|
| T2期 |
15(18.1) |
11(12.0) |
|
|
| T3期 |
32(38.6) |
38(41.3) |
|
|
| T4期 |
25(30.1) |
39(42.4) |
|
|
| N分期 |
|
|
15.960 |
< 0.001 |
| N0期 |
27(32.5) |
10(10.9) |
|
|
| N1期 |
20(24.1) |
17(18.5) |
|
|
| N2期 |
36(43.4) |
65(70.6) |
|
|
|
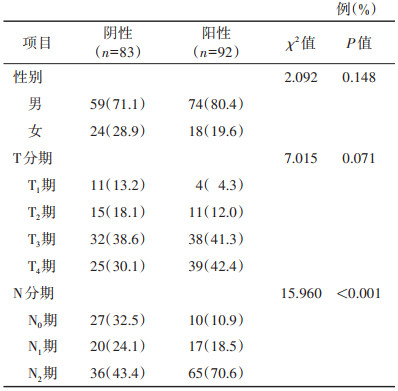 |
表 3
|
表 3 二区影响胃癌淋巴结转移的计量资料的单因素分析[M(QL,QU)] |
表 3 二区影响胃癌淋巴结转移的计量资料的单因素分析[M(QL,QU)]
| 项目 |
阴性(n=67) |
阳性(n=61) |
W值 |
P值 |
| 年龄(岁) |
58.000(53.000,68.000) |
60.000(54.500,66.000) |
499.0 |
0.362 |
| CEA(μg/L) |
2.550(1.340,6.980) |
3.330(2.100,7.360) |
501.5 |
0.379 |
| CA19-9(μg/L) |
11.800(6.370,19.900) |
18.600(9.210,33.115) |
405.0 |
0.039 |
| CA72-4(μg/L) |
4.110(1.790,7.140) |
2.390(1.595,5.200) |
681.0 |
0.188 |
| 淋巴结短径(mm) |
5.500(4.700,6.200) |
6.400(5.650,6.750) |
348.5 |
0.006 |
| 注:CEA为癌胚抗原,CA72-4为糖类抗原72-4,CA19-9为糖类抗原19-9。 |
|
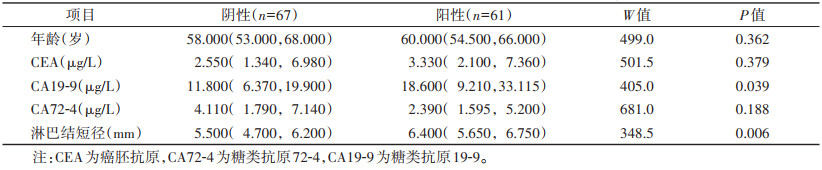 |
表 4
|
表 4 二区影响胃癌淋巴结转移的计数资料的单因素分析 |
表 4 二区影响胃癌淋巴结转移的计数资料的单因素分析
| 例(%) |
| 项目 |
阴性(n=67) |
阳性(n=61) |
χ2值 |
P值 |
| 性别 |
|
|
0.130 |
0.718 |
| 男 |
43(64.2) |
41(67.2) |
|
|
| 女 |
24(35.8) |
20(32.8) |
|
|
| T分期 |
|
|
17.986 |
< 0.001 |
| T1期 |
13(19.4) |
0(0) |
|
|
| T2期 |
16(23.9) |
8(13.1) |
|
|
| T3期 |
16(23.9) |
24(39.4) |
|
|
| T4期 |
22(32.8) |
29(47.5) |
|
|
| N分期 |
|
|
17.872 |
< 0.001 |
| N0期 |
28(41.8) |
6(9.8) |
|
|
| N1期 |
14(20.9) |
14(23.0) |
|
|
| N2期 |
25(37.3) |
41(67.2) |
|
|
|
 |
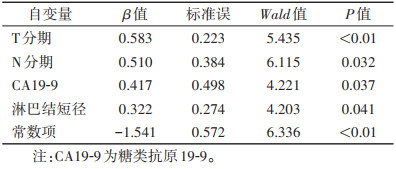
多因素logistic回归分析显示,N分期和淋巴结短径是一区胃癌淋巴结转移的独立临床危险因素(均P < 0.05)(表 5);CA19-9、淋巴结短径、T分期、N分期是二区胃癌淋巴结转移的独立临床危险因素(均P < 0.05)(表 6)。
表 5
|
表 5 一区影响胃癌淋巴结转移的多因素logistic回归分析 |
表 5 一区影响胃癌淋巴结转移的多因素logistic回归分析
| 自变量 |
β值 |
标准误 |
Wald值 |
P值 |
| N分期 |
0.581 |
0.450 |
6.173 |
< 0.01 |
| 淋巴结短径 |
0.362 |
0.334 |
4.226 |
0.031 |
| 常数项 |
-1.632 |
0.625 |
6.427 |
0.025 |
|
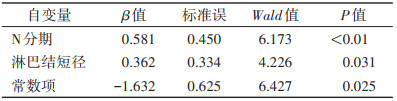 |
表 6
|
表 6 二区影响胃癌淋巴结转移的多因素logistic回归分析 |
表 6 二区影响胃癌淋巴结转移的多因素logistic回归分析
| 自变量 |
β值 |
标准误 |
Wald值 |
P值 |
| T分期 |
0.583 |
0.223 |
5.435 |
< 0.01 |
| N分期 |
0.510 |
0.384 |
6.115 |
0.032 |
| CA19-9 |
0.417 |
0.498 |
4.221 |
0.037 |
| 淋巴结短径 |
0.322 |
0.274 |
4.203 |
0.041 |
| 常数项 |
-1.541 |
0.572 |
6.336 |
< 0.01 |
| 注:CA19-9为糖类抗原19-9。 |
|
 |
2.2 两区筛选的影像组学特征
一区、二区淋巴结特征筛选后分别得到18、11个特征参数(表 7)。
表 7
|
表 7 一区、二区淋巴结筛选的影像组学特征参数 |
表 7 一区、二区淋巴结筛选的影像组学特征参数
| 分区 |
特征参数 |
| 一区 |
squareroot_glrlm_GrayLevelNonUniformity,logarithm_gldm_GrayLevelNonUniformity,exponential_glrlm_RunEntropy,wavelet-LH_ngtdm_Coarseness,gradient_gldm_DependenceVariance,wavelet-LH_ngtdm_Strength,gradient_glrlm_RunPercentage,original_shape_MinorAxisLength,gradient_glszm_ZonePercentage,wavelet-HL_ngtdm_Strength,wavelet-HL_ngtdm_Coarseness,lbp-3D-k_glrlm_RunLengthNonUniformityNormalized,lbp-3D-k_gldm_SmallDependenceLowGrayLevelEmphasis,logarithm_gldm_SmallDependenceLowGrayLevelEmphasis,wavelet-LH_glcm_Imc1,lbp-2D_firstorder_Median,lbp-2D_glrlm_ShortRunEmphasis,wavelet-LL_gldm_SmallDependenceLowGrayLevelEmphasis |
| 二区 |
wavelet-LL_gldm_SmallDependenceLowGrayLevelEmphasis,lbp-2D_firstorder_Median,wavelet-LH_ngtdm_Coarseness,lbp-2D_glrlm_ShortRunEmphasis,wavelet-LH_glcm_Imc1,original_shape_MinorAxisLength,gradient_glszm_ZonePercentage,wavelet-HL_ngtdm_Coarseness,logarithm_gldm_SmallDependenceLowGrayLevelEmphasis,squareroot_glrlm_GrayLevelNonUniformity,logarithm_gldm_GrayLevelNonUniformity |
|
 |
2.3 模型构建及验证
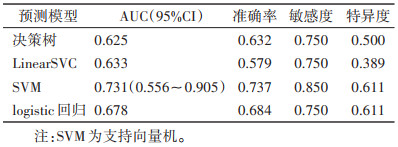
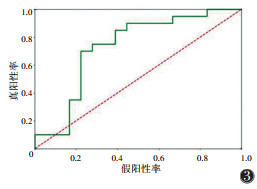
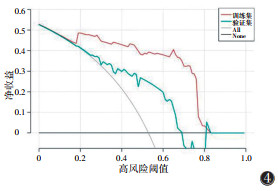
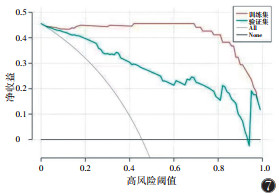
在一区所构建的4个模型中,预测性能最佳的是SVM模型,在训练集中的AUC为0.960(95%CI 0.925~0.995),在验证集中的AUC为0.731(95%CI 0.556~0.905)(表 8,9;图 2,3)。决策曲线分析提示,SVM模型在临床决策中的应用可取得较大效益(图 4)。
表 8
|
表 8 一区训练集4个预测模型比较 |
表 8 一区训练集4个预测模型比较
| 预测模型 |
AUC(95%CI) |
准确率 |
敏感度 |
特异度 |
| 决策树 |
0.932 |
0.824 |
0.860 |
0.844 |
| LinearSVC |
0.949 |
0.862 |
0.848 |
0.878 |
| SVM |
0.960(0.925~0.995) |
0.885 |
0.957 |
0.805 |
| logistic回归 |
0.930 |
0.816 |
0.804 |
0.829 |
| 注:SVM为支持向量机。 |
|
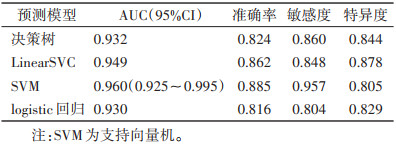 |
表 9
|
表 9 一区验证集4个预测模型比较 |
表 9 一区验证集4个预测模型比较
| 预测模型 |
AUC(95%CI) |
准确率 |
敏感度 |
特异度 |
| 决策树 |
0.625 |
0.632 |
0.750 |
0.500 |
| LinearSVC |
0.633 |
0.579 |
0.750 |
0.389 |
| SVM |
0.731(0.556~0.905) |
0.737 |
0.850 |
0.611 |
| logistic回归 |
0.678 |
0.684 |
0.750 |
0.611 |
| 注:SVM为支持向量机。 |
|
 |
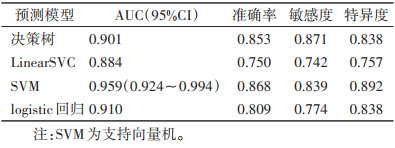
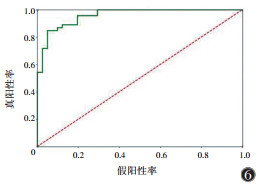
在二区所构建的模型中,预测性能最佳的是SVM模型,在训练集中的AUC为0.998(95%CI 0.993~1.000),在验证集中的AUC为0.959(95%CI 0.924~0.994)(表 10,11;图 5,6)。决策曲线分析提示,SVM模型在临床决策中的应用可取得较大效益(图 7)。
表 10
|
表 10 二区训练集4个预测模型比较 |
表 10 二区训练集4个预测模型比较
| 预测模型 |
AUC(95%CI) |
准确率 |
敏感度 |
特异度 |
| 决策树 |
0.953 |
0.895 |
0.839 |
1.000 |
| LinearSVC |
0.938 |
0.834 |
0.845 |
0.893 |
| SVM |
0.998(0.993~1.000) |
0.979 |
0.952 |
0.934 |
| logistic回归 |
0.996 |
0.911 |
1.000 |
0.925 |
| 注:SVM为支持向量机。 |
|
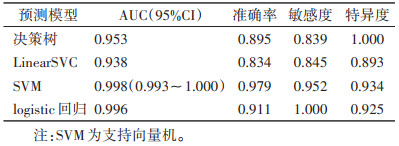 |
表 11
|
表 11 二区验证集4个预测模型比较 |
表 11 二区验证集4个预测模型比较
| 预测模型 |
AUC(95%CI) |
准确率 |
敏感度 |
特异度 |
| 决策树 |
0.901 |
0.853 |
0.871 |
0.838 |
| LinearSVC |
0.884 |
0.750 |
0.742 |
0.757 |
| SVM |
0.959(0.924~0.994) |
0.868 |
0.839 |
0.892 |
| logistic回归 |
0.910 |
0.809 |
0.774 |
0.838 |
| 注:SVM为支持向量机。 |
|
 |
3 讨论
不同淋巴结转移阶段的胃癌患者需行不同程度的淋巴清扫或新辅助治疗,因此,治疗前须准确预测和评估淋巴结转移情况。目前影像组学已越来越多地应用于胃癌患者的淋巴结预测。本研究利用影像组学方法,对胃周正常大小淋巴结的CT影像组学特征进行提取,结果表明组合模型对预测胃癌不同站点正常大小淋巴结转移状态具有一定的临床价值,其中SVM模型在一区和二区的鉴别效能均优于其他3种模型,与Sun等[5]的研究结果一致。此外,一区SVM模型在训练集和验证集的预测敏感度分别为0.957和0.850,敏感度高代表假阴性率低,这为正常大小淋巴结转移患者的准确分期和治疗方案的制订提供了依据。
本研究显示,CA19-9、淋巴结短径、T分期、N分期是胃癌淋巴结转移的独立临床危险因素。T分期越高,代表原发肿瘤浸润深度越深,发生淋巴结转移的概率更大。N分期越高,代表转移淋巴结的数量越多。而淋巴结短径的大小可更直观地反映淋巴结转移状态,短径越大,淋巴结发生转移的概率越大。赵培吉[6]的研究表明,胃癌患者血清CA19-9水平明显高于良性病变组和健康对照组,CA19-9水平越高,表明胃癌恶性程度越高,发生淋巴结转移的能力越强。
本研究显示,一区共筛选出18个影像组学特征参数,二区共筛选出11个影像组学特征参数,其中二区筛选的11个影像组学特征参数在一区中也均被筛选出来,提示其可能是预测淋巴结转移的关键特征参数。但由于组学软件较多,特征参数不尽相同,其是否为确切的关键特征参数仍需进一步研究。
Li等[7]建立了动脉期和门静脉期影像组学模型用于预测胃腺癌淋巴结转移的效能,结果显示门静脉期AUC为0.76,高于动脉期(0.71)。本研究于门脉期从代表不同病理状态的淋巴结中寻找关键特征,是因为门脉期反映的是组织血液清除情况,这是肿瘤转移的一个重要影像特征。另外,本研究为了验证构建的模型在不同站点淋巴结的预测性能,将纳入的淋巴结按不同站点分为两区进行分析。决策曲线分析表明本研究构建的SVM模型有着良好的临床实用性。
本研究存在以下不足:①一区训练集与验证集的AUC差异稍大,主要原因是样本量相对较小,导致结果出现过拟合情况。需开展多中心研究,扩大样本量,进一步验证模型的可重复性和外推性;②仅采用了4种分类器构建模型,未与其他算法的分类器比较,后期将利用更多的分类器进行建模比较,找到最优方案。
综上所述,利用胃癌淋巴结的门脉期CT影像组学特征构建的临床-影像组合预测模型,为精准预测不同站点正常大小淋巴结转移提供了新的方法,可提高无创诊断淋巴结转移的效能。
参考文献
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
ASSOCIATION J G C. Japanese gastric cancer treatment guidelines 2018 (5th edition)[J]. Gastric Cancer, 2021, 24(1): 1-21. DOI:10.1007/s10120-020-01042-y |
| [3] |
SUN Z, JIANG Y, CHEN C, et al. Radiomics signature based on computed tomography images for the preoperative prediction of lymph node metastasis at individual stations in gastric cancer: a multicenter study[J]. Radiother Oncol, 2021, 165: 179-190. DOI:10.1016/j.radonc.2021.11.003 |
| [4] |
JIANG Y, JIN C, YU H, et al. Development and validation of a deep learning CT Signature to predict survival and chemotherapy benefit in gastric cancer: a multicenter, retrospective study[J]. Ann Surg, 2021, 274(6): 1153-1161. DOI:10.1097/SLA.0000000000003778 |
| [5] |
SUN R J, FANG M J, TANG L, et al. CT-based deep learning radiomics analysis for evaluation of serosa invasion in advanced gastric cancer[J]. Eur J Radiol, 2020, 132: 109277. DOI:10.1016/j.ejrad.2020.109277 |
| [6] | |
| [7] |
LI J, DONG D, FANG M, et al. Dual-energy CT-based deep learning radiomics can improve lymph node metastasis risk prediction for gastric cancer[J]. Eur Radiol, 2020, 30(4): 2324-2333. DOI:10.1007/s00330-019-06621-x |











 2024, Vol. 22
2024, Vol. 22


