| 肺结节MRI检查的研究进展和临床应用 |
2. 复旦大学附属中山医院放射科, 上海 200032
因肺部质子密度低、T2信号衰减迅速、磁场不均匀等原因,肺部MRI的临床应用一直颇具挑战。随着扫描序列参数的优化、去伪影技术的提升、扫描仪和线圈的技术进步、平行成像技术的调整、对比剂的使用、后处理技术的发展、更高的图像对比度和SNR提供了更高的空间分辨力,MRI检查在胸部疾病患者的管理中开始发挥补充作用。国际肺癌筛查协会和之前基于CT的各种肺癌筛查的研究结果显示,在常规临床实践中对肺部结节的管理需求越来越大[1]。CT是目前肺部疾病的主要检测及诊断工具,但存在辐射暴露(尤其是年轻患者,后续反复的CT检查随访可能是不可取的)、高危人群长期随访引起的累积辐射损害、乳腺及甲状腺等敏感器官射线反复暴露可能诱发新的肿瘤、孕妇及碘对比剂过敏者不宜接受CT检查等[2]不足,因此,具有无辐射损害,可多序列、多参数成像等优点的MRI检查得到越来越多的关注。最新出版的Fleischner协会肺结节处理策略指南和肺部CT筛查报告和数据系统(Lung-RADS)建议应评估结节的所有类型及大小,因为结节类型和大小评估是结节管理的有效标志物,有助于降低肺癌的死亡率。随着MRI系统的发展,DWI、动态增强扫描(dynamic contrast-enhanced MRI,DCE-MRI)、MRS、体素内不相干运动(intravoxel incoherent motion,IVIM)等各种功能成像的应用,MRI不仅可提供病灶形态学的信息,还可提供功能、生理、病理生理和分子方面的信息,其已成为肺部疾病检测的重要补充工具。
本文重点介绍MRI平扫、增强扫描在肺结节检测和评估方面的进展,并对最新的分子成像方法,如化学交换饱和位移成像技术(chemical exchange satu-ration transfer,CEST)与MSCT及PET-CT进行比较。
1 肺结节的MRI检出目前,常用的肺结节MRI扫描序列包括快速自旋回波(turbo spin-echo,TSE)、梯度回波(gradient-echo,GRE)、半傅里叶采集单次激发快速自旋回波(half-Fourier acquisition single-shot turbo spin-echo,HASTE)、三维容积内插法屏气(three-dimensional volume interpolated breath-hold,3D-VIBE)技术等。以上序列能不同程度地减少心脏和呼吸运动伪影,检测出直径3~4 mm的实性肺结节[3]。不同MRI序列检出肺实性结节的特异度和敏感度各不相同。Meier等[4]的研究显示,1.5 T MRI TSE序列检测直径≥6 mm实性肺结节的特异度和敏感度分别为93%~96%、80%~87%。Vogt等[5]研究显示,1.5 T MRI HASTE序列检测直径≤5 mm肺结节的敏感度为95.6%。3.0 T MRI 3D-VIBE作为3D-GRE的主要技术,采用鸡尾酒快速采集技术,对肺结节的检出率为54.1%~87.3%[6]。Koyama等[7]研究显示,1.5 T MRI心电门控及呼吸触发T1WI技术对直径1~30 mm恶性肺结节检出的敏感度为96.1%。Ohno等[8]研究显示,3.0 T MRI 3D-超短自旋回波序列(ultrashort echo time,UTE)对直径4~29 mm恶性肺结节检出敏感度为93%,与64排CT相比(92%)差异无统计学意义。相关研究还发现,UTE序列可清晰显示亚实性结节及纯磨玻璃结节,检出病灶的敏感度分别为57.7%、90.9%,特异度分别为97.6%、98.0%[9]。UTE序列具有传统MRI无法做到的超短TE值,在短T2物质(肺)的信号快速衰减至零前迅速采集,这是医学影像学领域的一个重大突破,具有广阔的临床应用前景。MRI显示肺结节的局限之处主要在于病灶内实性成分、磨玻璃成分所占百分比[10],CT和MRI显示磨玻璃成分的对比见图 1。
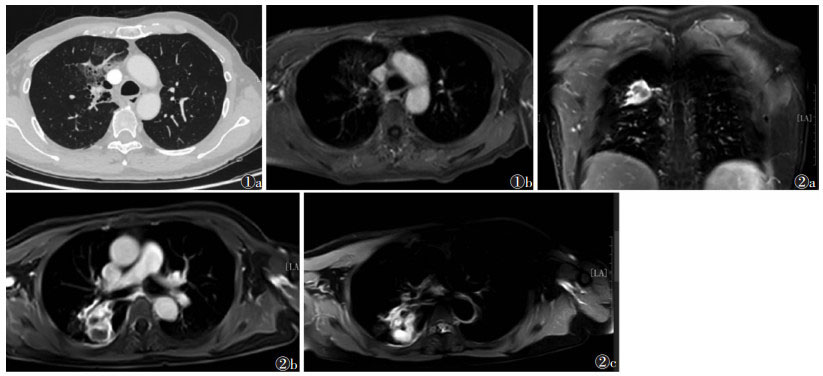 |
| 图 1 男,59岁,肺腺癌 图 1a CT显示右肺上叶混合磨玻璃阴影,边界欠清,范围约6.8 cm×5.3 cm 图 1b MRI增强扫描可清晰显示病灶内的磨玻璃成分 图 2 女,58岁,结核分枝杆菌感染 图 2a 冠状位MRI增强扫描图像,可见环形强化肿块 图 2b 横轴位MRI增强扫描图像,可见环形强化肿块伴中央无强化区 图 2c T2WI-SPAIR序列图像,中央无强化区表现为明显高信号,提示内部囊变、坏死 |
2 肺结节的MRI检查方法 2.1 平扫
使用SE或TSE技术,大部分肺结节如肺癌、肺转移瘤、低级别恶性病变(类癌、淋巴瘤)T1WI呈低或中等信号,T2WI呈高信号。研究显示,联合平扫T1WI、T2WI及增强T1WI图像,可诊断支气管囊肿、肺结核、含黏液的肿瘤、错构瘤和曲霉菌感染;然而,当缺乏典型表现的良恶性病变的弛豫时间重叠时,MRI很难进行鉴别诊断[11-12]。
2008年的一项研究认为,STIR是比平扫T1WI、增强T1WI、T2WI更具有前景的序列,STIR、T1WI、T2WI对肺结节的检出率相同(整体82.5%,恶性96.1%,良性68.1%),与薄层CT检出率(整体97%,恶性100%,良性93.8%)差异有统计学意义(均P < 0.05);该研究还报道了非增强扫描序列区分良恶性病变的定性与定量分析结果,其中STIR序列定性诊断特异度和准确度分别为60.6%和74.5%,明显高于T1WI(特异度37.9%,P < 0.05;准确度67.9%,P < 0.05)和T2WI(特异度48.5%,P < 0.05;准确度67.9%,P < 0.05),并且,STIR序列定量诊断特异度(54.5%)优于T1WI(39.4%)和T2WI(37.9%),均P < 0.05[7]。
21世纪初,学者开始对肺结节DWI表现进行深入研究[13]。DWI是从细胞数量、灌注、细胞外空间等方面评估组织内水分子的扩散运动的一项MRI技术。研究表明,DWI诊断直径3~5 mm肺结节的敏感度为43.8%,直径6~9 mm肺结节为6.4%,直径≥10 mm肺结节为97%[14]。在临床实践中ADC常作为DWI的定量成像标记物。Meta分析显示,使用ADC值对良恶性肺结节进行鉴别的敏感度和特异度分别为80%~88%、89%~93%,且肺癌的ADC值低于良性病变[15-17]。研究表明直径 < 2 cm的肺结节,ADC值测量可重复性较差,直径≥2 cm的肺结节,ADC值测量可重复性较高[15]。虽然ADC值可以量化,但仍受扫描方式、最佳诊断b值如何选择的影响。DWI病灶/脊髓信号比率评估方法受b值影响较小,且重复性更好、准确性更高,其鉴别良恶性结节的敏感度、特异度和准确度分别为88.8%、96.7%、93.9%[18]。
DWI反映的是细胞内外水分子的扩散运动以及毛细血管内血流微灌注的综合情况,并非水分子的真实扩散[19]。IVIM采用多b值DWI图像进行双指数模型拟合,对水分子扩散运动和毛细血管内微循环灌注进行单独分析,获得组织内水分子扩散系数D(mm2/s)、血流相关假扩散系数D*(mm2/s),以及灌注分数f(%)。D代表组织内水分子单纯的扩散效应,D*代表组织内微循环灌注相关扩散效应,f代表微循环灌注相关扩散效应占总体扩散效应的比率,由于灌注速度远大于扩散速度,因此,D也称为慢池扩散,D*也称为快池扩散。当b值较低(< 200 s/mm2)时,毛细血管内血流微灌注所占比例较大,随着b值升高,受微循环灌注的影响减小,主要反映的是组织内水分子真实的扩散情况。有研究认为,b值为900 s/mm2作为良恶性病变诊断的阈值时,ADC值诊断效能较高[20]。Deng等[21]的研究发现,炎性反应的f值明显高于肺癌,诊断特异度75%,敏感度80%,D和D*无明显差异。Wan等[22]的研究发现,恶性肺结节的D值明显低于良性结节(P≤0.001),且D值评价效果较ADC值更好,特异度和敏感度分别为81.82%、92.16%。
2.2 常规(即非动态)增强扫描MRI常规增强扫描时,由于病理和药代动力学的差异,恶性肺结节通常比良性肺结节表现出更大的强化幅度差异。尽管用于MRI检查的钆对比剂在生理和药代动力学方面基本上与CT检查中的碘对比剂相似,但常规MRI增强扫描通常比常规CT增强扫描更有效[23]。此外,在1.5 T和3.0 T MRI系统,使用相同浓度的对比剂时,T1WI GRE或turbo GRE序列显像优于SE和turbo SE[11]。环形/薄壁样强化被认为是肺结核的典型强化方式(图 2),它在组织学上对应的是纤维组织环绕在上皮样或结核性肉芽肿结节周围;中央无强化的部分对应的是干酪样坏死或者瘢痕组织;MRI上无强化的组织还可以是错构瘤内常见的软骨。起初,有研究认为,血管集束征多见于恶性病变[24],随着胸部MRI增强扫描的广泛应用,肺水肿、肺不张、阻塞性肺炎、淋巴瘤、来自胃肠道、卵巢癌的肺转移瘤内也可观察到此征象。因此,目前不认为该征象是恶性肺部疾病的特征性表现。
2.3 DCE-MRI由于近年来MRI硬件系统和脉冲序列的优化,DCE用于肺结节评估已得到广泛应用。该技术可使用2D自旋回波、快速自旋回波或其他各种2D、3D梯度回波技术扫描来快速获得连续的、注射对比剂前后对比的图像。
在一项前瞻性的CT动态增强扫描、MRI和FDG PET-CT的比较研究中,采集注入对比剂后首次通过目标结节或肿块的所有图像数据,3D-GRE和UTE仅需不到30 s,而FDG PET-CT、PET-CT需近2 h。此外,DCE-MRI表现出了卓越的诊断性能,与CT动态增强扫描、FDG-PET或PET-CT相比,UTE-DCE能区分需进一步干预和治疗(恶性病变或活动性炎症)和无需进一步干预和治疗的肺结节或肿块,它在鉴别诊断上发挥了补充作用,有潜力成为鉴别良恶性结节或肿块的CT替代性检查[25-26]。
有研究提出,可通过可视化的DCE半定量参数评价病灶内部的血供情况。半定量参数包括最大相对强化率、初始斜率、强化斜率、早期峰值、达峰时间等[26]。对比剂通过病灶后多次采集、选取ROI测量可获得TIC,TIC分为4型:速升速降型,在30 s内信号强度迅速上升(早期峰值强化增强比 > 30%),达高峰后迅速下降;平台型/速升缓降型,30 s内信号强度迅速上升(1 min时早期峰值强化增强比 > 30%),后稳定、轻度上升或轻度下降;缓慢上升型,信号强度上升缓慢(1 min时早期峰值强化增强比 < 30%);平稳型,信号强度有升高(最大峰值增强比 < 10%)。虽然在一些良性和恶性病变中,TIC的形态和强化模式有重叠,但在鉴别这些病变方面有重要价值。半定量参数受外部影响较多,如扫描参数、后处理和测量的主观性等因素。
采用Tofts两室血流动力学模型、非线性最小二乘积算法计算可获得组织的血流信息并进行定量评估,定量参数包括:容积转移常数(Ktrans)、速率常数(Kep)和血管外细胞外间隙容积分数(Ve),三者的关系为Ve=Ktrans/Kep。Ktrans反映的是单位时间单位组织内对比剂由血管腔进入血管外细胞外间隙的情况(单位min-1),可显示肿瘤组织毛细血管通透性及血管生成情况,但受血流灌注和组织渗透率的影响;Kep反映的是单位时间单位组织内对比剂由血管外细胞外间隙进入血管腔内的量(单位min-1),可显示毛细血管渗透能力;Ve反映的是血管外细胞外间隙占整个体素的容积比,可间接反映血管壁的通透性。DCE-MRI定量参数有助于区分需积极干预和仅需随访的结节。Ohno等[26]研究显示,首过灌注法DCE-MRI诊断肺结节的特异度、准确率明显优于CT动态增强扫描及PET-CT检查(P < 0.05)。DCE-MRI定量参数还能诊断肺癌纵隔淋巴结转移,为临床治疗方案的选择提供更多信息[27]。但也有研究指出,DCE-MRI单个扫描时间分辨率为20~30 s,而诊断能力高度依赖于时间分辨力;呼吸运动伪影也是影响图像质量的重要因素,因此,采用3D非刚性运动校准方法可减少呼吸运动导致的图像变形[28]。与屏气扫描相比,自由呼吸扫描重复性更好[29]。
不同功能成像方法的联合应用,不仅可提高肺结节检出率,还可提升对良恶性病变诊断的效能[30-31]。3.0 T MRI T2WI快速自旋回波序列联合3D T1WI VIBE序列可将直径 > 5 mm的肺结节检出敏感度提升至97.9%[32]。Yuan等[31]研究表明,Ktrans联合D值的诊断特异度、敏感度及准确率分别高达92%、94.2%及93.5%。对于表现为速升速降型TIC的病变,DCE-MRI联合DWI可鉴别炎症及坏死的部分[33]。
2.4 MRSMRS是一项无创性观察活体组织代谢及生化变化的技术。其利用化学位移研究分子结构,化学位移的程度具有磁场依赖性、环境依赖性。在肺结节鉴别诊断方面,已有研究证实胆碱复合物(Cho)值升高、胆碱复合物/肌酸(Cr)比值增加和异常的乳酸(Lac)峰是诊断恶性肺结节的重要标志物[34]。同时,MRS对非小细胞肺癌脑转移放疗的疗效评价具有预测价值,治疗前Cho/Cr比值高者预后较差[35]。当代谢物浓度以mmoL为单位时,1H-MRS约1 mL体素才能实现足够的信号,且MRS具有空间分辨力低、图像采集时间长,在精准显示解剖结构方面具有局限性等不足之处。虽然目前MRS仍不能取代MRI对肺部疾病进行独立诊断,但其在鉴别诊断方面具有一定的辅助参考价值。
2.5 CEST成像目前,临床上广泛应用于MRI信号增强的药物多为钆对比剂,可缩短自由水质子的弛豫时间。虽然钆对比剂可更好地区分正常组织和病变组织,但其并不是选择性的,而是均匀分布在细胞外空间[36]。CEST是一种基于组织内在特性(可交换质子-NH、-OH、-SH等)的对比技术,在20世纪90年代早期,CEST作为一种新的方法被应用于改良MRI的组织对比度,引起了相当大的关注。该方法是基于化学交换理论基础、由磁化转移发展而来的技术,它使用特定频率的射频脉冲,使目标分子选择性地饱和并使用饱和转移技术将饱和信号转移到周围自由水的氢质子,通过检测周围水分子信号的变化从而对人体进行间接成像[37]。其通过检测特定的代谢物和放大低浓度代谢物的信号,相比于MRS可达到μmoL甚至更低级别的显像[38]。目前,GEST相关的研究主要集中于中枢神经系统及肿瘤性疾病方面[39-40]。
酰胺质子(amide proton transfer,APT)成像是CEST成像的一个子集,专门适用于自由水和酰胺基(-NH)质子之间的化学交换,虽然该方法对静磁场(B0)的不均一性很敏感,但一些研究已经将APT成像应用于胸部。Togao等[41]进行的动物研究显示,APT成像可用于量化离体肺肿瘤。研究显示,肿瘤的APT效应更明显、更活跃,表明APT成像有潜力成为一种非侵入性的区分肺癌类型或分级的技术,这可能会减少侵入性穿刺活检或不必要的肺癌切除手术[41]。此外,文献报道,APT成像在鉴别恶性和良性胸部病变(敏感度、特异度和准确度分别为100%、75%、90.5%)、肺癌和其他胸恶性肿瘤(敏感度、特异度和准确率分别为100%、75%、92.3%),以及腺癌和鳞状细胞癌(敏感度、特异度和准确度分别为100%、100%、100%)方面有较好的诊断效能[42]。
Ohno等[43]的研究直接比较了APT成像、DWI、PET-CT及APT成像与PET-CT相结合的鉴别良恶性结节的能力。尽管DWI(67.3%)的敏感度明显高于APT成像(46.9%)和PET-CT(46.9%)(均P < 0.05),但其特异度(64.1%)明显低于APT成像(94.9%)和PET-CT(92.3%)(均P < 0.05)。此外,将APT成像和PET-CT相结合时,非对称磁化转移率与最大标准摄取值组合的敏感度、特异度和准确度分别为69.4%、84.6%和76.1%。因此,APT成像与PET-CT相结合可显著提高APT成像或PET-CT单独成像的敏感度和准确度(均P < 0.05),且其敏感度和准确度明显高于DWI。以上研究表明,CEST成像可能作为一种新的分子成像技术对肺结节进行评估,但其应用潜力仍需进一步证实。
3 总结与展望目前用于肺结节的检测及评估的MRI技术,包括传统MRI成像、功能成像和分子影像领域。优质图像与合理采集时间之间的平衡一直是先进的影像技术向临床应用转化的主要障碍,期待软硬件技术的进步、更新颖的观察角度(放射组学、放射基因组学、人工智能机器学习算法)、更多的临床试验及更多样深入的研究来加快各种半定量、定量的数据处理,以促进影像技术在临床的应用。
| [1] |
ABERLE D R, ADAMS A M, BERG C D, et al. Reduced lung cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [2] |
MCCUNNEY R J, LI J. Radiation risks in lung cancer screening programs: a compararison with nuclear industry workers and atomic bomb survivors[J]. Chest, 2014, 145(3): 618-624. DOI:10.1378/chest.13-1420 |
| [3] |
BIDERER J, OHNO Y, HATABU H, et al. Screening for lung cancer: does MRI have a role?[J]. Eur J Radiol, 2017, 86: 353-360. DOI:10.1016/j.ejrad.2016.09.016 |
| [4] |
MEIER M, HOMSI R, SCHILD H H, et al. Lung cancer screening with MRI: characterization of nodules with different non-enhanced MRI sequences[J]. Acta Radiologica, 2019, 60(2): 168-176. DOI:10.1177/0284185118778870 |
| [5] |
VOGT F M, HERBORN C U, HUNOLD P, et al. HASTE MRI versus chest radiography in the detection of pulmonary nodules: comparison with MDCT[J]. AJR Am J Roentgenol, 2004, 183(1): 71-78. DOI:10.2214/ajr.183.1.1830071 |
| [6] |
CIESZANOWSKI A, LISOWSKA A, DABROWSKA M, et al. MR imaging of pulmonary nodules: detection rate and accuracy of size estimation in comparison to computed tomography[J]. PLoS One, 2016, 11(6): 156272. |
| [7] |
KOYAMA H, OHNO Y, KONO A, et al. Quantitative and qualitative assessment of non-contrast-enhanced pulmonary MR imaging for management of pulmonary nodules in 161 subjects[J]. Eur Radiol, 2008, 18(10): 2120-2131. DOI:10.1007/s00330-008-1001-2 |
| [8] |
OHNO Y, KOYAMA Y, YOSHIKAWA T, et al. Standard-, reduced-, and no-dose thin-section radiologic examinations: comparison of capability for nodule detection and nodule type assessment in patients suspected of having pulmonary nodules[J]. Radiology, 2017, 284(2): 562-573. DOI:10.1148/radiol.2017161037 |
| [9] |
WIELPUTZ M O, LEE H Y, KOYAMA H, et al. Morphological characterization of pulmonary nodules with ultrashort TE MRI at 3T[J]. AJR Am J Roentgenol, 2018, 210(6): 1-10. |
| [10] |
KOO C W, WHITE D B, LINGINENI R K, et al. Magnetic resonance imaging of part-solid nodules: a pilot study[J]. J Thorac Imaging, 2016, 31(1): 2-10. DOI:10.1097/RTI.0000000000000176 |
| [11] |
OHNO Y, HIGASHINO T, WATANABE H, et al. MR imaging of lung cancer[J]. Eur J Radiol, 2002, 44(3): 172-181. DOI:10.1016/S0720-048X(02)00267-X |
| [12] |
OHNO Y. New applications of magnetic resonance imaging for thoracic oncology[J]. Semin Respir Crit Care Med, 2014, 35(1): 27-40. DOI:10.1055/s-0033-1363449 |
| [13] |
MORI T, NOMORI H, IKEDA K, et al. Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: Comparison with positron emission tomography[J]. J Thorac Oncol, 2008, 3(4): 358-364. DOI:10.1097/JTO.0b013e318168d9ed |
| [14] |
REITER M J, WINKLER W T, KAGY K E, et al. Dual-energy computed tomography for the evaluation of enhancement of pulmoanary nodules≤3 cm in size[J]. J Thorac Imaging, 2017, 32(3): 189-197. DOI:10.1097/RTI.0000000000000263 |
| [15] |
LIU H, LIU Y, YU T, et al. Usefulness of diffusion-weighted MR imaging in the evaluation of pulmonary lesions[J]. Eur Radiol, 2010, 20(4): 807-815. DOI:10.1007/s00330-009-1629-6 |
| [16] |
AKMAK V, UFUK F, KARABULUT N. Diffusion-weighted MRI of pulmonary lesions: comparison of apparent diffusion coefficient and lesion-to-spinal cord signal intensity ratio in lesion characterization[J]. J Magn Reson Imaging, 2017, 45(3): 845-854. DOI:10.1002/jmri.25426 |
| [17] |
MORI T, NOMORI H, IKEDA K, et al. Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography[J]. J Thorac Oncol, 2008, 3(4): 358-364. DOI:10.1097/JTO.0b013e318168d9ed |
| [18] |
KOYAMA H, OHNO Y, SEKI S, et al. Value of diffusion weighted MR imaging using various parameters for assessment and characterization of solitary pulmonary nodules[J]. Eur J Radiol, 2015, 84(3): 509-515. DOI:10.1016/j.ejrad.2014.11.024 |
| [19] |
HERNETH A M, GUCCIONE S, BEDNARSKI M. Apparent diffusion coefficient: a quantitative parameter for in vivo tumor characterization[J]. Eur J Radiol, 2003, 45(3): 208-213. DOI:10.1016/S0720-048X(02)00310-8 |
| [20] |
潘江峰, 应明亮, 李惠民, 等. 肺结节的3T多b值磁共振扩散加权成像鉴别诊断[J]. 中国医学计算机成像杂志, 2015, 21(6): 533-537. |
| [21] |
DENG Y, LI X, LEI Y, et al. Use of diffusion-weighted magnetic resonance imaging to distinguish between lung cancer and focal inflammatory lesions: a comparison of intravoxel incoherent motion derived parameters and apparent diffusion coefficient[J]. Acta Radiol, 2016, 57(11): 1310-1317. DOI:10.1177/0284185115586091 |
| [22] |
WAN Q, DENG Y S, ZHOU J X, et al. Intravoxel incoherent motion diffusion-weighted MR imaging in assessing and characterizing solitary pulmonary lesions[J]. Sci Rep, 2017, 7(1): 43257. DOI:10.1038/srep43257 |
| [23] |
KONO M, ADACHI S, KUSUMOTO M, et al. Clinical utility of Gd-DTPA enhanced magnetic resonance imaging in lung cancer[J]. J Thorac Imaging, 1993, 8(1): 18-26. DOI:10.1097/00005382-199324000-00004 |
| [24] |
陈子敏, 向子云, 王毅, 等. 三维重建在孤立性肺结节血管集束征的诊断价值[J]. CT理论与应用研究, 2017, 26(1): 69-76. |
| [25] |
OHNO Y, HATABU H, TAKENAKA D, et al. Solitary pulmonary nodules: Potential role of dynamic MR imaging in management initial experience[J]. Radiology, 2002, 224(2): 503-511. DOI:10.1148/radiol.2242010992 |
| [26] |
OHNO Y, NISHIO M, KOYAMA H, et al. Solitary pulmonary nodules: Comparison of dynamic first-pass contrast-enhanced perfusion area detector CT, dynamic first-pass contrast-enhanced MR imaging, and FDG PET/CT[J]. Radiology, 2015, 274(2): 563-575. DOI:10.1148/radiol.14132289 |
| [27] |
焦志云, 杜芳, 何玲, 等. 动态对比增强磁共振成像对肺癌纵隔淋巴结转移的初步研究[J]. 实用肿瘤学杂志, 2021, 35(2): 142-147. |
| [28] |
于荷峰, 吕晓琪, 黄显武, 等. 基于改进Demons算法的三维肺部医学影像配准研究[J]. 计算机应用研究, 2016, 33(4): 1269-1272. DOI:10.3969/j.issn.1001-3695.2016.04.069 |
| [29] |
INGRISCH M, MAXIEN D, SCHWAB F, et al. Assessment of pulmonary perfusion with breath-hold and free-breathing dynamic contrast-enhanced magnetic resonance imaging: quantification and reproducibility[J]. Invest Radiol, 2014, 49(6): 382-389. DOI:10.1097/RLI.0000000000000020 |
| [30] |
COOLEN J, VANSTEENKISTE J, KEYZER F D, et al. Characterisation of solitary pulmonary lesions combining visual perfusion and quantitative diffusion MR imaging[J]. Eur Radiol, 2014, 24(2): 531-541. DOI:10.1007/s00330-013-3053-1 |
| [31] |
YUAN M, ZHANG Y D, ZHU C, et al. Comparison of intravoxel incoherent motion diffusion-weighted MR imaging with dynamic contrast-enhanced MRI for differentiating lung cancer from benign solitary pulmonary lesions[J]. J Magn Reson Imaging, 2016, 43(3): 669-679. DOI:10.1002/jmri.25018 |
| [32] |
NAGEL S N, WYSCHKON S, SCHWARTZ S, et al. Can magnetic resonance imaging be an alternative to computed tomography in immunocompromised patients with suspected fungal infections? Feasibility of a speed optimized examination protocol at 3 Tesla[J]. Eur J Radiol, 2016, 85(4): 857-863. DOI:10.1016/j.ejrad.2016.02.009 |
| [33] |
COOLEN J, VANSTEENKISTE J, KEYZER F, et al. Characterisation of solitary pulmonary lesions combining visual perfusion and quantitative difusion MR imaging[J]. Eur Radiol, 2014, 24(2): 531-541. DOI:10.1007/s00330-013-3053-1 |
| [34] |
杨春山, 肖湘生, 李惠民, 等. 孤立性肺结节质子MR波谱的初步研究[J]. 中华放射学杂志, 2005, 39(1): 17-21. DOI:10.3760/j.issn:1005-1201.2005.01.005 |
| [35] |
贺政, 李光, 张宏伟, 等. 1H磁共振波谱在非小细胞肺癌脑转移放疗疗效评价中的预测价值[J]. 中国医科大学学报, 2017, 46(12): 1095-1100. DOI:10.12007/j.issn.0258-4646.2017.12.009 |
| [36] |
CARAVAN P, ELLISON J J, MCMURRY T J, et al. Gadolinium (Ⅲ) chelates as MRI contrast agents: structure, dynamics, and applications[J]. Chem Rev, 1999, 99(9): 2293-2352. DOI:10.1021/cr980440x |
| [37] |
HENKELMAN R M, STANISZ G J, GRAHAM S J. Magnetization transfer in MRI: a review[J]. NMR Biomed, 2001, 14(2): 57-64. DOI:10.1002/nbm.683 |
| [38] |
PANKOWSKA A, KOCHALSKA K, AZORCZYK A, et al. Chemical exchange saturation transfer(CEST) as a new method of signal obtainment in magnetic resonance molecular imaging in clinical and research practice[J]. Pol J Radiol, 2019, 84: 147-152. DOI:10.5114/pjr.2019.84242 |
| [39] |
CHEN L, WEI Z, CHAN KWY, et al. Protein aggregation linked to Alzheimer's disease revealed by saturation transfer MRI[J]. Neuro Image, 2019, 188: 380-390. |
| [40] |
YAO J, CHAKHOYAN A, NATHANSON D A, et al. Metabolic characterization of human IDH mutant and wild type gliomas using simultaneous pH and oxygen-sensitive molecular MRI[J]. Neuro Oncol, 2019, 21(9): 1184-1196. |
| [41] |
TOGAO O, KESSINGER C W, HUANG G, et al. Characterization of lung cancer by amide proton transfer (APT) imaging: an in-vivo study in an orthotopic mouse model[J]. PLoS One, 2013, 8(10): 77019. DOI:10.1371/journal.pone.0077019 |
| [42] |
OHNO Y, YUI M, KOYAMA H, et al. Chemical exchange saturation transfer MR imaging: preliminary results for differentiation of malignant and benign thoracic lesions[J]. Radiology, 2016, 279(2): 151161. |
| [43] |
OHNO Y, KISHIDA Y, SEKI S, et al. Amide proton transfer-weighted imaging to differentiate malignant from benign pulmonary lesions: comparison with diffusion-weighted imaging and FDG-PET/CT[J]. J Magn Reson Imaging, 2018, 47(4): 1013-1021. DOI:10.1002/jmri.25832 |
 2021, Vol. 19
2021, Vol. 19


