| 内生软骨瘤的影像学诊断 |
2. 郑州大学附属洛阳中心医院影像科,河南 洛阳 4710002;
3. 河南省洛阳市第一人民医院CT/MRI室,河南 洛阳 471002
内生软骨瘤又称中央型软骨瘤或孤立性内生软骨瘤,为良性透明软骨肿瘤[1],是一种起源于软骨内化骨的良性骨肿瘤,以手足短管骨多见[2],四肢长管骨及肩胛骨等不规则骨亦可发生。内生软骨瘤最常见的发病部位是手部短骨,占40%~65%;足部短管状骨不如手部常见,仅占7%;发生于长管状骨的内生软骨瘤,占25%[3-4]。根据发生部位分为髓腔型(起自骨髓腔)和皮质型(起自骨皮质)。根据病灶数目分为单发型和多发型。笔者收集2012年1月至2017年8月河南省洛阳正骨医院收治的经手术和病理确诊的29例内生软骨瘤的影像学资料,现报道如下。
1 资料与方法 1.1 一般资料29例中,男16例,女13例;年龄13~65岁,平均23.8岁;病程1个月~4年,平均11个月。临床表现为轻微疼痛22例,肿胀畸形13例,病理性骨折6例。所有患者均行手术治疗,术后常规送病理学检查。
1.2 仪器与方法25例行X线正位或正侧位片,10例行CT扫描,3例行SPECT-CT扫描,4例行MRI扫描。X线扫描采用美国Kodak公司计算机X线成像(computed radiography,CR)系统。CT扫描采用美国Picker公司PQ2000S螺旋CT,层厚2~5 mm,层距2~5 mm,分别以骨窗和软组织窗进行观察。SPECT-CT扫描采用Siemens Symbia-T6 SPECT-CT图像融合系统对病变区行SPECT断层扫描及同机CT扫描,扫描前3~4 h静脉注射99mTc-MDP 20 mCi,CT扫描层厚1.5 mm,层距0.9 mm,螺距1,使用Siemens Symbia-T6随机图像融合软件进行融合。MRI检查采用美国Marconi公司1.5 T超导MRI成像仪,常规快速自旋回波序列FSE T1WI(TR/TE 600 ms/1.1 ms),脂肪抑制序列T2WI(TR/TE 2 000 ms/90 ms),层厚4.0 mm,层距0.8 mm,矩阵256×256,NEX 2次,FOV 22.0 cm×20.0 cm,对病变部位行冠状位、矢状位、横轴位扫描。
2 结果 2.1 病变部位手足短管骨23例,占79.3%,长管骨4例,占13.8%,肩胛骨2例,占6.9%。单发24例,指骨13例(近节8例,中节3例,末节2例),掌骨5例,肱骨1例,股骨3例,肩胛骨2例;多发5例,掌指骨4例,趾骨1例;髓腔型20例,皮质型9例。
2.2 X线表现X线检查25例中,掌指短管骨20例,病灶表现为囊状透亮区,内有钙化15例,无钙化5例,呈点状、斑片状、簇集团状。肩胛骨2例,表现为膨胀性囊状骨破坏,边界欠清楚,内有斑片状钙化及骨嵴影,病灶区骨皮质变薄甚至溶解消失。肱骨1例,表现为髓腔内条状密度减低影,边界欠清楚,内有散在点状钙化,骨皮质变薄。股骨3例,其中1例表现为髓腔内簇状钙化灶,边界可见;1例表现为类圆形透亮影,边界清晰,围绕环形硬化边,内可见簇状钙化影;1例表现为髓腔内类圆形低密影,边界欠清楚,内有散在斑点状钙化(图 1,2a)。
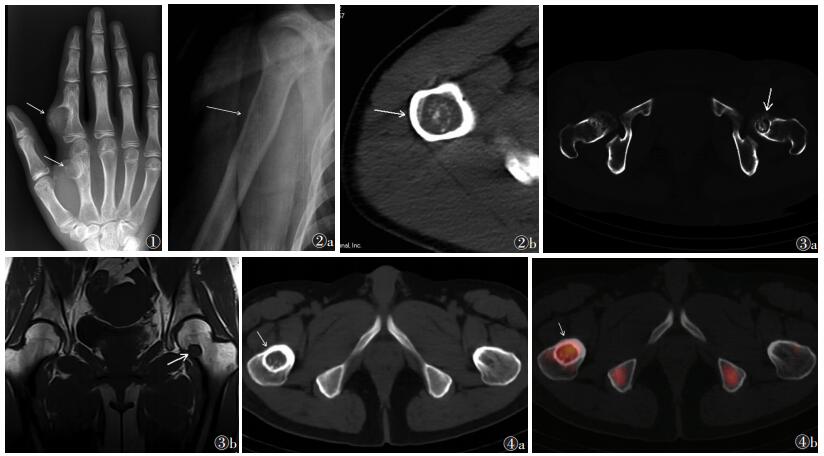 |
| 图 1 男,13岁,右手第2指骨近节及第2掌骨内生软骨瘤(多发)。右手正位X线片显示第2指骨近节中段及第2掌骨远端膨胀性骨破坏影,边界清楚,内可见沙砾样高密度影,周围软组织受压移位(箭头) 图 2 男,47岁,右肱骨上段内生软骨瘤(单发) 图 2a 右肱骨正位X线片显示有肱骨上段轻度膨胀,内显示密度减低影,边界欠清楚,病变区内似可见斑点状高密度影(箭头) 图 2b CT横轴位显示病变区内泥沙样高密度影(箭头) 图 3 女,40岁,左股骨颈内生软骨瘤(单发) 图 3a 骨盆正位X线片显示,左股骨颈内侧类圆形透亮影,边界清楚,边缘薄壁硬化,病灶内团状高密度结节影,密度欠均匀(箭头) 图 3b 冠状位T1WI显示,病变区呈低信号改变,边界清晰(箭头) 图 4 男,40岁,右股骨粗隆间内生软骨瘤(单发) 图 4a CT显示右股骨粗隆间一类椭圆形囊状骨质破坏区,边界清楚,边缘骨质呈环形硬化,其内密度不均,可见泥沙样高密度影(箭头) 图 4b SPECT-CT融合图像示右股骨粗隆间病变区异常放射性核素浓聚(箭头) |
2.3 CT表现
CT检查10例中,短管骨7例,表现为髓腔或皮质内囊状骨破坏,边界清楚,多有硬化带,病灶内有斑点状、沙砾状或斑片状钙化,皮质不同程度的膨胀变薄,呈蛋壳样、筛孔样改变或溶解消失,部分可见骨嵴影,无软组织肿块。肱骨1例表现为肱骨上段髓腔内软组织密度影,CT值40 HU,边界较清楚,内有沙砾样钙化,骨皮质轻度变薄,无明显骨膜反应及软组织肿块影。股骨2例表现为股骨髓腔内有团状不均匀钙化影,无明显骨膜反应及软组织肿块影(图 2b,3a)。
2.4 SPECT-CT表现SPECT-CT检查3例中,股骨2例,肱骨1例,其中1例CT显示右股骨粗隆间类圆形骨质破坏,边界清楚,边缘呈环形硬化,内为沙砾样高密度影,骨皮质规则、光整,未见明显骨膜反应及软组织肿块影(图 4a);其SPECT-CT融合图像显示右股骨粗隆间病灶区呈团状异常放射性核素浓聚(图 4b)。1例CT示右侧股骨下段髓腔内簇状高密度钙化影,其SPECT-CT融合图像示左股骨大粗隆病灶区呈团状异常放射性核素浓聚。1例CT示右肱骨中上段内侧骨皮质呈不规则膨胀性骨质破坏,边界清楚,边缘骨皮质变薄,内见斑点状高密度影,周围骨质硬化,未见明显骨膜反应及软组织肿块影;其SPECT-CT融合图像示病变区未见明显异常放射性核素浓聚。
2.5 MRI表现MRI检查4例均位于长管骨,肱骨表现为髓腔内条带状骨破坏,大小17 mm×95 mm,边界清楚,形态及边缘不规则,病变区信号不均匀,内可见中等T1、长T2信号影,边缘骨皮质略显变薄,周围软组织未见异常信号及骨膜反应。股骨颈表现为股骨颈内侧圆形长T1、长T2混杂信号影,大小13 mm×14 mm,边界清楚,内可见点状低信号影,病灶周围伴低信号环,周围软组织示稍长T2信号影(图 3b)。股骨髁部表现为髓腔内可见类椭圆形长T1信号,边界较清楚,边缘可见扇贝样改变,静脉注射Gd-DTPA增强扫描病灶可见花边样强化影,边界较清楚,其内可见斑片状未强化影。
3 讨论内生软骨瘤是一种起源于软骨内化骨的良性骨肿瘤,病因不明,病程较长,进展缓慢,早期临床表现不典型,可因局部轻微疼痛、无痛性畸形或外伤后病理性骨折就诊。病变好发于掌指骨或趾骨等短管骨,股骨、肱骨等长管骨次之,肩胛骨等不规则骨亦可发病。内生软骨瘤瘤体来源于骺端生长板内发育不良的软骨组织,由软骨细胞和软骨基质组成,软骨细胞排列呈分叶状位于软骨基质的陷窝中,可见黏液样变性、钙化或骨化[5]。
内生软骨瘤早期X线表现多不典型,随着病变进展,出现特征性表现,病灶呈局限性透亮影,表现为圆形、类圆形、条带状或分叶状,其内可有不同程度的钙化,其形态多样,呈点状、沙砾状、斑片状、簇集团状,并可见深入病灶内的骨嵴,病灶区边界清楚或模糊,可环绕以硬化边。资料[4, 6]表明,发生于长骨的内生软骨瘤在X线片上一般不如短骨内生软骨瘤典型,本组发生在短管骨及不规则骨的病灶多膨胀明显,呈扇贝征,骨皮质可呈蛋壳样,甚至部分溶解消失,而长管骨多无明显膨胀,仅骨皮质变薄改变,病变区无骨膜反应及软组织肿块。CT表现呈囊状圆形、类圆形或分叶状软组织密度影,CT值多为30~50 HU,密度等或略低于肌肉,可见典型的斑点状、沙砾状、斑片状钙化,局部骨皮质可轻度变薄或极度膨胀呈蛋壳样,可出现筛孔样变,甚至溶解缺失,病灶边缘光整,围绕高密度硬化边,可见深入病变骨嵴影,增强扫描低密度区稍强化[7],无骨膜反应及软组织肿块。SPECT-CT是以病变部位血供及骨质代谢活跃程度等功能变化为基础,病变部位血供、骨代谢等一旦发生改变,骨显像即可发生异常[8]。在血供丰富、骨代谢活跃区域放射性核素会出现异常浓聚。3例SPECT-CT检查中2例病变区呈异常放射性核素浓聚,提示病变区骨代谢旺盛,病灶处于活跃状态,1例病变区无异常放射性核素浓聚,提示病灶处于稳定静止状态。内生软骨瘤内富含透明软骨基质,水分子含量与黏多糖成分比值很高,形成独特的MRI表现[9],MRI表现为髓腔内圆形、类圆形、条带状异常信号影,边界清楚,围绕长T1短T2低信号环,内信号较混杂,呈不均匀低或等T1、长T2信号,脂肪抑制序列为明显高信号,并混杂点状低信号影,周围可伴软组织水肿,但无软组织肿块。
内生软骨瘤需与以下疾病鉴别:①骨纤维异常增殖症,病灶多位于髓腔内,呈囊状磨玻璃样透亮影,少数有不规则钙化,病灶边界清楚,病变区骨干可弯曲变形,无骨膜反应。②骨囊肿,病灶多为中心性生长,呈卵圆形改变,其长轴多与骨干平行,膨胀较轻,病灶内密度较低且均匀,边界清楚,无硬化边。③上皮样囊肿,病灶多发生于末节指骨远端,呈囊状透亮影,内无钙化,长轴与骨干一致,有不同程度膨胀,骨皮质周围无骨膜反应。④软骨母细胞瘤与内生软骨瘤相似,其内可见钙化,且硬化边包绕。好发于青少年男性,肿瘤多发于四肢长管骨的骨骺区,X线表现为骨骺区溶骨性破坏,周围可见细的硬化缘,少见软组织肿块和病理性骨折。⑤骨梗死,病灶呈圆形、类圆形或不规则地图样硬化斑状影,边界欠清楚。⑥骨巨细胞瘤,多发生在长管骨骨端,为中央或偏心性溶骨性破坏,膨胀明显,可穿越骺线侵及干骺区,病变周围边界清晰,周围可见反应性薄层骨壳,病灶内常见骨脊突入。⑦低度恶性软骨肉瘤,侵袭性强,生长迅速,常见软组织肿块、骨膜反应、骨皮质破坏,病灶范围较大[10]。
综上所述,内生软骨瘤具有典型特征性影像学表现,典型病例X线片结合临床多可明确诊断,CT对其病灶内微小钙化发现率较高[9],MRI可显示病灶内的软骨成分,明确病灶范围,提高诊断准确性,而SPECT-CT能更进一步从分子影像学层面反映病灶的细胞活跃程度,提高诊断的准确性[11],为临床诊疗工作提供更准确有效的诊断依据。
| [1] |
Murphey MD, Flemming DJ, Boyea SR, et al. From thearchives of the AFIP.Enehondroma versus ehondrosareoma in the appendieular skeleton:differentiating features[J]. Radiographics, 1998, 18: 1213-1237. DOI:10.1148/radiographics.18.5.9747616 |
| [2] |
Pieger H, Neuber M, Joosten U, et al. Therapy and prognosis of enchondromen of the hand[J]. Chirurg, 2000, 71: 1152-1155. DOI:10.1007/s001040051193 |
| [3] |
Cohen EK, Kressel HY, Frank TS, et al. Hyaline cartilageorigin bone and soft tissue neoplasms:MR appearance and histologic correlation[J]. Radiology, 1988, 167: 477-481. DOI:10.1148/radiology.167.2.3162774 |
| [4] |
Wang XL, De Beuckeleer LH, De Schepper AM, et al. Low-grade chondrosarcome vs enchondroma challenges in diag-nosis and management[J]. Eur Radiol, 2001, 6: 1054-1057. |
| [5] |
刘子君. 骨关节病理学[M]. 北京: 人民卫生出版社, 2000: 115172.
|
| [6] |
刘菲, 史新乐, 赵小龙, 等. 儿童内生软骨瘤影像学表现及病理学特点讨论[J]. 中国CT和MRI杂志, 2016, 19(9): 9-12. DOI:10.3969/j.issn.1672-5131.2016.09.003 |
| [7] |
陈亚玲, 刘玉珂, 郭树农, 等. 单发内生软骨瘤的X线及CT诊断[J]. 中医正骨, 2007, 19(11): 15-16. DOI:10.3969/j.issn.1001-6015.2007.11.007 |
| [8] |
张斌青, 陈亚玲, 张敏, 等. 应用图像融合技术诊断骨肿瘤[J]. 中医正骨, 2010, 22(11): 22-26. DOI:10.3969/j.issn.1001-6015.2010.11.007 |
| [9] |
Hopyan S, Gokgoz N, Pooh B. A mutant PTH/PTHrP type 1 receptor in enchondromatosis[J]. Nature Genetics, 2002, 11: 306-3l. |
| [10] |
周建功, 袁小东, 马小龙, 等. 长骨中心型Ⅰ级软骨肉瘤与内生软骨瘤的影像鉴别诊断[J]. 中华放射学杂志, 2015, 48(11): 926929. |
| [11] |
张笑瑄, 郭梓恒, 赵文川, 等. 多发内生软骨瘤病1例[J]. 中国骨伤, 2016, 29(6): 573-575. DOI:10.3969/j.issn.1003-0034.2016.06.019 |
 2018, Vol. 16
2018, Vol. 16


