| 动脉自旋标记技术在评估缺血性脑卒中患者脑血流量中的应用 |
缺血性脑卒中占脑卒中的65%~80%[1]。脑细胞一旦坏死便不可再生,因此,脑卒中致死、致残率高,常导致患者生活质量降低。若能在脑梗死前期提前发现,及时干预治疗,可降低缺血性脑卒中的发生率。目前,对脑梗死的诊断多为定性诊断,且均在脑梗死后发现。自旋标记技术(ASL)能测出局部脑组织的脑血流量(CBF)值,并根据CBF值判断该区域大脑是否存在血流灌注异常,及时干预,避免脑梗死发生。本研究探讨ASL对CBF的评估能力,以期为提高对脑梗死前期诊断率提供帮助。
1 资料与方法 1.1 一般资料选择我院2016年4—9月收治的缺血性脑卒中患者21例,均行MRI检查。其中男15例,女6例;年龄31~86岁,平均(59.51±5.33)岁。DWI高信号证实脑卒中19例,其中急性脑卒中(发病 < 3 d)6例,亚急性脑卒中(发病 < 2周)13例。短暂性脑缺血发作(transinent ischemi attack,TIA)2例。所有患者检查前均签署知情同意书。
1.2 纳入及排除标准① TIA组标准,TIA发作者,排除既往大面积脑梗死或处于脑梗死恢复期、脑出血。②脑卒中组标准,为急性期(< 3 d)和亚急性期(< 2周)的缺血性脑卒中患者。排除大面积脑梗死、脑梗死恢复期、脑出血、体内装有金属异物、有幽闭恐惧症、安装心脏起搏器及支架者。
1.3 仪器与方法采用GE Discovery 750 3.0 T MRI扫描仪、头颅专用的32通道线圈。患者取仰卧位,头先进,耳内塞棉花球。采集图像包括T1WI、T2WI、FLAIR、DWI、ASL、3D-T1和3D-TOF-MRA序列图像,扫描基准线为前后联合连线水平。扫描参数:轴位T1 FLAIR TR 1 902 ms,TE 24 ms,层数16,层厚6 mm,层距2 mm,FOV 24 cm×24 cm,NEX为1,矩阵320×224。轴位T1WI TR 9 000 ms,TE 128 ms,层数16,层厚6 mm,层距2 mm,FOV 24 cm×24 cm,NEX为1,矩阵256×256。DWI TR 3 800 ms,TE 1 ms,层数16,层厚6 mm,层距2 mm,FOV 24 cm× 24 cm,NEX为1,矩阵160×160。3D-ASL TR 4 938 ms,TE 10.5 ms,层厚4 mm,FOV 24 cm×24 cm,NEX为3,矩阵320×224。3D-T1 TR 8.2 ms,TE 3.2 ms,层厚1.2 mm,FOV 24 cm×24 cm,NEX为1,矩阵256×256。3D-TOF-MRA:TR 21 ms,TE 2.5 ms,层厚1.4 mm,FOV 22 cm×19 cm,NEX为1,矩阵320×256。
1.4 图像分析运用ADW 4.6后处理工作站、Funtool软件,自动生成ASL-CBF伪彩图像,利用3D-T1序列与伪彩图像相匹配,观察图像,取病灶最大平面,人工手动勾画出与灌注异常区域一致的ROI,由软件自动测量ROI的CBF值。测量时应尽可能避免大血管、脑沟池及脑室等结构,由2位有经验的诊断医师对所得的CBF、DWI及MRA图像进行分析。
1.5 统计学方法采用SPSS 21.0软件分析所得数据,计量资料以x±s表示。病灶中心区和对侧相应区域两侧CBF值比较行配对t检验。以P < 0.05为差异有统计学意义。
2 结果脑卒中19例(图 1,2),其中血管正常4例,颈内动脉狭窄、闭塞硬化4例,大脑前动脉狭窄2例,大脑中动脉狭窄闭塞9例。TIA 2例(图 3)。
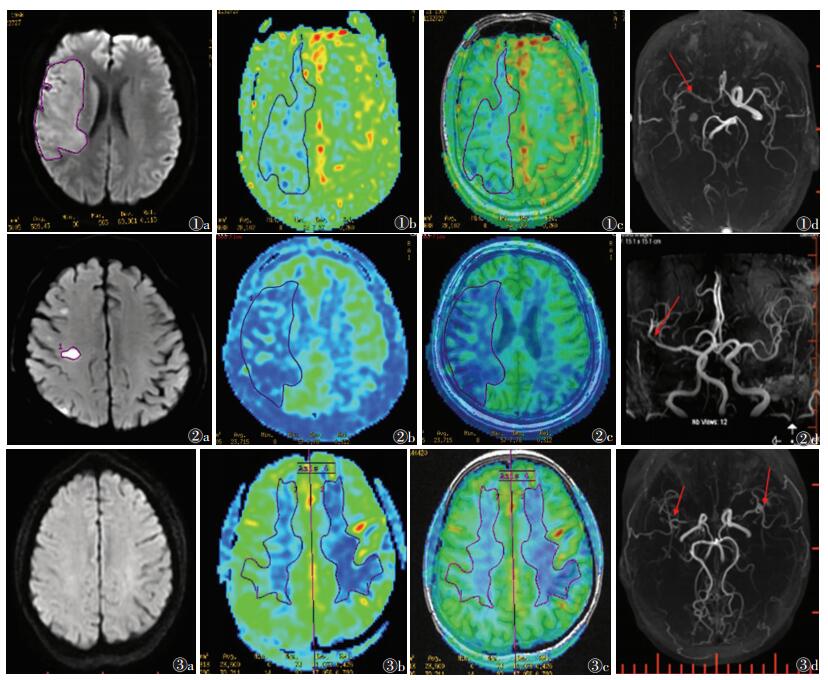 |
| 图 1 男,64岁,急性脑卒中 图 1a DWI示右侧额顶叶斑片状高信号影 图 1b,1c 自旋标记技术-脑血流量图(ASL-CBF)及ASL与3D-T1匹配图像,ASL可见右侧额顶叶灌注较左侧明显减低 图 1d MRA示右侧大脑中动脉远段以及右侧前交通动脉局部血管血栓形成,管腔狭窄(箭头) 图 2 男,50岁,亚急性脑卒中 图 2a DWI示右侧侧脑室旁大片稍高信号影 图 2b,2c ASL-CBF及ASL与3D-T1匹配图像,ASL可见右侧半卵圆区较左侧灌注明显减低 图 2d MRA示右侧大脑中动脉管腔稍细,显影较左侧欠佳(箭头) 图 3 女,48岁,短暂性脑缺血发作 图 3a DWI未见异常表现 图 3b,3c ASL-CBF及ASL与3D-T1匹配图像,ASL示左侧额顶叶白质区灌注较右侧明显减低区 图 3d MRA可见左右侧大脑中动脉M1段血栓形成,管腔狭窄,周围多发小吻合血管(箭头) |
脑卒中病灶中心区的CBF平均值为(24.4±1.81)mL·(min·100 g)-1,对侧相应区的CBF平均值为(38.67±3.07)mL·(min·100 g)-1,差异有统计学意义(P=0.00)。其中17例ASL示病灶面积大于DWI,2例ASL显示病灶面积小于DWI(图 1,2)。
3 讨论脑供血的多少可定量的用CBF。CBF是指一定时间内流经定量脑组织的血流量。一般正常人CBF值为50 mL·(min·100 g)-1。当CBF < 正常人的50%[CBF值=25 mL·(min·100 g)-1]时,即出现临床症状,当CBF>正常人的50%,且又达不到正常时,尽管局部大脑供血不足,但未出现任何临床症状[2]。TIA是颈动脉或椎-基底动脉系统发生短暂性血液供应不足,引起局灶性脑缺血导致突发、短暂性、可逆性神经功能障碍。有学者[3]报道,TIA患者发生脑卒中的概率比普通人显著增加。
ASL是通过标记成像层面的血液从而使自旋弛豫状态发生改变,等被标记血液全部灌注到组织后开始扫描,可得到既包含组织又包含组织内标记血液的图像,叫做标记像。不对成像层面的血液标记进行扫描成像,得到包含组织和组织内未标记血液的图像,称为非标记像。标记像和非标记像之间的差值为灌注像,即CBF图[4]。ASL不仅可反映大脑血流动力学状态,分析大脑血流灌注的情况,还可定量评估CBF。ASL不仅能显示大脑灰质和白质的灌注不同,还能显示脑卒中和TIA患者缺血区与正常区域的血流灌注不同,有利于确定病灶的部位和大小[5]。有学者[6]报道,30例缺血性脑卒中患者分别行动态磁敏感对比增强灌注成像(DSC-PWI)和ASL扫描,两者结果比较,具有一致性。但PWI-CBF比ASL-CBF显示的面积小,可能是由于ASL以自体血为示踪剂,磁化标记的质子T1非常短,导致延迟的动脉易被采集[7-8]。也有学者[9]研究表明,ASL测量正常人的CBF值与PET脑血流灌注成像所测量的CBF值具有很强的一致性,并认为两者在评估血流灌注是否异常方面的准确性相同。
本研究灌注异常区CBF平均值为(24.42±1.81)mL·(min·100 g)-1,对侧为(38.67±3.07)mL·(min·100 g)-1,两者比较差异有统计学意义(P < 0.05)。这可能是由于灌注异常区脑细胞缺血坏死,CBF值较健侧明显降低[10]。生理学研究[11]认为正常CBF值>50 mL·(min·100 g)-1;当CBF值< (18±2)mL·(min·100 g)-1时,脑血氧供应水平较低,脑细胞损害具有可逆性。当CBF为(10±2)mL·(min·100 g)-1时,脑细胞已发生水肿、坏死,坏死不可逆[12]。ASL所测量的CBF值与大脑的生理CBF虽存在不同,但ASL可反映脑血流的状态,与CBF的高低具有明确的匹配关系,根据大脑左右两侧的对比可反映出脑血流灌注是否存在异常。
本研究中,17例病灶在DWI上的面积比ASL灌注异常区面积小,说明这些区域的血供降低,但脑细胞还能代偿存活,未发生缺血、缺氧坏死,即缺血半暗带(ischemic penumbra,IP)[13]。本研究17例存在IP,而根据MRA显示的血管狭窄对溶栓进行评估是不准确的,即使血管硬化狭窄,但也可能有丰富的侧支循环提供大脑的供血,所以血管狭窄未必会引起脑细胞缺血、缺氧坏死。若MRA显示局部有硬化、狭窄、闭塞,对应的ASL显示的CBF值降低,且CBF降低区的面积>DWI的面积,则说明存在IP,可进行溶栓治疗;若ASL显示的CBF值无变化甚至增加,且CBF降低区的面积≤DWI的面积,则说明不存在IP,不能进行溶栓治疗,否则有可能导致脑出血。本研究2例亚急性期脑卒中ASL所显示的面积比DWI上的小,考虑原因是脑卒中发生后,及时的治疗、溶栓再通及侧支循环形成导致的再灌注,使得局部CBF逐渐增加,且IP开始减少,而缺血坏死的脑细胞和周围血管源性水肿在DWI上仍表现为高信号,从而导致DWI面积大于ASL,此时若进行溶栓治疗,则脑出血的可能性增加。因此,ASL联合DWI和MRA提高了脑卒中的诊断和早期治疗的准确性,有助于治疗方案的选择,尤其是有助于判断是否进行溶栓。
本研究的不足:由于急性脑卒中发病时间短,很难在有效时间内监测到,因此本研究的样本量较少,且TIA仅2例,无法通过大样本数据预测具体的CBF临界值。部分患者已进行治疗干预,对研究结果可能会有一定影响。
| [1] |
胡大一, 郭艺芳. 2010年美国心脏协会/美国脑卒中协会脑卒中一级预防指南要点介绍[J]. 中华高血压杂志, 2011, 19(4): 301-304. |
| [2] |
金红瑞, 嵇鸣, 叶春涛. 3.0 T磁共振ASL技术在缺血性脑血管疾病中的应用研究[J]. 上海医学影像, 2011, 20(1): 69-72. |
| [3] |
Kokubo Y. Epidemiology of transient ischemic attack[J]. Front Neurol Neurosci, 2014, 33: 69-81. |
| [4] |
Hendrikse J, van Osch MJ, Rutgers DR, et al. Internal carotid artery occlusion assessed at pulsed arterial spin-labeling perfusion MR imaging at multiple delay times[J]. Radiology, 2004, 233: 899-904. DOI:10.1148/radiol.2333031276 |
| [5] |
刘素兰, 赵斌, 王光彬, 等. DWI、MRA和FAIR灌注成像在早期脑缺血中的诊断价值[J]. 实用放射学杂志, 2008, 24(4): 433-436. |
| [6] |
Zhang SX, Yao YH, Zhang S, et al. Comparative study of DSC-PWI and 3D-ASL in ischemic stroke patients[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35: 923-927. DOI:10.1007/s11596-015-1529-8 |
| [7] |
张水霞, 张顺, 姚义好, 等. 3D-ASL与DSC-PWI在缺血性脑梗死患者中的对比研究[J]. 放射学实践, 2014, 29(8): 901-905. |
| [8] |
郝敬波, 鹿彩銮, 时宏娟, 等. 多模式磁共振灌注技术在急性缺血性脑梗死患者脑血流灌注状态诊断中的应用[J]. 脑与神经疾病杂志, 2015, 23(6): 412-417. |
| [9] |
孟亮亮, 邹颖, 张晓东, 等. MRI测量正常人脑氧摄取分数[J]. 中国医学影像技术, 2011, 27(11): 2175-2179. |
| [10] |
姜曼, 李传富. 动脉自旋标记技术在颅脑疾病诊断及功能研究中的应用进展[J]. 中国中西医结合影像学杂志, 2016, 14(2): 223-226. |
| [11] |
王爽, 杨弋. 脑血流自动调节概述及其在脑血管疾病中的应用[J]. 中风与神经疾病杂志, 2014, 31(11): 1049-1052. |
| [12] |
丁新生, 冯美江. 缺血性卒中的病理生理学机制与细胞凋亡[J]. 国际脑血管病杂志, 2006, 14(1): 5-10. |
| [13] |
Parsons MW, Pepper EM, Bateman GA, et al. Identification of the penumbra and infarct core on hyperacute noncontrast and perfusion CT[J]. Neurology, 2007, 68: 730-736. DOI:10.1212/01.wnl.0000256366.86353.ff |
 2018, Vol. 16
2018, Vol. 16


