| 肺结节影像检查技术 |
随着肺癌筛查的开展,肺内结节的检出率也随之升高。传统的数字X线摄影对胸部病变的筛查、诊断及随访仍有重要价值,但已无法满足对肺结节的细节观察。随着影像检查技术的开展,各种参数的CT检查、多序列的MRI检查及PET-CT检查能为肺结节的发现、鉴别诊断和处理提供更多支持。
1 肺结节概述 1.1 定义肺内结节可多发,也可单发。孤立性肺结节定义为直径<3 cm的肺内圆形、类圆形或不规则形异常密度影,边界清或不清,周围完全被含气肺组织包绕[1]。
1.2 分类① 根据大小可分为结节、小结节、微小结节和粟粒结节。结节直径1~<3 cm,小节结直径0.5~<1 cm,微小结节直径0.3~<0.5 cm,粟粒结节直径<0.3 cm。②根据密度可分为实性结节和亚实性结节[2]。实性结节一般为软组织成分,亦可包含脂肪、钙化及坏死等多种密度。亚实性结节包含磨玻璃密度,即为CT值轻度增加的区域,表现为絮状或云雾状,其中可见正常的肺实质、气管及血管等结构。影像学上根据亚实性结节在纵隔窗是否有软组织成分,将其分为2类:纯磨玻璃密度结节(pure ground-glass nodule,pGGN)和混合磨玻璃密度结节(mixed ground glass nodule,mGGN)。pGGN不包含实性成分,而mGGN既有磨玻璃密度部分,也有实性部分。
2 影像技术 2.1 MSCTMSCT成像参数通常包括螺距、管电压、管电流及扫描野。螺距为球管旋转1周扫描床移动的距离与准直器宽度的比值。管电压和管电流分别决定X线的硬度和光子数量,增大管电压(kV)可增加X线的穿透力,相同kV下扫描,在满足影像质量的前提下应尽可能减小CT剂量指数(CT dose index,CTDI),增大管电流(mAs)可使辐射剂量增加。扫描野又称有效视野,通过缩小扫描野对病灶进行靶扫描,对病灶细节显示更佳。
2.1.1 平扫MSCT通过提高空间和对比度分辨力、减少重合失调伪影,提高检测肺结节的敏感度和特异度,并对亚实性肺结节提供更准确的细节特征,现已广泛应用于临床。常规平扫采用120 kV,250 mAs可基本满足临床需求。管电压和CTDI对CT值影响较大[3],因此,监测病灶强化程度时,需注意保持多次检查的扫描参数一致。
高分辨率CT(high resolution computer tomography,HRCT)通过薄层扫描及高分辨算法重建获得容积扫描数据,可行MPR、CPR、MIP或MinIP、表面遮盖(surface shaded display,SSD)和VR等后处理[4]。靶扫描采用小视野,可更精确地显示结节边界,通常以病灶为中心,向周围扩大3 cm(图 1a~1c);重建矩阵512×512,层厚1 mm,层距1 mm[5]。为更加清晰显示肺内亚实性结节,可采用超高分辨率靶扫描,扫描参数:120 kV,300 mA,准直0.625 mm×64,螺距0.64,扫描时间1~3 s,重建层厚0.8~1 mm,重建层距0.4~0.5 mm,滤过函数F,视野180 mm×180 mm,图像扫描及重建矩阵均为1 024×1 024(图 2)。胸部CT检查常规采用仰卧位,位于背侧胸膜下的病灶可能因重力所致的坠积效应影响观察;李鲁等[6]提出了生理通气G方案,即患者取侧、斜侧或俯卧位时,使病灶尽量位于扫描肺野高处(通过呼吸生理使得病灶及其周围背景尽可能充气),扫描定位像时视角90°。
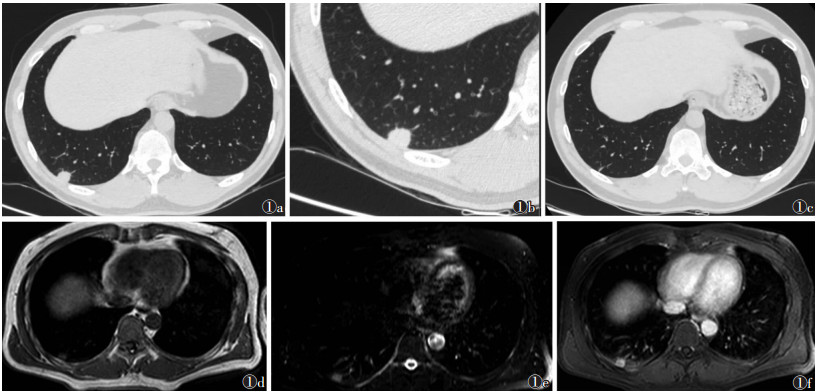 |
| 图 1 男,40岁,胸部CT示右肺下叶胸膜下实性小结节影 图 1a 薄层 1 mm 层厚扫描,可清晰显示结节 图 1b 靶扫描,结节边缘细节清晰显示 图 1c 薄层 1 mm 层厚扫描,抗感染治疗后结节吸收 图 1d~1f 分别为 MRI T1WI、T2WI-SPIR、T1WI 增强扫描图像。结节 T1WI 呈等信 号,T2WI 呈稍高信号,增强扫描明显强化 |
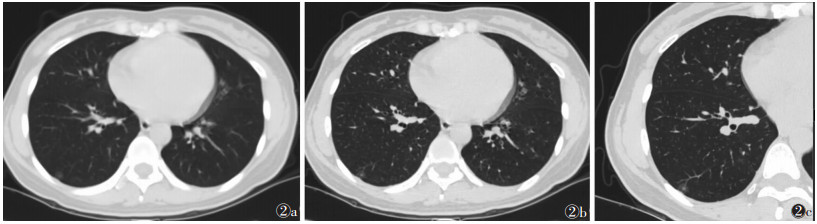 |
| 图 2 女,45岁,胸部CT示右肺下叶胸膜下磨玻璃密度结节影。术后病理:原位癌 图 2a 常规 5 mm 层厚扫描,可见磨玻璃病灶,但边界及内部结构显示不清 图 2b 薄层 1 mm 层厚扫描,结节边界及内部结构可显示 图 2c 超高分辨率 靶扫描,结节边界及内部结构清晰可见 |
随着肺癌筛查的开展,受检者接受辐射的剂量增多。低剂量CT(low-dose computed tomography,LDCT)应运而生,主要通过降低管电流来降低辐射剂量,通常采用120 kV,40~100 mAs(智能D-right)。然而,LDCT的图像噪声水平提高,图像质量下降,进而影响诊断,采用迭代重建算法可有效降低图像噪声,使图像在满足筛查需求的同时降低辐射剂量[7]。研究[8]表明,在当前胸部LDCT检查中,对于结节内实性成分的存在和大小,在观察者之间和观察者内部可达成中度共识,不会对结节的临床策略产生差异。
2.1.2 增强扫描CT增强扫描是通过静脉注射水溶性有机碘对比剂后进行扫描,以观察病灶的动脉血供或组织灌注的显影技术。
常规增强扫描是在注入对比剂后,按普通扫描方法进行扫描,可显示含实性成分结节的血供情况,观察结节内部的血管走行,有助于结节的诊断。日常临床工作中通常在开始注入对比剂后25、75 s行增强扫描,获得动脉期和静脉期图像,初步判断病灶的动脉血供和组织灌注。
动态增强扫描是在开始注入对比剂后连续多次对结节进行扫描,以获得结节的强化模式、强化峰值及动态增强扫描曲线等信息(图 3)。国内一项研究[9]表明,肺癌以不均匀强化或周边强化为主,强化的实体部分厚薄不一,周边强化区的内缘不规则;结核球以不强化或内缘规则的薄壁周边强化为主;炎性结节以不均匀强化为主。国外亦有多中心研究[10]表明,恶性结节CT值可增加20 HU以上,而CT值增加少于15 HU的结节良性可能性较大。
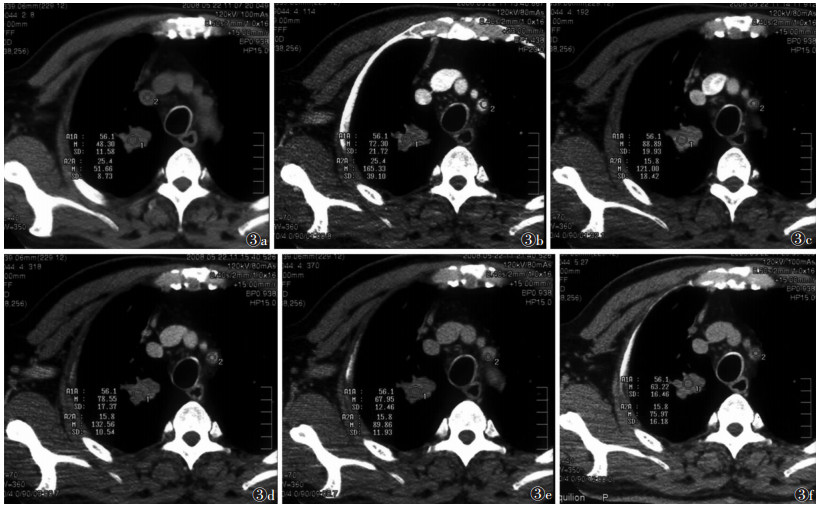 |
| 图 3 男,63岁,反复咳嗽,咳痰3个月余。胸部CT示右上肺中央型肺癌伴远端阻塞性肺炎,术后病理:右肺浸润性鳞状细胞癌Ⅱ级 图 3a 病 灶中心层面平扫纵隔窗影像,CT 值为 48.30 HU 图 3b~3f 分别为病灶与平扫相同平面动态增强扫描各期图像(注入对比剂后 30 s、1 min、2 min、8 min、15 min),CT 值分别为 72.30、88.89、78.88、67.95、63.22 HU,病灶注入对比剂后明显强化,1 min 出现强化峰值,随后强化程度减弱,病 灶内强化不均匀 |
CTPI成像是在注入对比剂后连续快速扫描(通常间隔1 s)及延迟扫描,以获取灌注值、血容量、平均通过时间、表面通透性及对比剂廓清率等多个参数。强化净增值受心输出量等影响,而灌注成像参数很大程度上不受对比剂、心输出量及患者体质量的影响,更能反映病变本质[11]。
2.2 MRI检查MRI检查由于肺内氢质子含量少、多个空气-组织界面导致的敏感性伪影,以及呼吸和心血管运动伪影等客观因素,目前不作为肺结节检出的首选方式。但随着硬件及序列设计的优化,其在结节诊断方面仍取得了重大进展(图 1d~1f)。
肺部常用序列有T1加权三维梯度回波容积内插屏气呼吸检查(T1-VIBE)、T1加权反相位(T1-out-of-phase)、T1加权梯度回波(T1-GRE)、T2-FSE、T2加权快速自旋回波脂肪抑制序列(T2-SPIR)、T2-STIR、2D-半傅里叶采集单次激发自旋回波序列(T2-HASTE)、超短时回波时间(UTE)、DWI等。1.5 T和3.0 T MRI上各种序列的结节检出率或敏感度在45.5%~96.0%,自旋回波序列的检出率或敏感度优于梯度回波序列,目前研究[12]普遍认为MRI对直径≥8 mm的结节的检出率达100%。研究[13]报道采用放射状K空间填充的自由呼吸容积内插序列(radial VIBE)对直径≥6 mm的结节检出率可达100%。
MRI定量分析包括动态增强扫描、DWI和MRS等序列,分别评估病灶的血流灌注、水分子扩散及肺结节的代谢,为结节的诊断提供更多定量信息。MRI动态增强扫描一般采用2D SE、turbo SE序列或各种类型的2D或3D GRE序列,通过注入对比剂后各多次采集、选择ROI测量并勾画TIC,计算出最大相对强化率和强化斜率,评估结节的强化模式或血液供应。研究[14]表明,恶性及感染性结节的MRI动态指数明显高于良性结节,但仅将结节分为两类,对于恶性和感染性结节的进一步鉴别仍需其他检查。DWI通过ADC值或病变与脊髓比率之间的信号强度比率评估组织内水分子的扩散,已成为结节检测和/或评估的新方法,如DWI在肺腺癌亚型分类中的应用[15]。在3.0 T多b值DWI的研究中,b值为900 s/mm2时的ADC值诊断效能较高,恶性结节的ADC值显著低于良性结节[16]。MRS可显示结节内的代谢情况,但该方面的研究较少。研究[17]表明,肺恶性结节相对于良性结节具有更高的胆碱峰、胆碱峰/肌酸峰比值,可出现异常的乳酸峰等。
2.3 PET-CT用氟18标记的氟脱氧葡萄糖(18F-FDG)PET进行功能成像可评估葡萄糖代谢的情况(图 4)。受检者检查前需空腹6 h以上,且血糖控制在正常水平(<7.8 mmol/L),静脉注射18F-FDG 0.10~0.15 mCi/kg体质量,休息45~60 min后开始全身扫描。采用TrueX+TOF法重建图像,获得横断面、矢状面及冠状面的PET图像、CT图像及PET-CT融合图像。标准化摄取值(SUV)阈值2.5已被用于区分良恶性结节,但仍需注意感染性结节的假阳性结果[18]。PET-CT既可测量结节的代谢情况,又可清晰显示结节形态和边界,在结节检测和评估方面均有优势,在一项将PET-CT和MSCT评估孤立性肺结节的研究中,PET-CT比MSCT更敏感(96% vs. 81%)、更准确(93% vs. 85%)[19]。但使用CT进行PET图像的衰减校正会引入伪影和定量误差,并可能导致对结果的误解,如获取患者不同呼吸周期的图像可能会导致屏气期间获得的CT衰减数据与安静潮气呼吸期间获得的PET数据之间不匹配[20]。另外,PET的空间分辨力也很有限,在评估亚实性结节及直径小于10 mm的实性结节时,可能导致假阴性结果[21]。
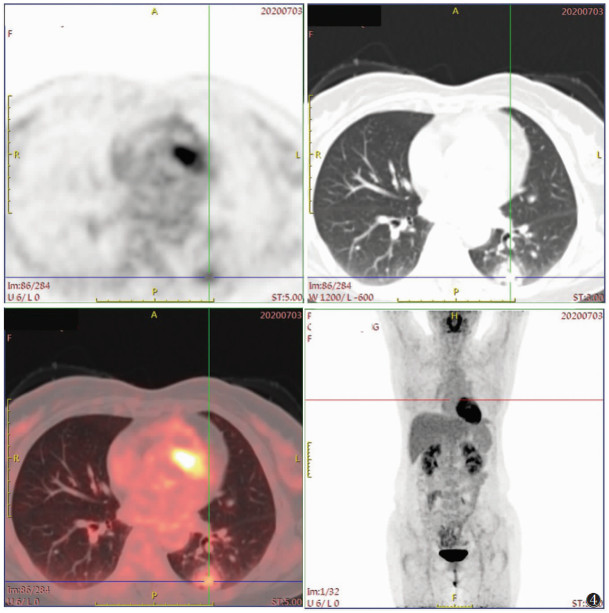 |
| 图 4 女,61岁,体检发现肺结节,术后病理:浸润性黏液腺癌。PET-CT示左肺下叶结节,边界欠清,其内密度不均,最大标准化摄取值(SUVmax)为3.6 |
3 总结
影像技术的发展日新月异,双能CT、PET-MRI在肺部的应用日臻成熟,多种影像技术的综合运用有助于诊断医师完成更精准的肺结节影像评价,结合患者的临床信息,能够为结节的筛查、随访和治疗提供策略。
| [1] |
HANSELL D M, BANKIER A A, MACMAHON H, et al. Fleischner Society:glossary of terms for thoracic imaging[J]. Radiology, 2008, 246(3): 697-722. DOI:10.1148/radiol.2462070712 |
| [2] |
HENSCHKE CI, YANKELEVITZ DF, MIRTCHEVA R, et al. CT screening for lung cancer:frequency and significance of part-solid and nonsolid nodules[J]. AJR Am J Roentgenol, 2002, 178(5): 1053-1057. DOI:10.2214/ajr.178.5.1781053 |
| [3] |
朱明, 刘贵霞, 李敬玉. CT扫描参数对CT值影响因素的实验研究[J]. 中国中西医结合影像学杂志, 2017, 15(4): 473-475. DOI:10.3969/j.issn.1672-0512.2017.04.029 |
| [4] |
LACOUT A, MARCY PY, NGO TM, et al. Multidetector row CT scan in hypersensitivity pneumonitis:contribution of minimum intensity projection reformation[J]. J Med Imaging Radiat Oncol, 2011, 55(3): 291-295. DOI:10.1111/j.1754-9485.2011.02267.x |
| [5] |
李惠民, 肖湘生, 刘士远. 螺旋CT靶扫描对肺部小结节的诊断价值[J]. 临床放射学杂志, 2001, 20(6): 424-427. DOI:10.3969/j.issn.1001-9324.2001.06.006 |
| [6] |
李鲁, 李惠民, 舒锦尔, 等. 生理通气辅助超高分辨率CT扫描技术探讨[J]. 中国医学计算机成像杂志, 2015, 21(3): 228-231. |
| [7] |
张丽, 于红, 刘士远, 等. 迭代重建技术对低剂量肺部平扫CT图像质量的影响[J]. 中华放射学杂志, 2013, 47(4): 316-320. DOI:10.3760/cma.j.issn.1005-1201.2013.04.006 |
| [8] |
VAN RIEL S J, SANCHEZ C I, BANKIER A A, et al. Observer variability for classification of pulmonary nodules on low-dose CT images and its effect on nodule management[J]. Radiology, 2015, 277(3): 863-871. DOI:10.1148/radiol.2015142700 |
| [9] |
李相生, 肖湘生, 李惠民. 孤立性肺结节的CT动态增强模式的诊断价值[J]. 中国医学计算机成像杂志, 2000, 6(6): 383. DOI:10.3969/j.issn.1006-5741.2000.06.007 |
| [10] |
SWENSEN S J, VIGGIANO R W, MIDTHUN D E, et al. Lung nodule enhancement at CT:multicenter study[J]. Radiology, 2000, 214(1): 73-80. DOI:10.1148/radiology.214.1.r00ja1473 |
| [11] |
李慎江, 肖湘生, 刘士远, 等. 肺结节的不均匀灌注[J]. 中华放射学杂志, 2008, 42(8): 862-865. DOI:10.3321/j.issn:1005-1201.2008.08.018 |
| [12] |
NAIDICH D P, BANKIER A A, MACMAHON H, et al. Recommendations for the management of subsolid pulmonary nodules detected at CT:a statement from the Fleischner Society[J]. Radiology, 2013, 266(1): 304-317. DOI:10.1148/radiol.12120628 |
| [13] |
党珊, 师卫华, 段海峰, 等. 放射状K空间填充的自由呼吸容积内插序列对周围型实性肺占位形态学征象的显示价值[J]. 磁共振成像, 2018, 9(10): 754-758. DOI:10.12015/issn.1674-8034.2018.10.007 |
| [14] |
OHNO Y, HATABU H, TAKENAKA D, et al. Solitary pulmonary nodules:potential role of dynamic MR imaging in management initial experience[J]. Radiology, 2002, 224(2): 503-511. DOI:10.1148/radiol.2242010992 |
| [15] |
KOYAMA H, OHNO Y, AOYAMA N, et al. Comparison of STIR turbo SE imaging and diffusion-weighted imaging of the lung:capability for detection and subtype classification of pulmonary adenocarcinomas[J]. European Radiology, 2010, 20(4): 790-800. DOI:10.1007/s00330-009-1615-z |
| [16] |
潘江峰, 应明亮, 李惠民, 等. 肺结节的3T多b值磁共振扩散加权成像鉴别诊断[J]. 中国医学计算机成像杂志, 2015, 21(6): 533-537. |
| [17] |
杨春山, 肖湘生, 李惠民, 等. 孤立性肺结节质子MR波谱的初步研究[J]. 中华放射学杂志, 2005, 39(1): 17-21. DOI:10.3760/j.issn:1005-1201.2005.01.005 |
| [18] |
GOULD M K, MACLEAN C C, KUSCHNER W G, et al. Accuracy of positron emission tomography for diagnosis of pulmonary nodules and mass lesions:a meta-analysis[J]. JAMA, 2001, 285(7): 914-924. DOI:10.1001/jama.285.7.914 |
| [19] |
YI C A, LEE K S, KIM B T, et al. Tissue characteriza-tion of solitary pulmonary nodule:comparative study between helical dynamic CT and integrated PET/CT[J]. J Nucl Med, 2006, 47(3): 443-450. |
| [20] |
BEYER T, ANTOCH G, BLODGETT T, et al. Dual-modality PET/CT im-aging:the effect of respiratory motion on combined image quality in clinical oncology[J]. Eur J Nucl Med Mol Imaging, 2003, 30(4): 588-596. DOI:10.1007/s00259-002-1097-6 |
| [21] |
NOMORI H, WATANABE K, OHTSUKA T, et al. Evaluation of F-18 fluorode-oxyglucose (FDG) PET scanning for pulmonary nodules less than 3 cm in diameter, with special reference to the CT images[J]. Lung Cancer, 2004, 45(1): 19-27. DOI:10.1016/j.lungcan.2004.01.009 |
 2021, Vol. 19
2021, Vol. 19


