| 多因素Logistic回归分析评价MSCT鉴别甲状腺良恶性结节的价值 |
2. 郑州大学附属郑州中心医院放射科,河南 郑州 450000
甲状腺癌是内分泌系统最常见的恶性肿瘤,占内分泌系统肿瘤的95%以上,也是头颈部最常见的恶性肿瘤,因发病隐匿患者早期自觉症状多不明显,导致临床早期诊断率较低,易发生误诊和漏诊[1]。目前诊断方法主要有超声、CT及MRI,近年来随着MSCT的广泛应用,CT增强扫描不仅可显示原发肿瘤的甲状腺外侵犯,如咽喉、气管、食管、喉返神经和大血管等,还可评价咽旁淋巴结、颈部及纵隔淋巴结是否存在转移灶,与超声相比具有不受邻近骨、空气、钙化或操作者缺乏经验干扰等优势[2-3]。本研究对甲状腺良恶性结节的CT特征行Logistic回归分析,探讨MSCT在鉴别甲状腺良恶性结节中的诊断价值。
1 资料与方法 1.1 一般资料选取2018年1月至2019年10月在郑州大学附属郑州中心医院经超声引导下细针穿刺活检或术后病理确诊的甲状腺结节87例(104个结节),其中男23例,女64例。良性组44例(52个结节),男13例,女31例;年龄19~90岁,平均(48.19±7.98)岁;结节最大径0.8~3.5 cm,平均(1.79±0.83)cm;其中结节性甲状腺肿34个、腺瘤性结节性甲状腺肿11个、结节性甲状腺肿合并腺瘤性结节性甲状腺肿3个、甲状旁腺腺瘤4个,合并桥本甲状腺炎4个、合并亚急性甲状腺炎2个。恶性组43例(52个结节),男10例,女33例;年龄22~88岁,平均(47.89±8.77)岁;结节最大径0.77~2.92 cm,平均(1.66±0.94)cm;其中乳头状甲状腺癌39个、滤泡细胞癌2个、微小乳头状癌11个,合并表皮样囊肿1个、结节性甲状腺肿或腺瘤样结节性甲状腺肿27个、桥本甲状腺炎9个、微小乳头状癌8个。2组性别、年龄及结节最大径差异均无统计学意义(均P<0.05)。
1.2 仪器与方法采用Philips 64排螺旋CT扫描仪。患者取仰卧位,颈部呈仰伸状态,扫描范围口咽部至锁骨上缘。扫描参数:120 kV,150 mAs,层厚0.625 mm,螺距1.0。增强扫描经肘静脉团注对比剂碘海醇(碘浓度300 mg/mL)60 mL,流率3 mL/s,注射后延迟25、60 s分别行动脉期及静脉期扫描。图像由2位主治以上医师共同分析,记录结节形态、边界、钙化、强化特点及淋巴结肿大情况等。
1.3 统计学方法采用SPSS 25.0统计软件进行数据分析,计数资料以百分率表示,组间比较行χ2检验。以病理结果作为金标准、结节良恶性作为因变量、CT征象为自变量行单因素分析和多因素Logistic回归分析,检验水准为α=0.05。以P<0.05为差异有统计学意义。
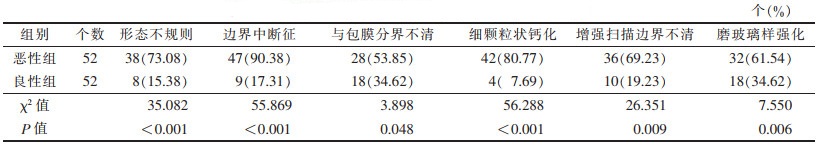
2 结果2组MSCT征象的单因素分析比较见表 1。良恶性结节在形态、边界、包膜情况、内部钙化形态、强化方式方面比较,差异均有统计学意义(均P<0.05)。单因素分析显示,形态不规则、边界中断征、细颗粒状钙化、与包膜分界不清、磨玻璃样强化、增强扫描边界不清是鉴别甲状腺良恶性结节的重要征象(图 1~3)。多因素Logistic回归分析显示,边界中断征、细颗粒状钙化、增强扫描边界不清与甲状腺癌相关(P=0.006,0.003,0.013)(表 2)。
| 表 1 甲状腺良恶性结节MSCT征象的单因素分析比较 |
 |
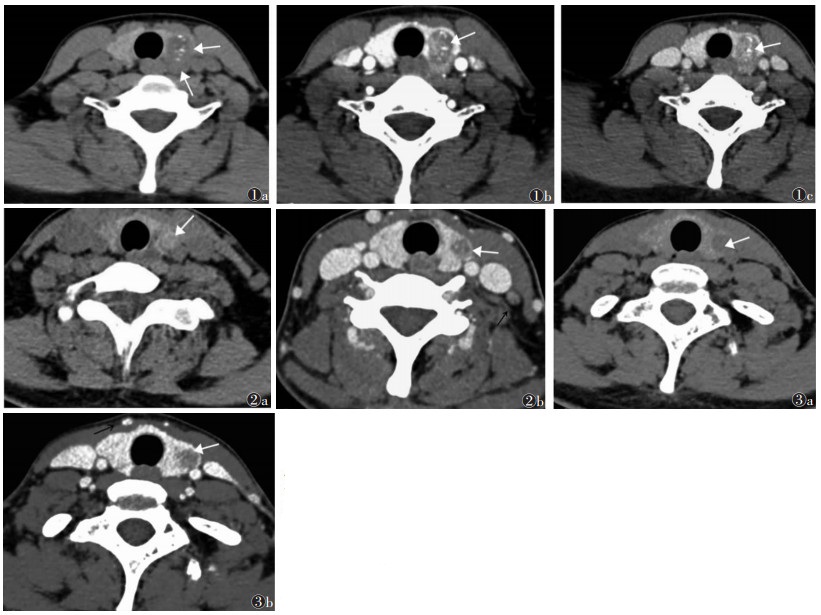 |
| 图 1 女,38岁,结节性甲状腺肿合并乳头状癌 图 1a CT平扫示甲状腺左叶结节,形态尚规则,边界显示欠佳,内可见点状细颗粒状钙化(白箭) 图 1b,1c 增强扫描后方边界与甲状腺分界不清,强化程度低,呈磨玻璃样强化(白箭) 图 2 女,34岁,桥本甲状腺炎并微小乳头状癌 图 2a CT平扫示甲状腺双侧叶密度弥漫性降低,左侧叶内可见稍低密度结节,边界不清,形态不规则,周边似可见假包膜(白箭) 图 2b 增强扫描病灶边界不清,内似可见细颗粒状钙化(白箭),左侧颈部Ⅲ区可见强化淋巴结(黑箭) 图 3 女,28岁,结节性甲状腺肿合并甲状腺乳头状癌 图 3a CT平扫示甲状腺左叶可见一低密度结节,形态不规则,结节边缘呈中断征(白箭) 图 3b 增强扫描边界不清,强化程度低于周围甲状腺组织(白箭),颈部可见强化淋巴结(黑箭) |
| 表 2 甲状腺结节MSCT图像特征的Logistic多因素回归分析结果 |
 |
3 讨论
近年来,甲状腺癌发病率迅速增长,我国城市女性甲状腺癌发病率位居女性恶性肿瘤的第4位[4]。超声检查无创、无辐射,是诊断甲状腺良恶性结节的重要方法,但因受操作者经验等主观因素影响较大,CT检查则更客观。正常甲状腺组织含碘量高,与周围组织存在密度差,可形成自然对比,注射对比剂后对病灶显示更好。本研究通过对甲状腺良恶性结节CT征象进行对比分析,得出结节形态、边界、包膜情况、钙化形态及强化特点等,可诊断甲状腺结节的良恶性,尤其是结节与正常甲状腺组织存在边界中断征、细颗粒状钙化及增强扫描边界不清等更倾向于恶性诊断。
甲状腺边界中断征是指CT平扫时正常高密度的甲状腺轮廓局部缺损,被低密度的瘤体取代,瘤体似嵌入甲状腺边缘,有较完整的轮廓[5]。本研究中形态不规则良性组占15.38%(8/52),恶性组占73.08%(38/52);边界中断征良性组占17.31%(9/52),恶性组90.38%(47/52);与包膜分界不清,良性组占34.62%(18/52),恶性组占53.85%(28/52),差异均有统计学意义。Gu等[6]也证实,甲状腺结节长径<10 mm、边缘浸润、边界不清是恶性肿瘤的独立危险因素。原因可能是由于良恶性结节的生长方式不同,良性结节多表现为膨胀性生长,周围甲状腺组织呈受压改变;恶性结节呈浸润性生长,病灶常因生长速度快而不均衡,导致结节形态不规则,肿瘤细胞取代正常甲状腺组织,由于密度差异,造成肿瘤组织似嵌入甲状腺组织中。
此外,肿瘤细胞的生长方式是纵向排列,甲状腺癌早期肿瘤细胞在前后方向进行有丝分裂,而其他方向的细胞在同一时期处于静止,这导致肿瘤前后径相对横径和纵径较大,这与良性结节的生长方式不同。也有研究[7]报道,甲状腺结节的前后径以7 mm为界,可作为判断其恶性程度的指标,通过CT三维重建可方便测量肿瘤各个径线,有助于对结节良恶性的定性。
甲状腺良恶性结节均可出现钙化,李凌等[8]认为钙化形成与体内局部组织代谢异常(如碱性磷酸酶水平增加)、肿瘤细胞特性(过快生长、细胞代谢旺盛、促进纤维组织增生等)及组织自身分泌的一些促进钙盐沉积的化学物质(如Cbfa1/Runx2因子等)有关。细颗粒状钙化在甲状腺乳头状癌中最常见。有学者[9-11]认为,颗粒状细钙化可高度提示甲状腺结节恶性,其病理基础是砂粒体,形成机制可能是肿瘤乳头状血管基底膜增厚、血栓形成、钙化、肿瘤细胞坏死。良性结节的钙化CT表现为光滑的结节状钙化、完整的环状钙化;恶性结节的钙化CT表现为细颗粒状钙化、钙化环内低密度及钙化周围晕征等。本研究恶性组细颗粒状钙化比例80.77%(42/52)明显高于良性组7.69%(4/52),差异有统计学意义,说明该征象对恶性结节诊断特异度较高。
甲状腺良恶性结节强化方式明显不同,良性结节与正常甲状腺组织具有相似的亲碘性特点,恶性结节因破坏甲状腺组织正常储碘功能,强化程度、方式更多受肿瘤血供的影响。甲状腺癌血供丰富,病理证实其纤维血管束分布在乳头状结构的中心,增强扫描结节强化明显,与周围正常组织密度差减小,因此结节边界模糊。甲状腺恶性结节呈浸润性生长,常发生纤维化和透明样变性,导致正常血管网遭到破坏,病灶内血供分布不均匀,因此增强扫描可表现为不均匀强化。良性结节如结节性甲状腺肿,常无包膜,结节内部与周围正常甲状腺组织的血管分布类似,与其血流状态和灌注模式相似,多表现为均匀强化,因此不均匀强化或强化后结节边界不清可作为甲状腺恶性结节的征象[12-16]。本研究中良、恶性结节强化方式明显不同,恶性组强化后边界不清占69.23%(36/52),良性组仅占19.23%(10/52),差异有统计学意义。磨玻璃样强化即增强扫描结节稍低于周围正常甲状腺组织,判断这一征象易受合并结节性甲状腺肿、桥本甲状腺炎及亚急性甲状腺炎影响,存在一定误差。本研究中多因素Logistic回归分析显示良恶性结节这一征象差异无统计学意义。
随着MSCT的发展,其在诊断甲状腺结节良恶性方面具有独特优势。多因素Logistic回归分析有助于筛选出高特异度征象,提高甲状腺癌诊断的准确率。边界中断征、细颗粒状钙化及增强扫描边界不清与甲状腺癌密切相关,可作为辅助判断甲状腺结节良恶性的可靠指标。
| [1] |
中国临床肿瘤学会甲状腺癌专业委员会. 复发转移性分化型甲状腺癌诊治共识[J]. 中国癌症杂志, 2015, 25(7): 481-496. |
| [2] |
YEH M W, BAUER A J, BERNET V A, et al. American Thyroid Association statement on preoperative imaging for thyroid cancer surgery[J]. Thyroid, 2015, 25(1): 3-14. DOI:10.1089/thy.2014.0096 |
| [3] |
吴城炜, 邹大中, 缪伎云, 等. 超声引导下FNAC与ARHI印迹基因检测在甲状腺结节良恶性病变鉴别诊断中的比较研究[J]. 中国超声医学杂志, 2019, 35(10): 877-879. DOI:10.3969/j.issn.1002-0101.2019.10.004 |
| [4] |
国家卫生健康委员会.甲状腺癌诊疗规范(2018年版)[J/CD].中华普通外科学文献(电子版), 2019, 13(1): 1-15.
|
| [5] |
韩志江, 陈文辉, 舒艳艳, 等. 乳头状甲状腺微小癌和微小结节性甲状腺肿的CT鉴别诊断[J]. 中国临床医学影像杂志, 2013, 24(2): 88-92. DOI:10.3969/j.issn.1008-1062.2013.02.004 |
| [6] |
GU W J, YAN H X, LUO Y K, et al. Characterization of papillary thyroid microcarcinomas using sonographic features in malignant papillary thyroid cancer:a retrospective analysis[J]. Medicine, 2015, 94(21): e841-e845. DOI:10.1097/MD.0000000000000841 |
| [7] |
HUANG K, GAO N, ZHAI Q, et al. The anteroposterior diameter of nodules in the risk assessment of papillary thyroid microcarcinoma[J]. Medicine, 2018, 97(10): e9712-e9719. DOI:10.1097/MD.0000000000009712 |
| [8] |
李凌, 徐庆中. 超声多因素Logistic回归分析鉴别甲状腺良恶性结节的价值[J]. 医学影像学杂志, 2019, 29(4): 553-556. |
| [9] |
CHEN K Y, CHEN C N, WU M H, et al. Computerized detection and quantification of microcalcifications in thyroid nodules[J]. Ultrasound Med Biol, 2011, 37(6): 870-878. DOI:10.1016/j.ultrasmedbio.2011.03.002 |
| [10] |
LU Z, MU Y, ZHU H, et al. Clinical value of using ultrasound to assess calcification patterns in thyroid nodules[J]. World J Surg, 2011, 35(1): 122-127. |
| [11] |
韩志江. 钙化征在超声及CT鉴别甲状腺良恶性结节中的价值[J]. 中国临床医学影像杂志, 2012, 23(9): 648-650. DOI:10.3969/j.issn.1008-1062.2012.09.012 |
| [12] |
黄聪, 韩志江, 吴勇, 等. 甲状腺未分化癌的临床及影像学研究进展[J]. 中国中西医结合影像学杂志, 2019, 17(6): 664-667. |
| [13] |
李永强. 双排螺旋CT在甲状腺单发结节良恶性诊断中的价值探讨[J]. 现代医用影像学, 2016, 25(6): 1204-1205. |
| [14] |
唐帅生, 崔延安, 梁定, 等. 甲状腺结节的CT诊断与分析[J]. 中国中西医结合影像学杂志, 2016, 14(6): 711-713. DOI:10.3969/j.issn.1672-0512.2016.06.032 |
| [15] |
石晓辰, 唐少珊, 于宏伟. 超声造影诊断良恶性甲状腺结节Meta分析[J]. 中国医学影像技术, 2015, 31(3): 355-358. |
| [16] |
徐列印, 邱维加, 何敏丽, 等. 结节性甲状腺肿合并甲状腺癌的CT诊断[J]. 临床放射学杂志, 2015, 34(1): 28-31. |
 2021, Vol. 19
2021, Vol. 19


