| 肠系膜脂肪代谢异常的MSCT表现 |
2. 辽宁省健康产业集团铁煤总医院普外一科,辽宁 调兵山 112700
肠系膜脂肪代谢异常是一组发生于肠系膜脂肪组织疾病的总称,包括肠系膜脂肪营养不良、肠系膜脂膜炎及回缩性脂膜炎。既往认为是少见病[1],发病率低,临床症状不典型,易被忽视。近年来随着肥胖人群的增多,其发病率上升,对该病的报道也增多,逐渐被临床及影像医师所重视。笔者收集我院2013年7月至2018年7月收治的81例经病理证实的肠系膜脂肪代谢异常患者,分析其MSCT表现,以提高诊断准确率,为临床治疗提供帮助。
1 资料与方法 1.1 一般资料81例中,男42例,女39例;年龄22~87岁,平均(59.35±14.28)岁。均经影像诊断及临床查体排除其他器质性病变,保守治疗后症状缓解,部分患者经手术切除。临床症状轻者多为慢性持续性腹痛,无血便或排便异常,无肠梗阻等症状;症状严重者可扪及腹部肿块。
1.2 仪器与方法81例均行MSCT检查,采用Siem-ens Somatom Perspective CT、GE Lightspeed VCT及Philips Brilance iCT,均采用螺旋扫描模式。扫描参数:120~140 kV,250~350 mA,FOV 30 cm×30 cm~35 cm×35 cm,层厚1.25 mm,重建层距1.25 mm,螺距1.375,采用腹窗显示,窗宽350 HU,窗位40 HU。扫描范围自膈顶层面至耻骨联合上缘,包括全腹腔脏器。增强扫描均行动脉期、门脉期及延迟期3期扫描,对比剂为碘海醇注射液(350 mgI/mL,北陆药业),采用Nemoto高压注射器,注射流率3.5 mL/s,剂量75~80 mL,经肘正中静脉注入。
1.3 图像分析采集原始轴位数据后,传至随机所带的ADW4.3、ADW4.5、ADW4.7或EBW2.5工作站,行MIP及MPR,由2名以上的高年资医师进行影像分析。
1.4 分型标准采用Durst等[2-3]对肠系膜脂肪代谢异常的分型,即根据病理表现形式、临床症状及CT表现,分为3型:Ⅰ型,肠系膜脂肪营养不良,病变范围局限,肠系膜血管周围呈同心圆样分布;Ⅱ型,肠系膜脂膜炎,病变范围增大,成片分布,与正常脂肪组织有明显分界;Ⅲ型,回缩性脂膜炎,病变呈包裹态,腹膜增厚,并有纤维索条形成。
2 结果 2.1 病变分布81例中,45例分布于肠系膜根部,病变围绕肠系膜上动脉或肠系膜下动脉呈圆形或片状分布;36例分布于肠系膜远端各部位,病灶亦呈圆形或片状分布。81例中,Ⅰ型58例,均分布在小肠系膜;Ⅱ型19例,分布在小肠系膜14例,结肠系膜5例;Ⅲ型4例,均位于结肠系膜。
2.2 MSCT表现Ⅰ型病灶表现为肠系膜血管根部局限的呈靶环样或同心圆样分布的磨玻璃影,直径<0.5 cm,病灶围绕肠系膜血管向外放散,病灶间可见正常的肠系膜脂肪组织,平扫时CT值为-87~-75 HU,增强扫描病灶无明显强化(图 1,2),CT值较平扫增加7~15 HU。Ⅱ型病灶范围较Ⅰ型增大,多呈片状分布,病变内无正常脂肪组织,其内可见长索条,病变与远处正常脂肪组织间存在明显的分界线(图 3),病变的磨玻璃密度较Ⅰ型更高,病灶直径 > 1 cm,平扫时CT值-35~-27 HU,增强扫描病灶血管显示清晰,但无狭窄、无变形,病灶远端分界线呈索条样强化(图 4),病灶包含强化的血管,CT值增加17~34 HU。Ⅲ型病灶多呈包裹态,界限明显,外缘可见类似的假包膜,多为线样高密度索条,病灶内肠管及肠系膜血管包裹明显,扭曲变形(图 5,6),系膜组织回缩,严重者可见假包块形成,增强扫描包块呈不均匀性的轻度强化,强化幅度 > 30 HU,动脉期强化程度低于门脉期及延迟期。
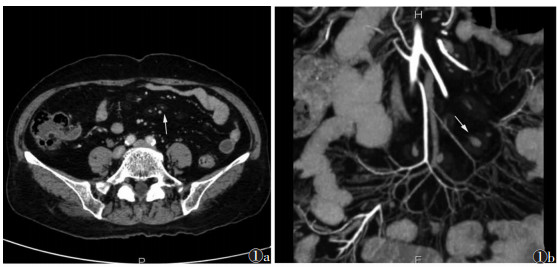 |
| 图 1 女,70岁,肠系膜脂肪营养不良 图 1a CT轴位示围绕血管分布的同心圆样磨玻璃影(白箭),相互间存在正常脂肪组织 图 1b 冠状位示病灶清晰(白箭),肠系膜血管显示清楚,无变化 |
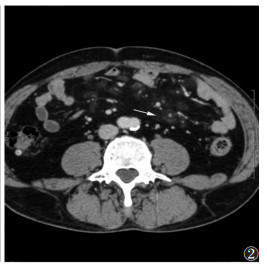 |
| 图 2 男,52岁,肠系膜脂肪营养不良,分布范围较广泛,病灶独立未连成片(白箭) |
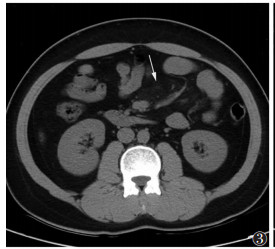 |
| 图 3 男,27岁,肠系膜脂膜炎,左半区肠系膜可见呈片状分布的磨玻璃影(白箭),病变内无正常脂肪组织 |
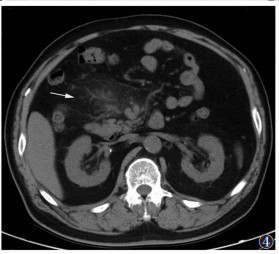 |
| 图 4 男,61岁,肠系膜脂膜炎,右半区肠系膜病变内可见索条(白箭),外缘见线样分界 |
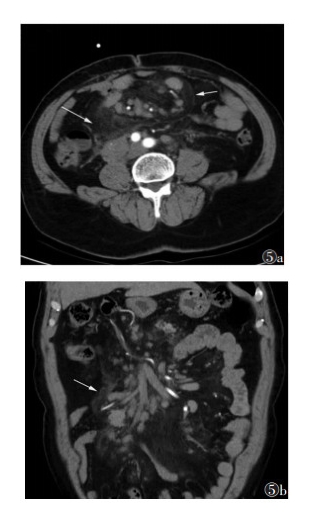 |
| 图 5 男,55岁,回缩性脂膜炎 图 5a,5b CT轴位及冠状位示病变多呈包裹态(白箭),与邻近组织有明显的界限,外缘可见线样高密度索条形成的假包膜,血管根部受包绕,内见增大的淋巴结 |
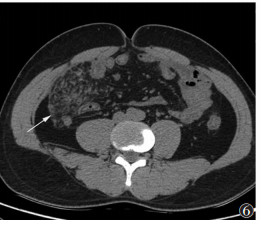 |
| 图 6 男,35岁,回缩性脂膜炎,病变内肠管及肠系膜血管分布杂乱,扭曲变形,系膜组织回缩增厚(白箭) |
3 讨论 3.1 病理改变及分型
Emory等[1]报道肠系膜脂肪代谢异常病理表现为肠系膜脂肪组织内大量巨噬细胞浸润,因此亦称为孤立性脂肪代谢障碍。随着对该病认识的增加,也称之为肠系膜脂肪肥厚症、肠系膜脂性肉芽肿、原发性肠系膜脂硬化症、缩窄性肠系膜炎、特发性收缩性肠系膜炎及硬化性肠系膜炎等[3],但均与其病理表现不尽相同,其病理变化从最初的脂肪细胞内大量巨噬细胞浸润,发展成炎性细胞大量聚集,继而细胞间出现纤维组织,脂肪细胞坏死、萎缩,最后纤维组织收缩形成包裹硬化。最新研究[4]认为,不同的病理时期,其名称也应不同,病变较早期,仅大量巨噬细胞吞噬脂肪细胞,尚未引起明显炎症反应,病理以脂肪细胞坏死为主,该阶段应称为肠系膜脂肪营养不良,属Ⅰ型;当病变进一步发展,肠系膜脂肪间出现大量炎性细胞聚集时,此时病理以炎性细胞聚集为主,掺杂脂肪细胞坏死,病灶边缘出现纤维组织,该阶段应称为肠系膜脂膜炎,属Ⅱ型;随着病变进展,炎症及脂肪细胞坏死增多,瘢痕纤维组织成为该阶段主要的病理改变,纤维组织收缩加剧,最终形成包裹硬化,外观呈蚕茧样,此阶段应称为回缩性脂膜炎,属Ⅲ型。不同病理时期的影像学改变不同,因此不应用统一名称代替[1, 4-5]。
3.2 MSCT表现肠系膜脂肪代谢异常时MSCT均可见腹腔内脂肪组织多于正常人群,且脂肪组织越多,其发病率越高。不同分型肠系膜脂肪代谢异常的MSCT表现:①肠系膜脂肪营养不良,由于肠系膜解剖分布呈扇形,其扇轴位置是腹主动脉及其分支,扇面远端附着于结肠及小肠系膜,病变分布区域分为扇轴及扇面2处,因此表现为肠系膜血管根部脂肪密度增高,呈靶环样或同心圆样分布的磨玻璃影,病灶围绕肠系膜血管向外放散,病灶间可见正常的肠系膜脂肪组织将其分隔,增强扫描病灶无明显强化,该阶段脂肪细胞坏死多于炎细胞浸润及纤维增生。②肠系膜脂膜炎,MSCT示病变范围较肠系膜脂肪营养不良增大,多呈片状分布,病变内无正常脂肪组织出现,脂肪密度被磨玻璃影取代,其内可见长索条,但与远处正常脂肪组织间存在明显分界线,病变磨玻璃密度较肠系膜脂肪营养不良更高,增强扫描病变区血管显示清晰,但无狭窄、无变形,病灶远端分界线呈细线样强化[6-8]。③回缩性脂膜炎,病变多呈包裹态,与邻近组织有明显的界限,外缘可见类似的假包膜,多为线样高密度索条,病变内可见淋巴结增大,肠管及肠系膜血管包裹明显,分布杂乱,扭曲变形,系膜组织回缩增厚,严重者可形成假包块,增强扫描包块呈不均匀轻度强化[9-12]。
3.3 治疗及预后肠系膜脂肪营养不良患者临床表现轻微,属于自限性疾病,可通过合理饮食及体质锻炼提高机体抵抗力,消耗掉腹腔内过多的脂肪组织后,临床症状短期内可消失,影像表现恢复正常,一般无需临床干预。肠系膜脂膜炎症状严重者可给予皮质类固醇激素、抗生素及长期使用硫嘌呤进行免疫调节治疗,症状可有效控制。回缩性脂膜炎患者,手术治疗价值不大,因为炎性肿块的切除涉及小肠血管吻合重建,治疗效果有限,因此认为手术应仅限于治疗严重并发症,即当发生肠梗阻及血管压迫症状时,可考虑急诊手术治疗[13]。
总之,肠系膜脂肪代谢异常具有自限性,预后佳,通常2年内,大多患者疼痛消失,肿块退缩,MSCT对其诊断及分型具有重要价值。
| [1] |
Emory TS, Monihan JM, Carr NJ, et al. Sclerosing mesenteritis, mesenteric panniculitis and mesenteric lipodystrophy:a single entity[J]. Am J Surg Pathol, 1997, 21: 392-398. DOI:10.1097/00000478-199704000-00004 |
| [2] |
Durst AL, Freund H, Rosenmann E, et al. Mesenteric panniculitis: review of the literature and presentation of cases[J]. Surgery, 1977, 81: 203-211. |
| [3] |
Daskalogiannaki M, Voloudaki A, Prassopoulos P, et al. CT evaluation of mesenteric panniculitis:prevalence and associated diseases[J]. AJR Am J Roentgenol, 2000, 174: 427-431. DOI:10.2214/ajr.174.2.1740427 |
| [4] |
Holzberger P, Turtscher M, Stoss F. Retractile mesenteritis after resection of Meckel's, diverticulum[J]. Dtsch Med Wochenschr, 2000, 125: 182-185. |
| [5] |
Ayala Gutiérrez Mdel M, de Ramón Garrido E. Mesenteric panniculitis[J]. Med Clin (Barc), 2016, 146: 497-505. DOI:10.1016/j.medcli.2016.01.015 |
| [6] |
王锡臻, 王滨, 董鹏. 硬化性肠系膜炎的影像学特征[J]. 放射学实践, 2006, 21(3): 232-235. DOI:10.3969/j.issn.1000-0313.2006.03.005 |
| [7] |
Ehrenpreis ED, Roginsky G, Gore RM. Clinical significance of mesenteric panniculitis-like abnormalities on abdominal computerized tomography in patients with malignant neoplasms[J]. World J Gastroenterol, 2016, 22: 10601-10608. DOI:10.3748/wjg.v22.i48.10601 |
| [8] |
赵绍宏, 赵红, 蔡祖龙, 等. 肠系膜脂膜炎的多层螺旋CT诊断[J]. 中华放射学杂志, 2006, 40(5): 526-529. DOI:10.3760/j.issn:1005-1201.2006.05.018 |
| [9] |
Horton KM, Lawler LP, Fishman EK. CT findings in sclerosing mesenteritis (panniculitis):spectrum of disease1[J]. Radiographics, 2003, 23: 1561-1567. DOI:10.1148/rg.1103035010 |
| [10] |
Mahafza WS, Manzalawi KA, Gharaibeh AA, et al. Diagnosis of mesenteric panniculitis in the multi-detector computed tomogra-phy era. Association with malignancy and surgical history[J]. Saudi Med J, 2017, 38: 1013-1018. DOI:10.15537/smj.2017.10.20163 |
| [11] |
Sabate JM, Torrubia S, Maideu J, et a1. Sclerosing mesenteritis: imaging findings in 17 patients[J]. AJR Am J Roentgenol, 1999, 172: 625-629. DOI:10.2214/ajr.172.3.10063848 |
| [12] |
彭玉, 李仕红, 王甜, 等. 硬化性肠系膜炎的典型及非典型影像学表现[J]. 中国医学计算机成像杂志, 2017, 23(4): 352-356. DOI:10.3969/j.issn.1006-5741.2017.04.014 |
| [13] |
Nyberg L, Bjork J, Bjorkdahl P, et al. Sclerosing mesenteritis and mesenteric panniculitis-clinical experience and radiological fe-atures[J]. BMC Gastroenterol, 2017, 17: 75. DOI:10.1186/s12876-017-0632-7 |
 2019, Vol. 17
2019, Vol. 17


