| CTPA对急性肺动脉栓塞危险分层的预测价值 |
急性肺动脉栓塞(acute pulmonary embolism,APE)是指肺动脉主干及其分支血管被各种内外源性栓子阻塞而导致的疾病[1]。APE临床表现复杂多样,临床症状和体征缺乏特异性,轻者发病隐匿或出现轻微短暂的呼吸困难,重者可在短时间内出现呼吸困难、咯血、休克甚至猝死[2]。准确了解APE的发展过程,及时对病情进行准确的危险分层,有助于临床医师制订合适的治疗方案,提高治疗效果[3-5]。CT肺动脉成像(CT pulmonary angiography,CTPA)是诊断APE的重要检查方法,其不但能够准确显示有无肺动脉栓塞,还可通过分析获得反映肺动脉阻塞部位和阻塞程度的量化指标,如肺动脉栓塞指数(pulmonary artery obstruction index,PAOI)等[6]。目前,有关CTPA对APE危险分层的相关研究较少,因此本研究旨在探讨CTPA对APE危险分层的预测价值。
1 资料与方法 1.1 一般资料回顾性搜集2019年1月至2021年5月在我院确诊的360例APE患者为研究对象,其中男237例,女123例;年龄21~93岁,中位年龄67岁。
纳入标准:①临床确诊为APE,其诊断标准符合《急性肺栓塞诊断与治疗中国专家共识(2015)》[7];②CTPA检查前未行溶栓或抗凝等肺栓塞相关治疗;③CTPA图像质量满足诊断要求。排除标准:①有碘对比剂禁忌证;②严重心、肺疾病(如先天性心脏病、风湿性心脏病、心包大量积液、原发性肺动脉高压、肺癌侵犯肺动脉、弥漫性胸膜病变);③CTPA图像质量影响观察;④既往有肺栓塞病史且经过相关治疗。根据2020年欧洲心脏病协会指南[8]将APE进行危险分层,其中低危组203例;由于高危组例数过少,将中危组和高危组合并称为中/高危组,共157例。本研究已获得医院伦理委员会批准。
1.2 仪器与方法采用GE Lightspeed VCT 64排螺旋CT扫描仪。患者取仰卧位、头先进。扫描范围:胸廓入口至肋膈角以下。扫描参数:120 kV、200~500 mA、层厚、层距均为5 mm。经肘静脉注射碘佛醇(碘浓度320 mg/mL,江苏恒瑞医药股份有限公司),流率5 mL/s,剂量20 mL,后以相同流率注射生理盐水20 mL,运用小剂量测试技术监测对比剂在肺动脉干内的峰值浓度变化,计算出肺动脉干峰值时间,以确定延迟扫描时间[9];再次注射对比剂50 mL,以相同流率注射生理盐水30 mL完成扫描,重建层厚1.25 mm。
1.3 影像学分析由1名胸部影像诊断专业的硕士研究生和1名从事胸部影像诊断工作5年以上的主治医师在GE AW4.6工作站进行阅片,意见不一致时,经协商得到一致意见。影像评估内容包括:升主动脉直径(ascending mainatery diameter,AAd),肺动脉主干直径(mainpulmonary artery diameter,MPAd),肺动脉直径与升主动脉直径之比(rPA),有无肺动脉主干栓塞(包括肺动脉主干及左右肺动脉),胸腔积液(无,单侧、双侧),有无心包腔积液,有无肺结核,有无肺气肿,肺内实变影,以及肺动脉栓塞指数(PAOI)[10]。PAOI的计算公式为PAOI=[Σ(n×d)/40]×100%,d代表栓塞程度评分(完全栓塞为2分,部分栓塞为1分,无栓塞为0分),n代表栓塞的肺段支气管动脉数量(右肺上叶3段、中叶2段、下叶5段;左肺上叶3段、下叶5段、舌叶2段。左、右肺共20个肺段)。根据PAOI数值,将360例分为轻度(PAOI<30%)、中度(30%≤PAOI≤50%)和重度栓塞组(PAOI > 50%)[11]。
1.4 统计学方法使用SPSS 26.0和MedCalc 19.40软件进行数据分析。采用Kolmogorov-Smirnov检验对计量资料行正态性检验。符合正态性分布的计量资料以x±s表示,2组间比较行独立样本t检验;不符合正态性分布的计量资料以M(QL,QU)表示,2组间比较行Mann-Whitney U检验。计数资料以频数表示,2组间比较行χ2检验。将单因素分析具有统计学意义的变量纳入多因素logistic回归分析,采取逐步向前(有条件)选择方法筛选独立预测因子。对独立预测因素行ROC曲线分析,计算AUC,AUC比较采用DeLong检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组临床资料比较(表 1)| 表 1 低危组与中/高危组急性肺动脉栓塞患者临床资料比较 |
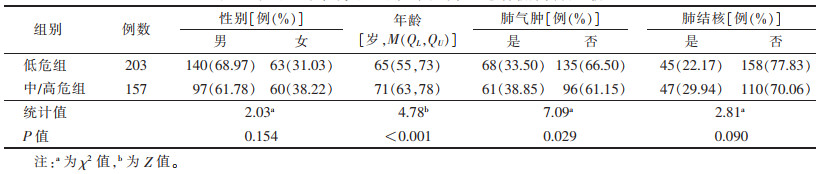 |
2组年龄、肺气肿比较,差异均有统计学意义(均P<0.05),而性别、肺结核差异均无统计学意义(均P > 0.05)。
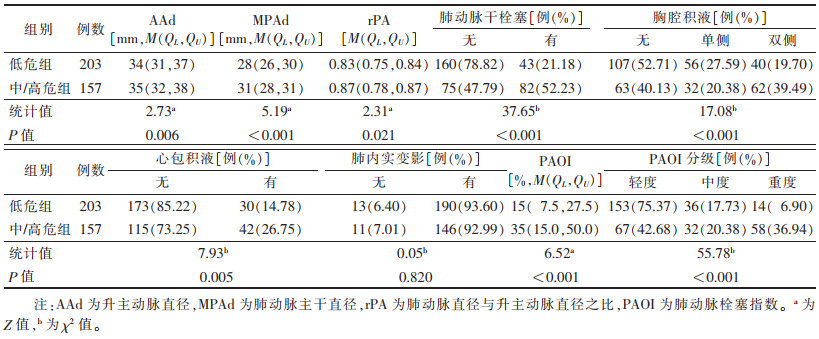
2.2 2组影像指标比较2组AAd、MPAd、rPA、肺动脉主干栓塞、胸腔积液、心包积液、PAOI及PAOI分级比较,差异均有统计学意义(均P<0.05)(图 1~3);肺内实变影比较,差异无统计学意义(P > 0.05)(表 2)。
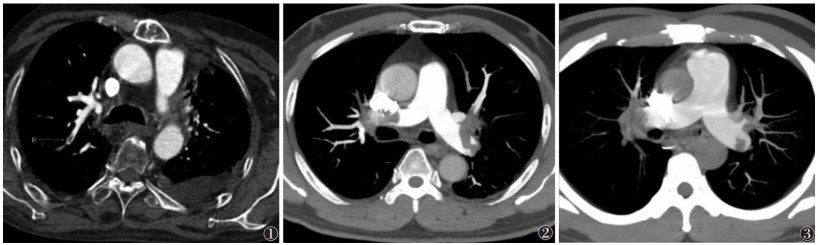 |
| 注:图 1患者,男,53岁,临床评估为低危患者。右肺上叶后段部分栓塞,余主干及分支未见栓子,肺动脉栓塞指数(PAOI)为2.5%,属于轻度栓塞。图 2患者,男,50岁,临床评估为中/高危患者。双肺动脉主干部分栓塞,PAOI为50%,属于中度栓塞。图 3患者,男,36岁,临床评估为中/高危患者。左肺动脉主干部分栓塞,右肺动脉主干完全栓塞,PAOI为75%,属于重度栓塞 图 1~3 急性肺动脉栓塞不同危险分层的CT图像 |
| 表 2 低危组与中/高危组急性肺动脉栓塞患者CTPA影像指标比较 |
 |
2.3 APE危险分层多因素logistics回归分析及诊断效能评估
将单因素分析有统计学意义的影像指标纳入多因素logistic回归分析,结果显示年龄(OR=1.046,95%CI 1.024~1.068,P<0.001)、PAOI分级(OR= 3.188,95%CI 2.273~4.472,P<0.001)、MPAd(OR= 1.094,95%CI 1.034~1.159,P=0.002)、胸腔积液(OR= 1.721,95%CI 1.282~2.311,P<0.001)是APE危险分层的独立预测因素。对上述各独立预测因素及4个独立预测因素联合行ROC曲线分析(图 4),结果显示多指标联合预测中/高危组的AUC为0.801(95%CI 0.755~0.846)较年龄、PAOI分级、MPAd、胸腔积液的AUC大,差异均有统计学意义(Z=5.05,5.39,5.10,6.48;均P<0.001)。
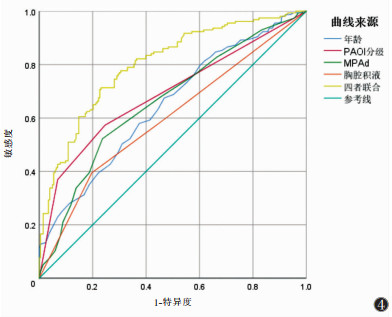 |
| 注:PAOI为肺动脉栓塞指数,MPAd为肺动脉主干直径 图 4 各独立指标及联合指标预测急性肺动脉栓塞危险分层的ROC曲线 |
3 讨论
APE是一种常见的心血管疾病,由于其临床症状缺乏特异性,易被忽视,而错过最佳治疗机会。APE若不及时治疗,其病死率高达30%,治疗后病死率可降至2%~8%[12]。高龄是APE的危险因素之一,随着年龄增加,发生APE的概率相对增加。陈贤坤等[13]研究89例APE死亡患者,其中61.8%的患者 > 50岁,从侧面反映年龄越大,肺栓塞危险程度越重,死亡风险也越高,其原因可能与年龄增长心肺代偿能力下降、体质变差及多发合并症有关。本研究显示,年龄是APE中/高危组的独立预测因素,因此老年患者的APE更值得临床医师关注。
本研究显示,伴肺气肿、AAd、MPAd、rPA、胸腔积液、心包积液、肺动脉主干栓塞、PAOI和PAOI分级在APE低危组与中/高危组差异均有统计学意义,其中PAOI分级、MPAd、胸腔积液为APE危险分层的独立预测因素,且肺气肿在中/高危组中更常见。有研究显示,在慢性阻塞性肺疾病病程中嗜酸性粒细胞通过强大的内源性凝血酶生成作用可导致血管内血栓形成[14];肺气肿导致肺血管床面积减少,肺动脉平均压力升高,从而增加右心后负荷,引起右心功能不全,心输出量下降[15]。本研究显示,PAOI和PAOI分级与APE的严重程度相关,这与Guo等[16-17]的研究一致,且PAOI分级作为独立预测因素能有效预测中/高危APE,PAOI分级越大,说明栓塞肺动脉主干或分支越多,影响肺组织范围越广,肺动脉阻塞程度越重,而肺栓塞后由于血液回流至左心房受阻,增加右心室后负荷,出现右心室功能障碍,导致患者预后不良、甚至死亡[18-19]。MPAd为本研究中/高危组另一独立预测因素,这可能由于APE栓子阻塞局部肺动脉,血液通过有障碍,导致近段未阻塞血管壁的压力增高,最终影响肺动脉主干,发生代偿性扩张,与奚泉等[20]的研究结果基本一致。王燕林等[21]研究显示,MPAd可预测高危肺栓塞且准确率较高。MPAd也被用来预测APE患者右心功能不全等远期并发症[22]。胸腔积液是APE常见伴随征象,发生率为19%~61%[23]。本研究中190例(52.78%)合并胸腔积液,102例(28.33%)为双侧胸腔积液;中/高危组合并双侧胸腔积液比率更高,究其原因可能为肺栓塞后肺动脉压力增加,严重者右心室功能异常,体循环血液回流受阻,血液淤积,体循环静脉压升高而漏出,而右心功能异常与危险分层密切相关[24]。也有研究发现,APE患者合并胸腔积液多预后不良[25]。
以往对APE危险分层的研究多基于生物标志物[26]或联合影像检查[27]。本研究对APE危险分层预测基于CTPA指标。多因素logistic回归分析显示,PAOI分级、MPAd和胸腔积液为中/高危APE的独立预测因素。因APE发病急,大多情况CTPA检查先于部分生物标志物检测结果,对异常的影像指标,影像医师应及时提醒临床医师,以减少不良事件的发生。
本研究将年龄、PAOI分级、MPAd和胸腔积液4个独立预测因素联合建立APE危险分层的logistic回归模型,结果显示联合模型预测中/高危组的效能高于各独立预测因素的预测效能。
本研究的局限性:①为回顾性的单中心研究,对患者的选择存在一定偏倚;②不同危险分层的样本量分布不均衡,尤其是高危组患者较少,未来需扩大样本量对不同危险分层进一步细化研究;③对CTPA各影像指标的测量基于人工手动勾画测量,工作繁重,也会导致部分测量误差,未来将研究深度学习在APE患者CTPA影像指标测量中的应用。
综上所述,基于CTPA的影像指标能有效预测APE危险分层,尤其是联合年龄、PAOI分级、MPAd和胸腔积液建立的联合预测模型可有效预测中/高危APE,对APE的临床危险分层具有重要参考意义。
| [1] |
中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. |
| [2] |
王利, 刘绍霞. 急性肺栓塞患者血清BNP、TnI及Hcy水平变化及临床意义[J]. 川北医学院学报, 2021, 36(5): 652-654. |
| [3] |
MEYER G, SANCHEZ O, JIMENEZ D. Risk assessment and management of high and intermediate risk pulmonary embolism[J]. Presse Med, 2015, 44(12): 401-408. DOI:10.1016/j.lpm.2015.10.009 |
| [4] |
MASSELLI G, ALMBERGER M, TORTORA A, et al. Role of CT angiography in detecting acute pulmonary embolism associated with COVID-19 pneumonia[J]. Radiol Med, 2021, 126(12): 1553-1560. DOI:10.1007/s11547-021-01415-y |
| [5] |
AVGERINOS E D, SAADEDDIN Z, ABOU ALI A N, et al. A meta-analysis of outcomes of catheter directed thrombolysis for high and intermediate risk pulmonary embolism[J]. J Vasc Surg Venous Lymphat Disord, 2018, 6(4): 530-540. DOI:10.1016/j.jvsv.2018.03.010 |
| [6] |
SHAYGANFAR A, HAJIAHMADI S, ASTARAKI M, et al. The assessment of acute pulmonary embolism severity using CT angiography features[J]. Int J Emerg Med, 2020, 13(1): 15. DOI:10.1186/s12245-020-00272-2 |
| [7] |
中华医学会心血管病学分会肺血管病学组. 急性肺栓塞诊断与治疗中国专家共识(2015)[J]. 中华心血管病杂志, 2016, 44(3): 197-211. |
| [8] |
KONSTANTINIDES S V, MEYER G, BECATTINI C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed incollaboration with the European Respiratory Society(ERS)[J]. Eur Heart J, 2020, 41(4): 543-603. DOI:10.1093/eurheartj/ehz405 |
| [9] |
薛波, 方玉, 尹航, 等. 基于时间-密度曲线的改进的个性化肺动脉CTA扫描方案研究[J]. 中国医疗设备, 2020, 35(2): 86-89. |
| [10] |
QANADLI S D, EL HAJJAM M, VIEILLARD-BARON A, et al. New CT index to quantify arterial obstruction in pulmonary embolism: comparison with angiographic index and echocardiography[J]. AJR Am J Roentgenol, 2001, 176(6): 1415-1420. DOI:10.2214/ajr.176.6.1761415 |
| [11] |
司友娇, 王培源, 曲凡勇, 等. CT肺动脉栓塞指数评价急性肺动脉栓塞的价值[J]. 实用放射学杂志, 2021, 37(4): 563-566. |
| [12] |
BELOHLAVEK J, DYTRYCH V, LINHART A. Pulmonary embolism, part I: epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism[J]. Exp Clin Cardiol, 2013, 18(2): 129-138. |
| [13] |
陈贤坤, 郑哲, 赵聪聪, 等. 肺血栓栓塞的临床和病理特征: 89例回顾性分析[J]. 中国法医学杂志, 2022, 37(1): 88-90. |
| [14] |
UDERHARDT S, ACKERMANN J A, FILLEP T, et al. Enzymatic lipid oxidation by eosinophils propagates coagulation, hemostasis, and thrombotic disease[J]. J Exp Med, 2017, 214(7): 2121-2138. |
| [15] |
KOZACI N, AY M O, BEYDILLI I, et al. Right-sided electrocardiogram usage in acute pulmonary embolism[J]. Am J Emerg Med, 2016, 34(8): 1437-1441. |
| [16] |
GUO F, ZHU G, SHEN J, et al. Health risk stratification based on computed tomography pulmonary artery obstruction index for acute pulmonary embolism[J]. Sci Rep, 2018, 8(1): 17897. |
| [17] |
AKGEDIK R, KARAMANLI H, KURT A B, et al. Usefulness of admission red blood cell distribution width as a predictor of severity of acute pulmonary embolism[J]. Clin Respir J, 2018, 12(2): 786-794. |
| [18] |
CHEN Y L, WRIGHT C, PIETROPAOLI A P, et al. Right ventricular dysfunction issuperior and sufficient for risk stratification by a pulmonary embolism response team[J]. J Thromb Thrombolysis, 2020, 49(1): 34-41. |
| [19] |
赵龙, 谢红英, 张玲玲, 等. CT肺动脉栓塞指数与急性肺栓塞患者右心功能及预后的相关性分析[J]. 中国医刊, 2021, 56(3): 332-335. |
| [20] |
奚泉, 赵春林, 刘娜. 大面积肺栓塞患者CT肺动脉栓塞指数与心血管参数的相关性研究[J]. 中国医学装备, 2021, 18(4): 70-73. |
| [21] |
王燕林, 木合拜提·买合苏提, 刘文亚, 等. CT肺动脉造影对大面积肺栓塞严重程度的评估[J]. 中国医学影像学杂志, 2016, 24(1): 8-11. |
| [22] |
HAJIAHMADI S, TABESH F, SHAYGANFAR A, et al. Pulmonary artery obstruction index, pulmonary artery diameter and right ventricle strain as prognostic CT findings in patient with acute pulmonary embolism[J]. Radiologia(Engl Ed), 2021, S0033-8338(21): 00076-X. |
| [23] |
PANJWANI A, ZAID T. An interesting case of undiagnosed pleural effusion[J]. Breathe(Sheff), 2017, 13(2): 46-52. |
| [24] |
张琴, 徐玲. 急性肺栓塞合并胸腔积液的研究进展[J/CD]. 临床医药文献电子杂志, 2019, 6(21): 193-195.
|
| [25] |
KIRIS T, YAZICI S, KOC A, et al. Prognostic impact of pleural effusion in acute pulmonary embolism[J]. Acta Radiol, 2017, 58(7): 816-824. |
| [26] |
陶吟杰, 施举红. 不同生物标志物对评估肺血栓栓塞症危险分层的应用价值[J]. 中华结核和呼吸杂志, 2021, 44(11): 1009-1015. |
| [27] |
赵军喜, 宋小雪, 李鹏, 等. 急性肺栓塞患者NLR、IL-6、血浆渗透压与CT肺动脉阻塞指数、sPESI的关系及对预后的预测价值[J]. 中国实用医刊, 2022, 49(2): 24-28. |
 2023, Vol. 21
2023, Vol. 21


