| 脑梗死影像智能诊断及预测的研究进展 |
脑梗死是指局部脑组织血液循环产生障碍,脑组织缺血、缺氧而发生软化坏死。随着CT、MRI设备和成像技术的不断发展,脑组织影像检查方法也逐渐成熟[1]。目前,医学影像检查设备基于不同的成像原理,可实现脑梗死的多模态成像,部分特殊成像方法(DWI、CTP、PWI等)可协助判断脑组织的病理生理状态[2]。因此,影像学检查是脑梗死重要的检出与评估手段,在临床实践中应用广泛。
1 脑梗死的影像诊断(图 1)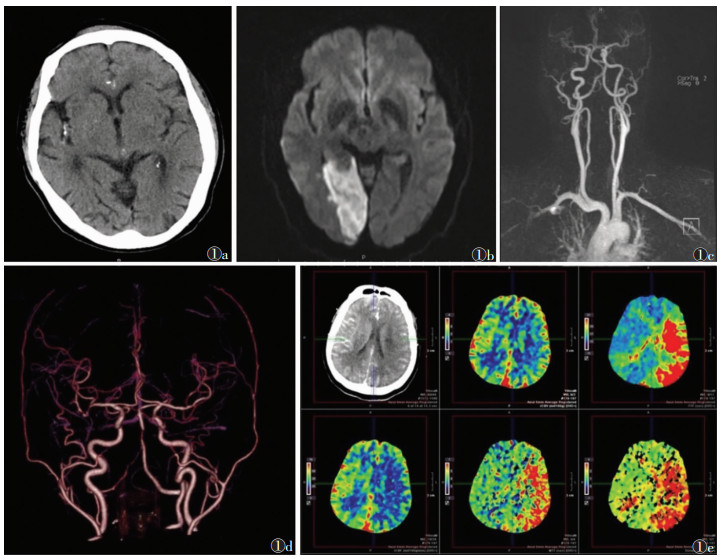 |
| 注:图 1a为头颅CT平扫;图 1b为头颅DWI;图 1c为头颅MRA;图 1d为头颅CTA;图 1e为头颅CTP 图 1 脑梗死常用的影像学检查方法图像 |
1.1 CT与MRI平扫
CT检查具有成像速度快、检查费用低等优点,是脑梗死最常用的影像学检查方法。脑梗死急性期CT平扫表现主要为脑动脉供血区域脑实质密度不同程度减低。2000年,Alberta卒中项目提出了一项早期CT评分(alberta stroke program early CT scale,ASPECTS),用于评估大脑中动脉供血区早期缺血性改变,实现了CT平扫图像上缺血性脑卒中的半定量评估[3]。MRI成像具有多序列、多参数、多平面的特点,可更准确地显示脑梗死的范围及水肿等情况。MRI是脑梗死的首选检查方法,DWI可显示超急性期的脑梗死(发病6 h内),在DWI图像上表现为高信号区域,同时可借助ADC来量化弥散受限的程度[4]。
1.2 CTA与MRACTA作为无创血管成像方法,具有成像速度快、空间分辨力高等优点,是目前临床首选的头颅血管检查方法。MIP、VR可直观显示血管管腔的内部形态,准确评价脑动脉狭窄的发生部位及狭窄程度。常用的MRA序列为3D扰相梯度回波序列(3D spoiled gradient recalled echo,3D-SPGR),该序列无需引入外源对比剂,且敏感度高,是临床上最常用的MRI动脉成像方法。对比增强MRA(contrast-enhanced magnetic resonance angiography,CE-MRA)需快速注射钆对比剂。与CTA相比,MRA易过高评估血管狭窄程度,对远端或分支血管狭窄显示准确度有限,但MRA是碘对比剂过敏或急性肾功能不全患者的首选检查方法[5]。
1.3 CTP与PWICTP是评价急性脑梗死血流灌注情况的首选检查方法。借助定量分析软件(如RAPID、MIStar等),可提供梗死核心区及缺血半暗带的定量信息。PWI也可提供脑组织的血流灌注信息,MRI检查灌注-弥散不匹配(perfusion-diffusion mismatch,PDM)是目前判断缺血半暗带的最理想的影像学方法,即PWI/DWI不匹配[6]。最为广泛认可和使用的头颅CTP/PWI分析软件Rapid,应用阈值法界定核心梗死区与缺血半暗带,即ADC < 620 mm2/s的区域为核心梗死区,灌注残余功能达峰时间(time of maximum concentration,Tmax) > 6 s的区域为缺血区域[7]。
2 人工智能概况人工智能是一系列用以模仿人类智能的理论、方法、技术及应用系统,其是计算机科学的分支,现阶段较为流行的算法分支是机器学习和深度学习。因为机器模型的性能根据输入的特征而变化,所以从数据中适当地选择和提取特征非常重要。输入特征通常由研究人员和数据科学家确定[8]。目前,已经开发了各种特征选择方法来增强选择过程并建立高精度的机器学习模型。基于这些特征,机器学习算法确定最佳决策边界,选择特征并开发模型以执行任务。图像数据的各种特征均可用于机器学习模型,如病变的大小、位置、形状和信号强度。此外,机器学习可区分和利用额外的图像特征,如纹理信息、信号强度梯度和偏斜度,这些特征是人类无法辨别的[9]。
2.1 机器学习机器学习是人工智能的核心技术,涉及诸多领域。该算法可从大数据中学习规律,从而拥有对测试集进行分析和研究的能力[10]。机器学习通常分为监督学习和非监督学习。监督学习使用由人类标记的训练数据集以定义所需或已知的答案,需人工标记过程。监督学习的经典方法有支持向量机、决策树、线性回归、逻辑回归、朴素贝叶斯和随机森林方法;非监督机器学习不使用人类定义的答案,试图在大型数据集中自行识别隐藏的模式,而这些模式通常对人类是不可见的。无监督学习的经典方法有K均值、均值偏移、亲和传播、层次聚类和高斯混合建模[11]。
2.2 深度学习深度学习是新一代的机器学习技术,其使用人工神经网络(artificial neural network,ANN)模仿人脑,具有多个隐藏层的ANN[12]。卷积神经网络(convolutional neural network,CNN)也使用ANN,CNN是医学中最常用的深度学习模型,其仿照生物视觉系统构建,能进行有监督学习和无监督学习,其隐藏层内的卷积核构建的权值共享网络结构,可减少计算过程中所需的权值数量[13]。深度学习可从医学大数据中挖掘深度信息,构建人工智能模型以实现疾病的识别诊断及预后预测,同时深度学习模型具备纠错能力,可根据结果反馈不断提高其算法的准确率,以减少临床实践中的人为诊断和治疗偏差[14]。
3 人工智能在脑梗死影像领域的研究进展 3.1 脑梗死医学影像的分割与定量① 阈值法:Lee等[15]研究结果显示DWI图像上急性脑梗死核心区域的阈值法自动分割结果与金标准之间的戴斯一致性系数(dice coefficient,DC)为0.395 1。Boldsen等[16]开发了一种基于阈值法的机器学习模型,用于前循环急性脑梗死DWI图像上梗死病灶的自动分割,中位DC为0.612 2。②深度学习方法:Nishi等[17]设计了一个CNN模型,用于MRI-DWI图像上梗死核心区的自动分割,DC为0.58±0.01。Kim等[18]构建了U-Net模型,实现了基于DWI+ADC和DWI的脑梗死病灶的自动分割,平均DC分别为0.60和0.57。Wu等[19]的研究应用深度学习分割模型实现了MRI-DWI图像上梗死核心区的自动分割,DC为0.86(0.79~0.89)。Kamnitsas等[20]构建了3D-DNN模型,使用体素周围的3D面片来代替像素周围的2D面片,该3D-CNN模型的平均DC为0.59±0.31,正确分割了测试集(36例)中的34例。Chen等[21]利用CNN模型实现了DWI图像上脑梗死病灶的全自动分割,病灶检出敏感度达0.94,与标准化标注结果的DC约为0.67,该模型在开发及训练过程中,使用了无监督学习。Wei等[22]的研究利用U-net模型实现了MRI-DWI图像上脑梗死区域的自动分割与体积测算,DC高达0.806(图 2)。
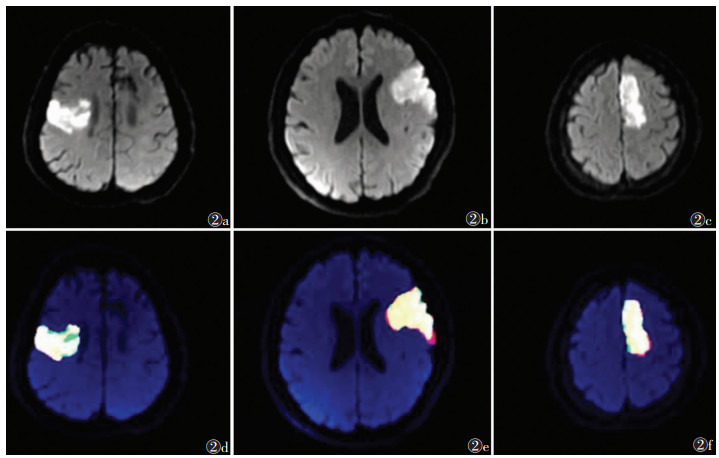 |
| 注:图 2a~2c为DWI图像;图 2d~2f为人工智能分割结果。红色区域为人工标注结果,绿色区域为人工智能输出结果,黄色区域为一致性部分 图 2 3例人工智能自动标注结果与人工标注结果间的比较 |
3.2 脑梗死的诊断与预测
① 识别与诊断:Takahashi等[23]利用机器学习技术检测CT图像上的大脑中动脉高密度征,提取外侧裂区特征,使用支持向量机进行分类,并使用留一法(交叉验证)对模型性能进行评估,该模型检测大脑中动脉高密度征的敏感度达97.5%(39/40)。Nagel等[24]运用2组人工智能技术进行自动化ASPECTS评分,特异度分别为93%和87%,准确率分别达91%和85%。Cheng等[25]应用2D和3D网络相结合的CNN模型实现了急性脑梗死在MRI-DWI图像上的病灶自动分割及自动化DWI-ASPECTS评分,结果表明自动化DWI-ASPECTS评分和放射科医师评分之间有很好的一致性,其中高级放射科医师与自动化评分的Kendall’s tau-b值为0.848。Czap等[26]运用一种基于3D-CNN的机器学习算法检出头颅CTA图像上的大血管闭塞,在68例外部验证集中ROC的AUC为0.80。Wei等[27]设计了一种3D-CNN,用于头颅CTA图像上动脉瘤的自动检出,并将人工智能检出结果与金标准DSA检查结果进行对照,在212例患者中,人工智能系统诊断动脉瘤的敏感度、特异度和准确率分别为84.9%、18.2%和74.5%。②预测:Nielsen等[28]的研究构建了一个深度学习CNN,用以预测静脉注射组织多肽抗原(tPA)治疗后的MRI-DWI图像上最终梗死体积,输入9个生物标志物,对比了29例未经静脉注射tPA治疗的患者和35例接受静脉注射tPA患者的数据,该模型预测最终梗死体积的准确率为88%,优于其他模型。Ho等[29]运用深度学习方法对脑梗死患者的多模态MRI图像进行发病时间点的预测分类(发病时间是否在4.5 h内),模型预测敏感度达0.788,阴性预测值达0.609。Kim等[30]构建了一个基于支持向量机的机器学习模型,整合了大脑中动脉区域脑梗死患者病变区域范围和其他临床变量,成功预测了患者3个月后视野缺陷的改善情况。Lee等[31]构建了贝叶斯网络模型,分析处理MRI-DWI图像及临床信息,用于预测脑梗死患者6个月后吞咽困难的恢复情况,AUC为0.802。Nishi等[17]的研究基于CNN模型对脑梗死患者的MRI图像进行分析处理,预测脑梗死患者的90d-mRS,AUC达0.81±0.06。Wei等[22]利用MRI-DWI图像及临床信息,构建了机器学习模型,实现了对前循环非腔隙性脑梗死患者重症卒中转化风险的预测,AUC达0.835 8。
4 前景与展望随着计算机技术及医学大数据的蓬勃发展,医学影像的智能诊断及预测将是必然趋势。目前,医学影像相关的人工智能辅助诊断技术已逐步应用到临床实践工作中。同时,人工智能与医学影像的融合也面临着巨大挑战,尚需大量的准备工作,以实现人工智能技术与医学影像分析的完美结合。
首先,高质量的临床影像多维数据库是人工智能技术得以应用的基础[32]。人工智能在脑梗死方面可利用的数据除影像数据外,还包括临床病史资料、检验信息、生物学信息等。目前,医学信息正逐步走向数字化,如能够将这些数据加以结构化、系统化的收集,并构建出临床影像多维的标准化数据库(包含影像、临床病史资料、检验信息等),将会为人工智能技术与医学影像的融合奠定坚实的基础。
其次,构建多中心、大样本、标准化标注的临床影像数据库是精准智能诊断及预测模型构建的前提条件[33]。目前,尚缺乏标准化的数据处理方法和智能存储、随访、分析及共享模式,需不断完善标准化数据库的建设。已有研究中,数据库多为单中心、小样本量数据库,高质量数据库构建的关键点在于影像数据采集的质量和广泛代表性,因此,需构建多中心、大样本的数据库。医学影像人工智能模型的敏感度及特异度仍有待提升,准确率是医学影像人工智能模型的核心部分,可通过在训练数据集内使用交叉验证法来增加模型的稳定性,应用独立的数据集验证模型的鲁棒性和泛化性,来进一步完善模型。另外,目前尚缺乏标注的标准化共识规范,数据库质量和规模参差不齐,不同机构采用的标注方式和结果各不相同。因此,有必要提高数据集的标注准确率,从而有效提高模型的准确率和鲁棒性。
在临床工作中,已积累了大量脑梗死的影像学信息及临床信息,而人工智能需基于大样本、标准化、结构化的数据库才能更好地运行。因此,实现成像协议的标准化、保证数据的准确率、开发用户友好的图像上传服务器、构建大存储容量的云系统,建立一个大样本、多中心、标准化的脑梗死数据库势在必行。
| [1] |
韩小伟, 李茗, 张冰. 人工智能在脑卒中神经影像中的应用[J]. 协和医学杂志, 2021, 12(5): 749-754. |
| [2] |
DO L N, BAEK B H, KIM S K, et al. Automatic assessment of ASPECTS using diffusion-weighted imaging in acute ischemic stroke using recurrent residual convolutional neural network[J]. Diagnostics (Basel), 2020, 10(10): 803. DOI:10.3390/diagnostics10100803 |
| [3] |
NIKA G, DIETRICH U, RADBRUCH A, et al. Detection of early infarction signs with machine learning-based diagnosis by means of the Alberta Stroke Program Early CT score (ASPECTS) in the clinical routine[J]. Neuroradiology, 2018, 60(9): 889-901. DOI:10.1007/s00234-018-2066-5 |
| [4] |
YOSHIMOTO T, INOUE M, YAMAGAMI H, et al. Use of diffusion-weighted imaging-alberta stroke program early computed tomography score (DWI-ASPECTS) and ischemic core volume to determine the malignant profile in acute stroke[J]. J Am Heart Assoc, 2019, 8(22): 012558. |
| [5] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9): 666-681. DOI:10.3760/cma.j.issn.1006-7876.2018.09.004 |
| [6] |
金征宇. 前景与挑战: 当医学影像遇见人工智能[J]. 协和医学杂志, 2018, 9(1): 2-4. |
| [7] |
MURRAY N M, UNBERATH M, HAGER G D, et al. Artificial intelligence to diagnose ischemic stroke and identify large vessel occlusions: a systematic review[J]. J Neurointerv Surg, 2020, 12(2): 156-164. DOI:10.1136/neurintsurg-2019-015135 |
| [8] |
MAYO R C, LEUNG J. Artificial intelligence and deep learning-Radiology's next frontier?[J]. Clin Imaging, 2017, 49: 87-88. |
| [9] |
CAI L, GAO J, ZHAO D. A review of the application of deep learning in medical image classification and segmentation[J]. Ann Transl Med, 2020, 8(11): 713. DOI:10.21037/atm.2020.02.44 |
| [10] |
MCBEE MORGAN P, AWAN OMER A, COLUCCI ANDREW T, et al. Deep learning in radiology[J]. Acad Radiol, 2018, 25(11): 1472-1480. DOI:10.1016/j.acra.2018.02.018 |
| [11] |
QIU W, KUANG H, TELEG E, et al. Machine learning for detecting early infarction in acute stroke with noncontrast-enhanced CT[J]. Radiology, 2020, 294(3): 638-644. DOI:10.1148/radiol.2020191193 |
| [12] |
SOLTANPOUR M, GREINER R, BOULANGER P, et al. Improvement of automatic ischemic stroke lesion segmentation in CT perfusion maps using a learned deep neural network[J]. Comput Biol Med, 2021, 137: 104849. DOI:10.1016/j.compbiomed.2021.104849 |
| [13] |
TANG A, TAM R, CADRIN-CHENEVERT A, et al. Canadian association of radiologists white paper on artificial intelligence in radiology[J]. Can Assoc Radiol J, 2018, 69(2): 120-135. DOI:10.1016/j.carj.2018.02.002 |
| [14] |
傅璠, 卢洁. 人工智能在缺血性脑卒中影像的研究进展[J]. 中华老年心脑血管病杂志, 2020, 22(10): 1110-1112. DOI:10.3969/j.issn.1009-0126.2020.10.028 |
| [15] |
LEE H, JUNG K, KANG D W, et al. Fully automated and real-time volumetric measurement of infarct core and penumbra in diffusion-and perfusion-weighted MRI of patients with hyper-acute stroke[J]. J Digit Imaging, 2020, 33(1): 262-272. DOI:10.1007/s10278-019-00222-2 |
| [16] |
BOLDSEN J K, ENGEDAL T S, PEDRAZA S, et al. Better diffusion segmentation in acute ischemic stroke through automatic tree learning anomaly segmentation[J]. Front Neuroinform, 2018, 4(25): 12-21. |
| [17] |
NISHI H, OISHI N, ISHⅡ A, et al. Deep learning-derived high-level neuroimaging features predict clinical outcomes for large vessel occlusion[J]. Stroke, 2020, 51(5): 1484-1492. DOI:10.1161/STROKEAHA.119.028101 |
| [18] |
KIM Y C, LEE J E, YU I, et al. Evaluation of diffusion lesion volume measurements in acute ischemic stroke using encoder-decoder convolutional network[J]. Stroke, 2019, 50(6): 1444-1451. DOI:10.1161/STROKEAHA.118.024261 |
| [19] |
WU O, WINZECK S, GIESE A K, et al. Big data approaches to phenotyping acute ischemic stroke using automated lesion segmentation of multi-center magnetic resonance imaging data[J]. Stroke, 2019, 50(7): 1734-1741. DOI:10.1161/STROKEAHA.119.025373 |
| [20] |
KAMNITSAS K, LEDIG C, NEWCOMBE V F J, et al. Efficient multi-scale 3D CNN with fully connected CRF for accurate brain lesion segmentation[J]. Med Image Anal, 2017, 2(36): 61-78. |
| [21] |
CHEN L, BENTLEY P, RUECKERT D. Fully automatic acute ischemic lesion segmentation in DWI using convolutional neural networks[J]. Neuroimage Clin, 2017, 6(13), 15: 633-643.
|
| [22] |
WEI L, CAO Y, ZHANG K, et al. Prediction of Progression to severe stroke in initially diagnosed anterior circulation ischemic cerebral infarction[J]. Front Neurol, 2021, 12: 652757. DOI:10.3389/fneur.2021.652757 |
| [23] |
TAKAHASHI N, LEE Y, TSAI D Y, et al. An automated detection method for the MCA dot sign of acute stroke in unenhanced CT[J]. Radiol Phys Technol, 2014, 7(1): 79-88. DOI:10.1007/s12194-013-0234-1 |
| [24] |
NAGEL S, SINHA D, DAY D, et al. e-ASPECTS software is non-inferior to neuroradiologists in applying the ASPECT score to computed tomography scans of acute ischemic stroke patients[J]. Int J Stroke, 2017, 12(6): 615-622. DOI:10.1177/1747493016681020 |
| [25] |
CHENG X, SU X, SHI J, et al. Comparison of automated and manual DWI-ASPECTS in acute ischemic stroke: total and region-specific assessment[J]. Eur Radiol, 2021, 31(6): 4130-4137. DOI:10.1007/s00330-020-07493-2 |
| [26] |
CZAP A L, BAHR-HOSSEINI M, SINGH N, et al. Machine learning automated detection of large vessel occlusion from mobile stroke unit computed tomography angiography[J]. Stroke, 2022, 53(5): 1651-1656. DOI:10.1161/STROKEAHA.121.036091 |
| [27] |
WEI X, JIANG J, CAO W, et al. Artificial intelligence assistance improves the accuracy and efficiency of intracranial aneurysm detection with CT angiography[J]. Eur J Radiol, 2022, 149: 110169. DOI:10.1016/j.ejrad.2022.110169 |
| [28] |
NIELSEN A, HANSEN M B, TIETZE A, et al. Prediction of tissue outcome and assessment of treatment effect in acute ischemic stroke using deep learning[J]. Stroke, 2018, 49(6): 1394-1401. |
| [29] |
HO K C, SPEIER W, EL-SADEN S, et al. Classifying acute ischemic stroke onset time using deep imaging features[J]. AMIA Annu Symp Proc, 2018, 4(16), 2017: 892-901.
|
| [30] |
KIM B J, KIM Y H, KIM N, et al. Lesion location-based prediction of visual field improvement after cerebral infarction[J]. PLoS One, 2015, 10(11): 0143882. |
| [31] |
LEE W H, MIN H L, HAN G S, et al. Development of a novel prognostic model to predict 6-month swallowing recovery after ischemic stroke[J]. Stroke, 2020, 51(2): 440-448. |
| [32] |
LEE E J, KIM Y H, KIM N, et al. Deep into the brain: artificial intelligence in stroke imaging[J]. J Stroke, 2017, 19(3): 277-285. |
| [33] |
KAMAL H, LOPEZ V, SHETH S A. Machine learning in acute ischemic stroke neuroimaging[J]. Front Neurol, 2018, 11(8): 945. |
 2023, Vol. 21
2023, Vol. 21


