| 基于影像组学构建乳腺癌前哨淋巴结转移预测模型的研究 |
2. 青岛大学附属烟台毓璜顶医院影像科,山东 烟台 264000;
3. GE Healthcare China,上海 200000
乳腺癌是我国女性最常见的恶性肿瘤之一,其发病率近年来一直呈上升趋势[1]。前哨淋巴结(sen鄄tinel lymph node,SLN)转移状况是影响乳腺癌患者预后的关键因素,能帮助临床医师判断和决定手术清扫范围、是否进行辅助化疗,以及评估生存预后[2-3]。目前确定SLN状态最可靠的方法是腋窝淋巴结清扫和病理检查。但腋窝淋巴结清扫可能导致治疗过度,增加不必要的术后并发症[4]。因此,寻找一种能在治疗前无创、准确地预测乳腺癌患者SLN状态的方法有重要的临床价值。
近年来,影像组学研究(如肺癌、结直肠癌、食管癌等)已显示其在预测肿瘤的基因表型、病理类型、淋巴结转移预后等方面具有重要潜能[5-7]。MRI动态增强扫描(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)在乳腺疾病中的应用必不可少,可提供关于肿瘤高空间分辨力的解剖和DCE参数信息[8]。因此,本研究探讨利用DCE-MRI图像的影像组学特征和DCE参数建立的预测模型在预测乳腺癌SLN转移中的价值。
1 资料与方法 1.1 一般资料回顾性分析2017年12月1日至2018年5月1日期间连续发现257例经病理证实的浸润性乳腺癌。纳入标准:①手术或穿刺活检前均行乳腺常规DCE-MRI扫描,扫描参数及序列统一;②乳腺SLN经病理活检;③原发单发病灶,直径>5 mm。排除标准:①DCE-MRI表现为非肿块强化者;②既往有乳腺手术、化疗、放疗、激素治疗史;③图像质量不理想者。最终纳入164例(78例SLN阳性,86例SLN阴性)。按照3:1的比例将数据集分为训练组及验证组,前者用于构建模型,后者用于验证模型;其中训练组124例:收集时间2017年12月至2018年3月;验证组40例:收集时间2018年4月至2018年5月。
1.2 仪器与方法采用GE 750W 3.0 T超导MRI扫描仪及专用8通道乳腺线圈进行扫描。患者取俯卧位,双侧乳腺自然悬垂并适当固定于线圈中。扫描序列及参数:①轴位T1WI TR 520 ms,TE 9 ms,层厚5 mm,层距1 mm,矩阵320×256;②轴位脂肪抑制T2WI TR 5 200 ms,TE 90 ms,层厚5 mm,层距1 mm,矩阵320×256;③平扫完成后行乳腺轴位DCE TR 6.2 ms,TE 2.3 ms,翻转角15°,矩阵288× 320,视野36 cm×36 cm,层厚2 mm,无间隔。在注射对比剂前先扫蒙片,后由高压注射器经手背静脉团注对比剂Gd-DTPA,剂量0.2 mmol/kg体质量,流率2.8 mL/s,后注射等量生理盐水,即刻连续扫描延迟至8 min,单期扫描时间16 s,共扫描30期。
1.3 图像处理及分析 1.3.1 DCE参数计算首先将DCE-MRI多翻转角图像和动态增强图像输入软件Omni-Kinetics(GE医疗,中国)进行分析计算。首先进行图像预处理,再利用多翻转角成像数据计算T1-mapping,将ROI放置于胸主动脉的中心获得动脉输入函数,选取达峰期相图像,使用双室模型进行定量分析,得到4个定量参数:容积转移常数(volume transfer constant,Ktrans)、速率常数(efflux rate constant,Kep)、细胞外血管外体积分数(extracellular -extravascular volume fraction,V e)、血浆体积分数(plasma volume fraction,Vp);以及4个半定量参数:达峰时间、最大斜率、浓度-时间曲线的AUC、最大浓度。由2名有10年乳腺影像诊断经验的放射科医师(医师1、2)在轴位DCE图像上病灶最大层面内手动选取ROI。
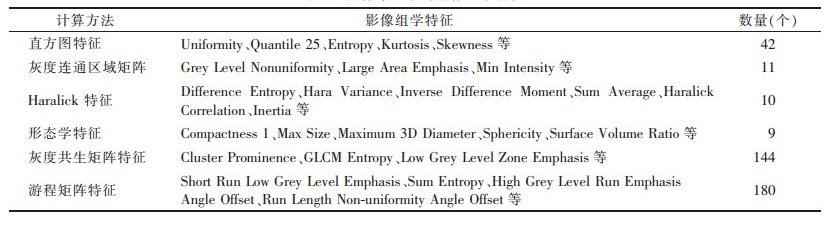
1.3.2 影像组学特征提取在A.K.软件(GE医疗,中国)对DCE-MRI图像进行分析。选取显示肿瘤最大层面,采用手动分割法,根据DCE-MRI的TIC,选择强化程度最明显的一期图像进行影像组学分析,这是肿瘤与背景对比度达到峰值的时间点[9],并在全部肿瘤区域勾画ROI(图 1)。由医师1、2在不知道病理情况下手工绘制ROI,得到396个影像组学特征(表 1)。
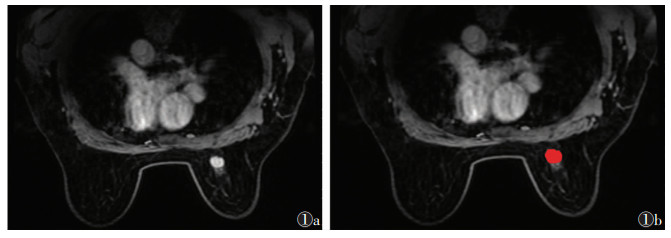 |
| 图 1 女,61岁,右侧乳腺浸润性导管癌Ⅱ级,无淋巴结转移 图 1a,1b 分别为DCE-MRI图和病灶ROI示意图 |
| 表 1 图像中提取的影像组学特征 |
 |
1.3.3 特征选择
采用R语言中的Lasso-Logistic回归模型对396个影像组学特征进行筛选,最终筛选出28个特征,包括:Short Run Low Grey Level Emphasis、Sum Entropy、Compactness 1、Inertia、stdDeviation、Cluster Prominence、Correlation、GLCM Entropy、Inverse Difference Moment、Entropy、Sum Average、Skewness、Difference Entropy、Uniformity、Volume Count、Quantile 25、Max Size、Kurtosis、Min Intensity、Haralick Correlation、Surface Volume Ratio、Grey Level Nonuniformity、Range、UPP、Sphericity、RMS、Maximum 3D diameter、Hara Variance纳入到Logistics回归模型。
1.3.4 模型构建及统计学分析对筛选出的28个影像组学特征联合DCE参数Ktrans、Kep、Ve、Vp、TTP、Slopemax、AUC及Conmax,采用Logistics回归模型分别建立单纯影像组学模型、单纯DCE参数模型及联合模型。应用AUC评价以上3个模型的预测效能,并对模型的ROC曲线行DeLong检验,计算相应的准确度、敏感度和特异度,包括95%CI。然后在验证组中对模型的效能进行验证。
使用R软件3.5.1版进行统计分析。使用独立样本t检验对SLN阳性、SLN阴性2组年龄、肿瘤大小进行比较;采用χ2检验比较2组组织学分级、分子分型的差异。以P<0.05为差异有统计学意义。
使用组内和组间相关系数(ICC)评估影像组学特征在观察者内和观察者间的一致性。最初随机选择25张MRI图像由医师1、2进行ROI分割和特征提取。医师1在1周后重复相同的步骤,ICC>0.75表示特征提取具有良好一致性。剩余图像的分割也由医师1完成。
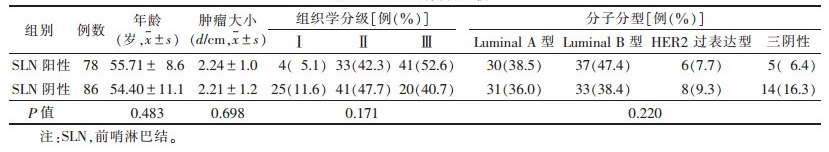
2 结果 2.1 2组患者基本资料比较(表 2)SLN阳性、SLN阴性2组的年龄、肿瘤大小、组织学分级、分子分型比较差异均无统计学意义(均P>0.05)。
| 表 2 2组基线资料比较 |
 |
2.2 影像组学特征在观察者内和观察者间的一致性评价
2名观察者内的ICC为0.813~0.882,观察者间的ICC为0.869~0.894,均大于0.75,一致性均较好。
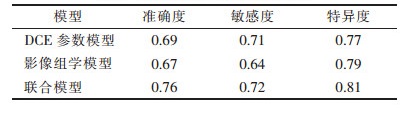
2.3 预测模型的构建及评价预测模型SLN转移诊断效能的ROC曲线,见图 2。单纯影像组学模型、单纯DCE参数模型及联合模型诊断的最佳截断值分别是0.15、0.13、-0.21。在训练组中单纯影像组学模型AUC的95%CI为0.81(0.72,0.89),单纯DCE参数模型AUC的95%CI为0.77(0.68,0.86),联合预测模型的AUC的95%CI为0.80(0.72,0.89);在验证组中单纯影像组学模型AUC的95% CI为0.74(0.59,0.89),单纯DCE参数模型AUC的95%CI为0.74(0.59,0.90),联合预测模型的AUC的95%CI为0.76(0.61,0.91),Delong检验显示差异无统计学意义(P>0.05)。联合模型的效能稍高,其准确度为0.76,特异度为0.81,敏感度为0.72(表 3)。
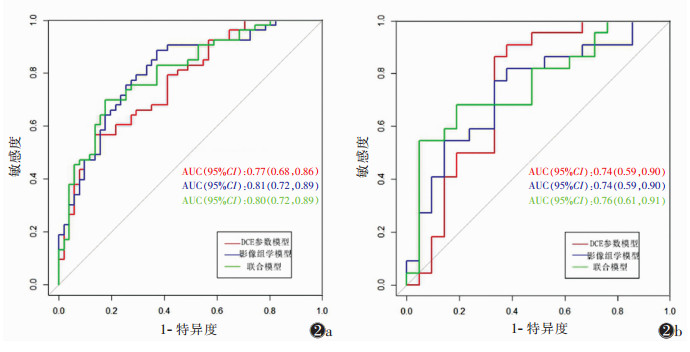 |
| 图 2 影像组学模型、DCE参数模型及联合模型预测淋巴结状态的ROC曲线 图2a,2b 分别为训练组、验证组 |
| 表 3 3种模型的验证组预测结果 |
 |
3 讨论
本研究将DCE-MRI提取影像组学特征和DCE参数联合,用于术前无创预测乳腺癌SLN的转移,且在验证组中证明模型诊断效能。本研究表明,联合模型的效能稍高,说明基于DCE-MRI图像提取影像组学特征及DCE参数构建的预测模型,作为一种无创性预测乳腺癌SLN转移的工具,有良好的应用前景。
SLN状况是影响乳腺癌患者预后的关键因素,对其治疗至关重要[2]。目前腋窝淋巴结清扫和病理检查是确定乳腺癌患者腋窝淋巴结状态最可靠的方法。然而,对于大多数早期乳腺癌患者来说,腋窝淋巴结清扫可能导致治疗过度,增加不必要的术后并发症。因此,寻找无创预测乳腺癌SLN转移的方法有重要意义。乳腺MRI通过视觉评估对腋窝淋巴结状态的诊断虽有价值,但准确率不高。另外,在大多数乳腺MRI扫描中,乳腺表面线圈主要集中在乳腺区域,但部分阳性淋巴结可能位于线圈边缘,部分甚至可能不在成像范围内[10]。本研究以乳腺肿瘤本身为研究对象,可能有助于避免上述限制。影像学检查,目前研究多基于MRI征象进行主观分析或半定量分析,未能充分挖掘蕴含于图像中的深层特征。
乳腺癌通常具有不同的组织学、分子和临床表型,并可能表现为影像学异质性。影像组学特征可反映肿瘤大小、形状、强度和纹理[11-12]。研究[13-14]表明,影像组学可用于预测肺癌、结直肠癌等恶性肿瘤的淋巴结转移。在乳腺癌影像组学研究方面,也已有较多研究[5-6, 12]成功地基于MRI挖掘影像组学特征,已用于Ki-67的量化、分子分型及预后预测等。HUANG等[13]的研究表明,与传统CT评估相比,影像组学可提高术前结直肠癌淋巴结的预测准确率,用于评估肿瘤的淋巴结转移。本研究显示,在预测模型中结合影像组学特征有较满意的效能,表明DCE-MRI的影像组学特征中包含关于肿瘤转移的有价值的信息。这与DONG等[15]利用T2WI压脂序列和DWI的影像组学特征预测乳腺癌SLN转移的研究(AUC=0.805)结果相似,但与DWI相比,DCE-MRI目前在医院应用更广泛。
DCE-MRI不仅可提供原发性乳腺癌丰富的影像组学信息,还能提供反映肿瘤DCE参数特征的功能信息。DCE参数模型可量化血管内和间质间隙的对比剂交换,提供肿瘤血流量、微血管系统和毛细血管通透性的测量[8]。LOISELLE等[16]发现,乳腺癌原发灶的DCE参数特征与其腋窝淋巴结转移相关。因此,肿瘤DCE参数特征变化在原发病变和淋巴结转移的联系中存在一种可能的机制。
本研究的局限性:①肿瘤的ROI由放射科医师手工绘制,可能使观察者之间的变异性增加,需要一种自动、可靠和有效的肿瘤分割方法。②为回顾性研究,样本量相对较小。研究数据组来自一个医疗中心,缺少对结果的泛化性和稳健性的评价。下一步研究中将对多中心数据进行更严格的分析。③选择肿瘤最具有代表性的层面进行初步研究,虽然这在以往研究中广泛应用[17],但与整个肿瘤体积相比,可能丢失一些重要的空间信息。④仅对用DCE-MRI序列提取的影像特征进行研究,由于DCE-MRI在乳腺MRI诊断中的重要作用,未对DWI、T2WI图像进行分析,后续研究中需应用多模态MRI挖掘影像组学信息。⑤为了使模型更加简单、提高应用的广泛性,未融合临床、病理及分子生物学信息,这可能降低模型的效能,后续研究中将进一步探讨。
综上所述,本研究建立的联合影像组学标签、DCE参数的影像组学模型,能有效预测术前乳腺癌患者SLN的转移情况,有助于术前乳腺癌的准确分期及制订正确的治疗方案。
| [1] |
左婷婷, 陈万青. 中国乳腺癌全人群生存率分析研究进展[J]. 中国肿瘤临床, 2016, 43(14): 639-642. DOI:10.3969/j.issn.1000-8179.2016.14.503 |
| [2] |
QIU P F, LIU J J, WANG Y S, et al. Risk factors for sentinel lymph node metastasis and validation study of the mskcc nomo gram in breast cancer patients[J]. Jpn J Clin Oncol, 2012, 42(11): 1002-1007. DOI:10.1093/jjco/hys150 |
| [3] |
WEIGEL M T, DOWSETT M. Current and emerging biomarkers in breast cancer:prognosis and prediction[J]. Endocr Relat Can cer, 2010, 17(4): 245-262. DOI:10.1677/ERC-10-0136 |
| [4] |
SAKORAFAS G H, PEROS G, CATALIOTTI L, et al. Lymphede ma following axillary lymph node dissection for breast cancer[J]. Surg Oncol, 2006, 15(3): 153-165. DOI:10.1016/j.suronc.2006.11.003 |
| [5] |
ANTROPOVA N, HUYNH B Q, GIGER M L. A deep feature fusion methodology for breast cancer diagnosis demonstrated on three imaging modality datasets[J]. Med Phys, 2017, 44(10): 5162-5171. DOI:10.1002/mp.12453 |
| [6] |
LI H, ZHU Y, BURNSIDE E S, et al.Quantitative MRI radiomics in the prediction of molecular classifications of breast cancer subtypes in the TCGA/TCIA data set[J/OL].NPJ Breast Cancer, 2016, 2 : 16012.[2016-05-11 ]http://pubmed.ncbi.nlm.nih.gov/ 27853751/.
|
| [7] |
LI H, ZHU Y T, ELIZABETH S B, et al. MR imaging radiomics signatures for predicting the risk of breast cancer recurrence as given by research versions of MammaPrint, Oncotype DX, and PAM50 gene assays[J]. Radiology, 2016, 281(2): 382-391. DOI:10.1148/radiol.2016152110 |
| [8] |
POELLINGER A, EL-GHANNAM S, DIEKMANN S, et al. Correl ation between enhancement characteristics of MR Mammography and capillary density of breast lesions[J]. Eur J Radiol, 2014, 83(12): 2129-2136. DOI:10.1016/j.ejrad.2014.09.007 |
| [9] |
LIU Z, LI Z, QU J, et al. Radiomics of multiparametric MRI for pretreatment prediction of pathologic complete response to neoa- djuvant chemotherapy in breast cancer:a multicenter study[J]. Clin Cancer Res, 2019, 25(12): 3538-3547. DOI:10.1158/1078-0432.CCR-18-3190 |
| [10] |
YUN S J, SOHN Y M, SEO M. Re:Differentiation of benign and metastatic axillary lymph nodes in breast cancer:additive value of MRI computer-aided evaluation[J]. Clin Radiol, 2016, 71(7): 711. |
| [11] |
AERTS H J. The potential of radiomic-based phenotyping in precision medicine:a review[J]. JAMA Oncol, 2016, 2(12): 1636-1642. DOI:10.1001/jamaoncol.2016.2631 |
| [12] |
MARUSYK A, ALMENDRO V, POLYAK K. Intra-tumour hete rogeneity:a looking glass for cancer?[J]. Nat Rev Cancer, 2012, 12(5): 323-334. DOI:10.1038/nrc3261 |
| [13] |
HUANG Y Q, LIANG C H, HE L, et al. Development and val idation of a radiomics nomogram for preoperative prediction of lymph node metastasis in colorectal cancer[J]. J Clin Oncol, 2016, 34(18): 2157-2164. DOI:10.1200/JCO.2015.65.9128 |
| [14] |
ZHONG Y, YUAN M, ZHANG T, et al. Radiomics approach to prediction of occult mediastinal lymph node metastasis of lung adenocarcinoma[J]. AJR Am J Roentgenol, 2018, 211(1): 109-113. DOI:10.2214/AJR.17.19074 |
| [15] |
DONG Y, FENG Q, YANG W, et al. Preoperative prediction of sentinel lymph node metastasis in breast cancer based on rad iomics of T2-weighted fat-suppression and diffusion-weighted MRI[J]. Eur Radiol, 2018, 28(2): 582-591. DOI:10.1007/s00330-017-5005-7 |
| [16] |
LOISELLE C, EBY P R, KIM J N, et al. Preoperative MRI improves prediction of extensive occult axillary lymph node metastases in breast cancer patients with a positive sentinel lymph node biopsy[J]. Acad Radiol, 2014, 21(1): 92-98. DOI:10.1016/j.acra.2013.10.001 |
| [17] |
LEE H J, RHA S Y, CHUNG Y E, et al. Tumor perfusion-rela- ted parameter of diffusion-weighted magnetic resonance imaging: correlation with histological microvessel density[J]. Magn Reson Med, 2014, 71(4): 1554-1558. DOI:10.1002/mrm.24810 |
 2020, Vol. 18
2020, Vol. 18

