| ADC值在下腔静脉梗阻型布-加综合征肝脏氧化应激损伤中的应用初探 |
2. 安徽省合肥市第三人民医院影像科, 安徽 合肥 231000;
3. 中国科学技术大学附属第一医院/安徽省立医院介入放射科, 安徽 合肥 231000
2. Department of Imaging, Third People's Hospital of Hefei, Hefei 231000, China;
3. Department of Interventional Radiology, First Affiliated Hospital of USTC, Anhui Provincial Hospital, Hefei 231000, China
布-加综合征(Budd-Chiari syndrome,BCS)是肝静脉流出道梗阻导致的一系列症候群[1-2]。肝静脉梗阻后改变细胞内外水分子弥散状态和微循环的灌注,进而影响DWI信号[3-4]。DWI是反映水分子布朗运动的MRI功能成像技术,可检测水分子扩散信息[5]。DWI已用于评估脂肪肝、乙肝后肝硬化等其他肝病[6],但其在BCS淤血性肝损伤中的应用报道较少,应用价值尚未形成共识。因此,本研究参考Cheng等[3]的方法建立BCS动物模型,探讨ADC值在BCS肝损伤模型中的应用价值。
1 资料与方法 1.1 一般资料本研究经安徽医科大学附属省立医院(安徽省立医院)伦理委员会批准,自动物实验中心购买体质量215~275 g的健康雄性SD大鼠135只[许可证号:SCXK(苏)2005-0001],随机分为对照组(15只)、模型组(60只)和假手术组(60只),模型组及假手术组又各分为4个亚组(1、4、8、12周组,每亚组15只)。
1.2 方法 1.2.1 模型制备在12 h明暗交替光照周期、温度15~25 ℃、湿度50%~60%条件下清洁饲养,丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒均购自上海信裕生物科技有限公司,3 F微导管购自日本泰尔茂公司。模型组于剑突下正中开腹分离肝镰状韧带,暴露肝后段下腔静脉,平行紧贴下腔静脉以3 F微导管,以0号线环绕结扎后抽出(图 1)。假手术组未结扎肝后段下腔静脉,其他过程同模型组。对照组仅常规饲养。
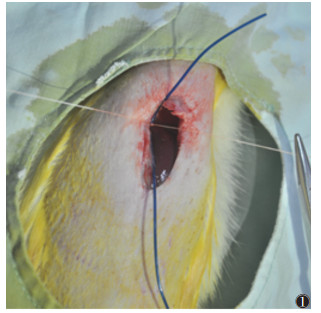 |
| 注:开腹暴露肝后段下腔静脉,平行紧贴下腔静脉以3 F微导管,并以0号线环绕结扎 图 1 模型组结扎下腔静脉图 |
1.2.2 MRI及DSA检查
对照组于第12周末,模型组及假手术组亚组分别于实验后1、4、8、12周末晨起停饲。MRI检查前以3.6%水合氯醛腹腔麻醉,剂量1.0 mL/100 g体质量。大鼠取仰卧位,腹部加压固定,将肝脏置于腕关节线圈中心。使用GE HDXT 1.5 T MRI常规行T1WI、T2WI序列及DWI检查。DWI序列的b值取800 s/mm2,SE-EPI序列加脂肪抑制(SPAIR),扫描参数:TR 1 250 ms,TE 65 ms,视野56 mm×56 mm,层距0.3 mm,层厚3.0 mm,翻转角90°,矩阵192×192,激励次数8。图像后处理:测量ADC值,ROI大小15~20 mm2,尽量避开肝脏边缘及胆管、血管,取3个ROI的平均值行进一步分析。使用GE Innova 3100-IQ DSA行DSA检查,各组大鼠于任意一侧下肢消毒、铺洞巾,以21 G静脉留置针穿刺股静脉,注射对比剂观察下腔静脉血流情况。
1.2.3 标本采集及检测分别于实验后1、4、8、12周末,取大鼠肝组织标本,制作组织切片行HE染色,余标本制备肝组织匀浆,采用双抗体夹心法[3]检测MDA、SOD的表达量,严格参照试剂盒说明书相应步骤操作。
1.2.4 标本采集及病理染色取适量MRI测量ROI相应层面的新鲜肝组织,10%福尔马林固定24 h后,石蜡包埋,制作肝脏病理组织切片,用HE染色,观察肝脏病理染色情况,余标本均置于-80 ℃冰箱冷藏备用。
1.3 统计学方法采用SPSS 22.0统计软件,检验数据是否符合正态分布及方差齐性,正态数据以x±s表示,ADC值、MDA、SOD在对照组与模型组及假手术组间的差异行单因素方差分析,模型组与假手术组间的差异行两因素方差分析,各亚组间多重比较行LSD检验;以Pearson法分析ADC值、MDA、SOD间的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 成模情况对照组存活15只,假手术组1、4、8、12周亚组分别存活14、14、15、15只,对照组及假手术组活动如常、反应机警,DSA均无阳性表现。模型组各亚组均存活14、13、13、13只,存活大鼠均成模,大鼠术后毛色灰暗无光泽,活动逐渐减少、反应迟钝,肝后段下腔静脉管腔变窄,远端扩张,4周后见侧支循环逐渐形成(图 2)。
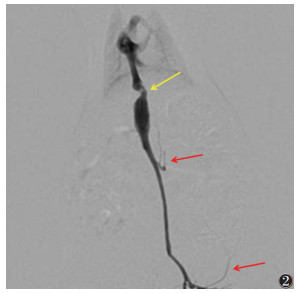 |
| 注:肝后段下腔静脉管腔变窄(黄箭),远端扩张,见侧支循环形成(红箭) 图 2 模型组4周DSA图 |
2.2 MRI表现
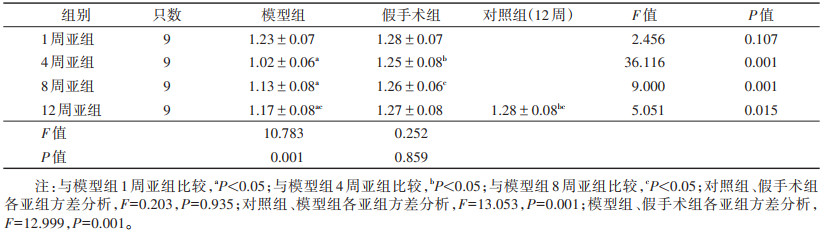
对照组、假手术组及模型组大鼠12周常规T1WI未见明显异常,肝脏表面光滑,实质信号均匀,肝叶比例协调(图 3~5);各组随机抽取9只,纳入数据分析。各组大鼠ADC值比较见表 1,图 6~8。对照组与假手术组各亚组ADC值比较,差异均无统计学意义(均P > 0.05);模型组各亚组ADC值均低于对照组及假手术组各亚组,差异均有统计学意义(均P < 0.05)。两两比较,模型组4周亚组及8周亚组均低于对照组及同一时间点的假手术亚组。模型组内ADC值随下腔静脉结扎时间延长呈先下降后升高趋势,1周亚组高于4、8周亚组,4周亚组低于12周亚组,差异均有统计学意义(均P < 0.05),ADC值在4周亚组最低(表 1)。
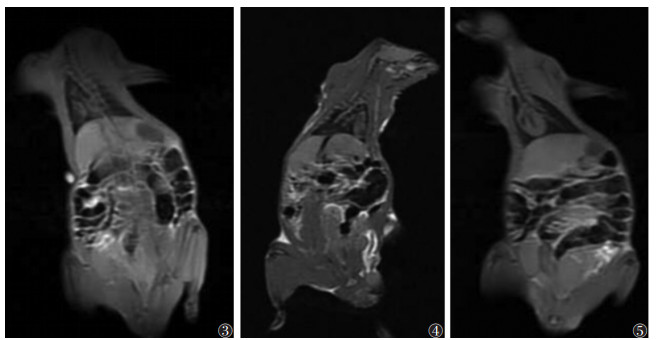 |
| 注:肝脏表面光滑,肝叶比例协调,实质信号均匀 图 3~5 对照组、假手术组和模型组大鼠12周肝脏T1WI冠状位图 |
| 表 1 各组大鼠ADC值比较(×10-3 mm2/s,x±s) |
 |
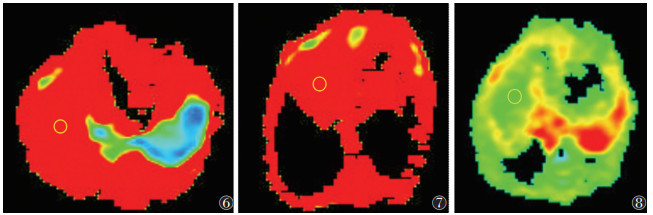 |
| 图 6~8 对照组、假手术组和模型组12周肝脏ADC伪彩图 |
2.3 MDA、SOD结果(表 2,3)
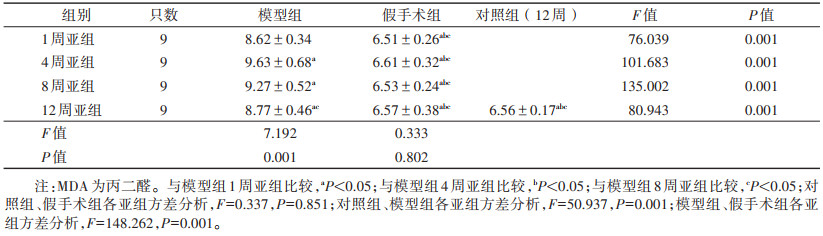
| 表 2 各组大鼠MDA比较(nmol/L,x±s) |
 |
| 表 3 各组大鼠SOD比较(nmol/L,x±s) |
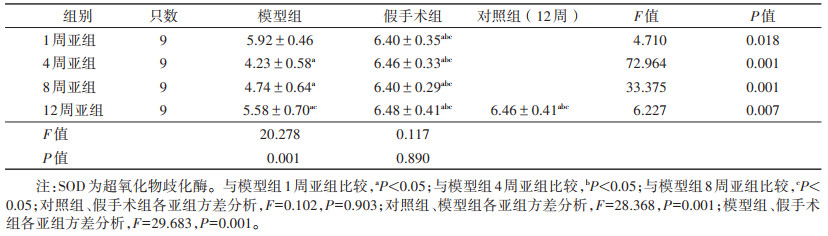 |
对照组与假手术组各亚组间的MDA、SOD水平比较,差异均无统计学意义(均P > 0.05)。模型组各亚组MDA均高于对照组及假手术组各亚组,模型组各亚组SOD均低于对照组及假手术组各亚组,差异均有统计学意义(均P < 0.05);两两比较,同一时间的模型组亚组与假手术组亚组MDA、SOD值比较,差异均有统计学意义(均P < 0.05)。
模型组MDA先升高后下降(第4周最高),SOD先下降后升高(第4周最低),在模型组内各亚组比较,差异均有统计学意义;两两比较,模型组MDA、SOD在各亚组间多重比较,除了1周亚组与12周亚组、4周亚组与8周亚组间差异均无统计学意义之外,其余各亚组间多重比较均有统计学意义(均P < 0.05)。
2.4 病理结果假手术组及对照组观察至第12周,肝细胞规律排列,形态正常,核仁清晰,肝血窦无扩张(图 9,10)。模型组肝脏病理损伤随病程进展而加重,肝血窦扩张,小叶中心性肝细胞萎缩、变性、坏死,胞浆红染,红细胞淤积,以12周亚组最明显(图 11~14)。
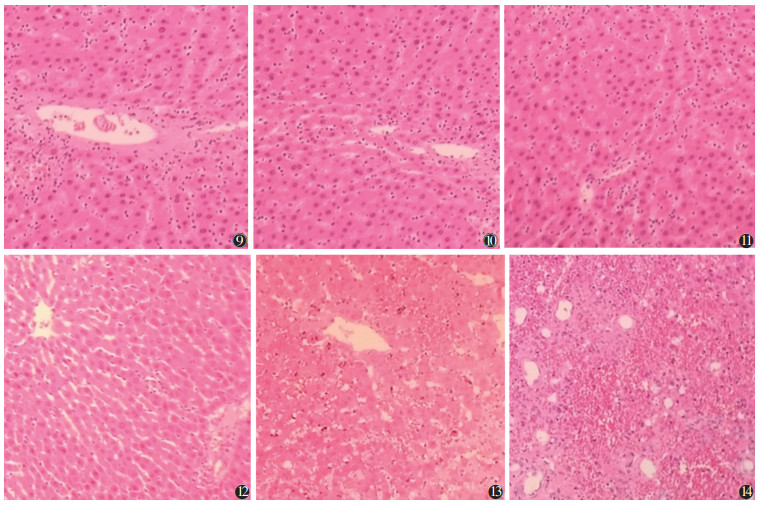 |
| 图 9 对照组12周大鼠病理图(HE染色,高倍放大) 图 10 假手术组12周大鼠病理图(HE染色,高倍放大) 图 11~14 模型组大鼠1、4、8、12周病理图(HE染色,高倍放大) |
2.5 各指标相关性分析
模型组ADC值与SOD呈正相关(r=0.828,P=0.001),与MDA呈负相关(r=-0.756,P=0.001),SOD与MDA呈负相关(r=-0.834,P=0.001)(图 15~17,表 4)。
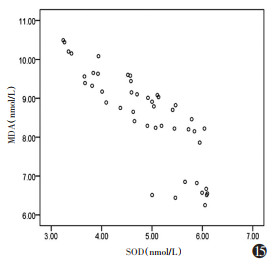 |
| 注:模型组ADC值与SOD呈正相关(r=0.828,P=0.001)。MDA为丙二醛,SOD为超氧化物歧化酶 图 15 MDA与SOD相关性散点图 |
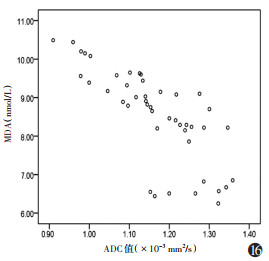 |
| 注:模型组ADC值与MDA呈负相关(r=-0.756,P=0.001) 图 16 MDA与ADC值相关性散点图 |
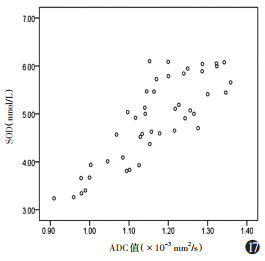 |
| 注:模型组SOD与MDA呈负相关(r=-0.834,P=0.001) 图 17 SOD与ADC值相关性散点图 |
3 讨论
ADC值是DWI的量化参数,其可活体检测水分子运动[5-6]。Shin等[7]研究发现,肝脏损伤会导致细胞外基质沉积,进而影响肝脏ADC值,肝脏ADC值与肝损伤严重程度呈负相关。BCS的病理改变表现为肝静脉回流受阻,导致肝内微循环障碍,肝窦红细胞淤积;随着肝细胞水肿加重,肝细胞坏死,核破裂,进而影响水分子弥散[4]。BCS的本质是淤血性肝损伤,肝淤血后的缺氧状态可导致氧化应激损伤[3,8]。细胞的氧化损伤与能够引发胞膜脂质过氧化的自由基的产生有关。脂质过氧化的醛类产物MDA可能介导肝脏的慢性氧化应激损伤。MDA在肝纤维化过程中增加了星状细胞中的Ⅰ型前胶原信使RNA和蛋白质的表达[9-10];SOD是机体抗氧化系统的代表物,其可清除氧自由基[10]。
本研究发现,模型组MDA呈先上升后下降趋势,SOD呈先下降后升高趋势,ADC值始终低于正常水平,说明BCS肝细胞存在水分子弥散受限和淤血后氧化应激损伤。研究发现,随着肝损伤加重,细胞外基质不断增加,水分子弥散受限,ADC值逐渐降低,与肝损伤的发展呈负相关[11]。BSC模型损伤的机制可能是肝淤血缺氧后发生氧化应激损伤,改变细胞膜的通透性,阻碍细胞内水分子扩散,同时肝脏病理损伤随大鼠模型的观察时间推移不断进展,第12周时淤血病理损伤最严重,这说明氧化应激介导了BCS淤血性肝损伤[12-15]。
本研究中模型组ADC值与SOD呈正相关,与MDA呈负相关,这是因为肝静脉回流受阻,导致肝窦淤血,肝细胞内水分子扩散受限,淤血缺氧后诱导缺氧因子表达,导致氧化应激损伤[4];这与内镜下观察到的肝索破坏、汇管区红细胞聚集、肝脏淤血一致,提示DWI可一定程度反映肝淤血缺氧损伤程度[4]。4周后,随着侧支循环建立,MDA逐渐下降(SOD及ADC值逐渐上升),这说明随着4周后侧支血管的建立,代偿了肝脏的静脉回流障碍,从而改善了肝脏的微循环障碍,提高了肝细胞水分子扩散能力。然而,模型组ADC值始终低于对照组健康大鼠,说明BCS的肝脏损伤随着自然病程会持续进展,无法自愈,与其他学者的研究[16-17]相符。
综上所述,ADC值与BCS的肝脏淤血缺氧后的氧化应激损伤存在一定的相关性,可作为动态评估BCS肝脏淤血缺氧损伤的新的检查手段。
| [1] |
SHARMA A, KESHAVA S N, EAPEN A, et al. An update on the management of Budd-Chiari syndrome[J]. Dig Dis Sci, 2021, 66(6): 1780-1790. DOI:10.1007/s10620-020-06485-y |
| [2] |
SHUKLA A, SHRESHTHA A, MUKUND A, et al. Budd-Chiari syndrome: consensus guidance of the Asian Pacific Association for the study of the liver (APASL)[J]. Hepatol Int, 2021, 15(3): 531-567. DOI:10.1007/s12072-021-10189-4 |
| [3] |
CHENG D L, ZHU N, LI C L, et al. Significance of malondialdehyde, superoxide dismutase and endotoxin levels in Budd-Chiari syndrome in patients and a rat model[J]. Exp Ther Med, 2018, 16(6): 5227-5235. |
| [4] |
周德兴, 孔莹, 李磊, 等. 布加综合征患者肝脏良性结节与肝细胞癌病灶的MRI鉴别诊断[J]. 中华肝胆外科杂志, 2020, 26(7): 539-542. DOI:10.3760/cma.j.cn113884-20190921-00309 |
| [5] |
沙茹玉, 徐志广, 梅光宝, 等. 常规MRI联合ADC直方图对腮腺多形性腺瘤与Warthin瘤的鉴别诊断价值[J]. 中国中西医结合影像学杂志, 2022, 20(5): 422-426, 431. |
| [6] |
JANG W, JO S, SONG J S, et al. Comparison of diffusion-weighted imaging and MR elastography in staging liver fibrosis: a meta-analysis[J]. Abdom Radiol (NY), 2021, 46(8): 3889-3907. DOI:10.1007/s00261-021-03055-2 |
| [7] |
SHIN M K, SONG J S, HWANG S B, et al. Liver fibrosis assessment with diffusion-weighted imaging: value of liver apparent diffusion coefficient normalization using the spleen as a reference organ[J]. Diagnostics (Basel), 2019, 9(3): 107. DOI:10.3390/diagnostics9030107 |
| [8] |
YI J, WU S, TAN S, et al. Berberine alleviates liver fibrosis through inducing ferrous redox to activate ROS-mediated hepatic stellate cells ferroptosis[J]. Cell Death Discov, 2021, 7(1): 374. DOI:10.1038/s41420-021-00768-7 |
| [9] |
ZHANG Y, ZHANG S, LUO X, et al. Paeoniflorin mitigates PBC-induced liver fibrosis by repressing NLRP3 formation[J]. Acta Cir Bras, 2022, 36(11): e361106. |
| [10] |
WU S, LIU L, YANG S, et al. Paeonol alleviates CCl4-induced liver fibrosis through suppression of hepatic stellate cells activation via inhibiting the TGF-β/Smad3 signaling[J]. Immunopharmacol Immunotoxicol, 2019, 41(3): 438-445. DOI:10.1080/08923973.2019.1613427 |
| [11] |
KAHRAMAN A S, KAHRAMAN B, OZDEMIR Z M, et al. Diffusion-weighted imaging of the liver in assessing chronic liver disease: effects of fat and iron deposition on ADC values[J]. Eur Rev Med Pharmacol Sci, 2022, 26(18): 6620-6631. |
| [12] |
周维彬, 赵玉婷, 周强, 等. 多排螺旋CT直接法下腔静脉成像诊断布加综合征的临床分析[J]. 医学影像学杂志, 2019, 29(7): 1236-1238. |
| [13] |
程影, 陈育锋, 祁良. 3.0 T MRV辅助DSA介入治疗布加综合征患者效果临床研究[J]. 实用肝脏病杂志, 2020, 23(6): 869-872. |
| [14] |
全坤, 沙俊诚, 张庆桥, 等. 三维可视化技术在经颈静脉肝内门-体静脉分流术治疗肝静脉广泛闭塞布加综合征中的初步应用[J]. 临床放射学杂志, 2021, 40(8): 1594-1598. |
| [15] |
吴磊, 祖茂衡, 徐浩. 布加综合征患者副肝静脉形成与年龄的相关性分析[J]. 中华肝胆外科杂志, 2020, 26(3): 218-219. |
| [16] |
ZHANG W, WANG Q Z, CHEN X W, et al. Budd-Chiari syndrome in China: a 30-year retrospective study on survival from a single center[J]. World J Gastroenterol, 2018, 24(10): 1134-1143. DOI:10.3748/wjg.v24.i10.1134 |
| [17] |
HE F L, LI C, LIU F Q, et al. Correlation analysis of collagen proportionate area in Budd-Chiari syndrome: a preliminary clinicopathological study[J]. World J Clin Cases, 2019, 7(2): 130-136. DOI:10.12998/wjcc.v7.i2.130 |
 2024, Vol. 22
2024, Vol. 22


