| 18F-FDG PET/CT原发灶代谢参数对肺腺癌临床分期的预测价值 |
2. 南京医科大学姑苏学院,江苏 苏州 215002;
3. 江苏大学医学院,江苏 镇江 212013
2. Gusu School, Nanjing Medical University, Suzhou 215002, China;
3. Medical School, Jiangsu University, Zhenjiang 212013, China
原发性肺癌是起源于支气管黏膜或腺体的恶性肿瘤,以非小细胞肺癌(non-small cell lung cancer,NSCLC)最常见,腺癌、鳞状细胞癌是其主要的2种组织学亚型[1]。肺癌早期多无明显症状,5年生存率约15%,70% 患者确诊时已处于晚期,及早诊断能明显改善患者预后[2]。目前,肺癌的分期主要基于国际抗癌联盟第8版肺癌TNM分期标准[3]。研究表明,18F-脱氧葡萄糖(FDG)PET/CT代谢参数,如最大标准化摄取值(maximum standardized uptake value,SUVmax)、肿瘤代谢体积(metabolic tumor volume,MTV)及病灶糖酵解总量(total lesion glycolysis,TLG)对肺癌的分期与预后评估具有重要价值[4-7];但不同文献的结果存在差异,尽管大多数研究以NSCLC为研究对象,然而不同病理类型肺癌的葡萄糖代谢也不同,鳞癌的代谢活性高于腺癌,以NSCLC为研究对象可能影响PET/CT对分期的评估[8]。基于此,本研究着重探讨基于PET/CT代谢参数对进展期肺腺癌的预测价值。
1 资料与方法 1.1 一般资料搜集2021年1月至2022年11月于江苏大学附属昆山医院行PET/CT检查并经病理确诊为肺腺癌的86例患者的临床及影像资料。
纳入标准:①PET/CT检查后2周内行手术、经皮肺穿刺术、支气管镜检查;②检查前未行放、化疗等治疗;③临床资料完整且图像质量完好者。排除标准:①合并其他原发肿瘤史;②病理证实为肺转移肿瘤或肺内多个原发灶,无法确定唯一来源者。
86例均按第8版肺癌TNM分期标准[3]进行分期,其中N分期基于PET/CT结合经气管镜超声引导针吸活检术和纵隔镜取样进行分期,M分期基于PET/CT、ECT、CT、MRI、胸腔积液检查、胸膜活检及临床随访情况进行分期。参照既往研究[9],将86例分为早期组(Ⅰ~ⅢA期行肺癌根治术的患者)54例和进展期组(ⅢB~Ⅳ期未行肺癌根治术的患者)32例。
1.2 仪器与方法PET/CT图像采集采用联影uMI780扫描仪。检查前常规禁食4~6 h,空腹血糖 < 11.1 mmol/L。静脉注射18F-FDG(3.7~4.4 MBq/kg体质量)(南京安迪科公司,放射化学纯度 > 95%)后,静息45~60 min显像。常规先采集CT平扫图像,扫描参数:140 kV,129 mA,层厚1.25 mm,螺距1.75,旋转时间0.8 s;后采集PET图像(5~6个床位,2~3 min/床位);最后通过CT数据校正、迭代重建算法,进行图像融合匹配。
1.3 图像分析由2位医师进行图像分析与测量:确定原发灶位置,设置纵隔窗选取最大层面测量原发灶最大径;采取相对阈值法(以40% 为阈值)对原发灶进行勾画,分割不理想时,由2位医师手动调整去除血池或淋巴结等非肿瘤组织。由系统软件自动计算SUVmax、平均标准化摄取值(mean standardized uptake value,SUVmean)、MTV,并根据公式TLG=SUVmean×MTV,计算TLG。
1.4 统计学分析采用SPSS 22.0软件分析数据。符合正态分布的计量资料以x±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whithey U检验。计数资料以例(%)表示,组间比较采用χ2检验。采用单因素及多因素logistic回归分析对进展期肺腺癌的危险因素进行分析,并生成相应的预测模型。绘制ROC曲线分析PET/CT参数预测进展期肺腺癌的最佳界值和诊断效能。以P < 0.05为差异有统计学意义。
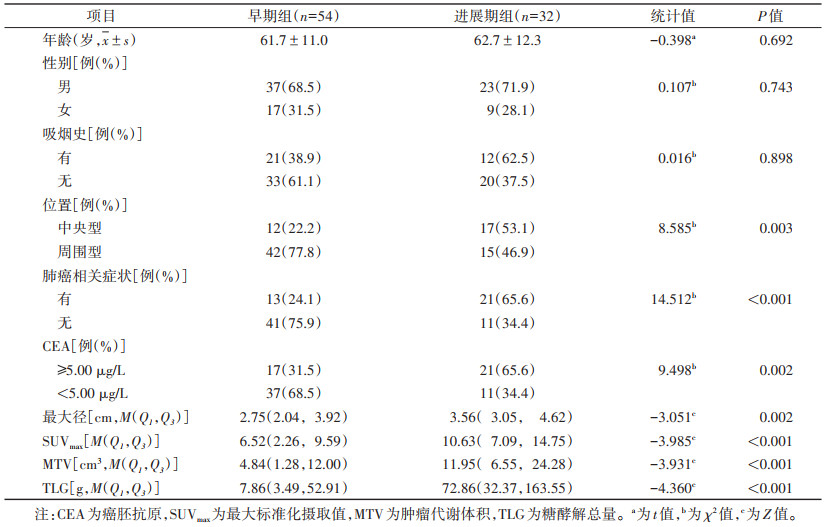
2 结果 2.1 2组一般资料及原发灶PET/CT参数比较进展期组中央型肺癌、有肺癌相关症状、血清癌胚抗原(CEA)≥5.00 μg/L的构成比,以及原发灶最大径、SUVmax、MTV、TLG均大于早期组,差异均有统计学意义(均P < 0.01)(表 1)。2组年龄、性别及吸烟史比较,差异均无统计学意义(均P > 0.05)。
| 表 1 2组一般资料及原发灶PET/CT代谢参数比较 |
 |
肺腺癌患者CT图像、PET/CT融合图像、MIP图像及病理图像见图 1,2。
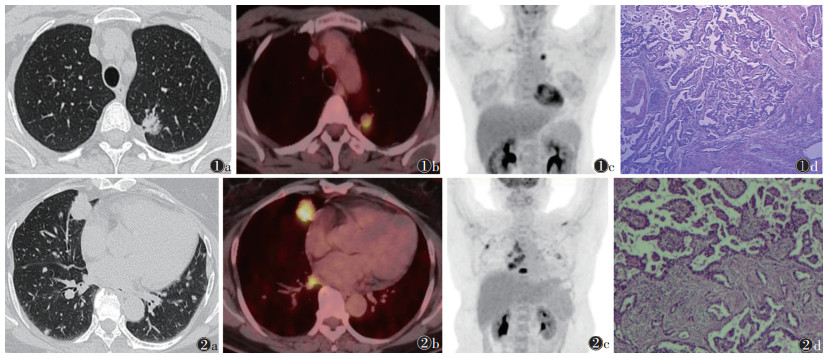 |
| 注:图 1患者,女,47岁,因体检发现肺部病灶就诊,癌胚抗原(CEA)=1.46 μg/L,T1cN2M0,临床分期ⅢA期;CT平扫示左肺上叶结节(图 1a),最大径2.34 cm;18F-脱氧葡萄糖(FDG)PET/CT融合图像示结节FDG代谢明显增高(图 1b),原发灶最大标准化摄取值(SUVmax)=5.67,肿瘤代谢体积(MTV)=1.73 cm3,糖酵解总量(TLG)=5.61 g;MIP图(图 1c)直观显示左肺上叶结节FDG代谢明显增高,双侧肺门及纵隔淋巴结FDG代谢未见增高;病理为左肺上叶周围型腺癌(HE染色,高倍放大)。图 2患者,女,64岁,因咳嗽咳痰伴痰中带血就诊,CEA=50.65 μg/L,T4N2M1c,临床分期ⅣB期;CT示右肺中叶结节(图 2a),最大径2.92 cm;18F-FDG PET/CT融合图像示肿块FDG代谢明显增高(图 2b),右侧肺门、纵隔淋巴结、全身骨骼多发FDG代谢增高,原发灶SUVmax=7.92,MTV=6.65 cm3,TLG=32.19 g;MIP图(图 2c)直观显示右肺中叶结节FDG代谢明显增高,右侧肺门及纵隔淋巴结、两侧肋骨、左侧肩关节、脊柱多发椎体、骨盆多发骨质FDG代谢明显增高;病理为右肺中叶周围型腺癌(HE染色,高倍放大,图 2d) 图 1,2 肺腺癌患者CT肺窗图像、PET/CT融合图像、MIP图、病理图像 |
2.2 进展期肺腺癌一般资料、原发灶PET/CT参数的单因素及多因素分析
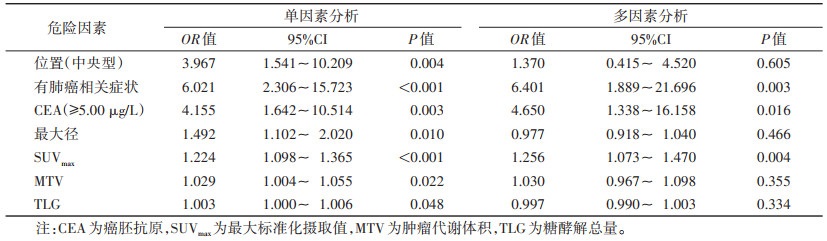
单因素logistic回归分析显示,中央型肺癌、有肺癌相关症状、血清CEA≥5.00 μg/L、原发灶最大径、SUVmax、MTV及TLG是进展期肺腺癌的危险因素(均P < 0.05)。多因素分析显示,有肺癌相关症状、血清CEA≥5.00 μg/L、SUVmax是进展期肺腺癌的独立危险因素(均P < 0.05)(表 2)。构建logistic回归模型,logit(P)=-0.829-2.024X1-1.920X2+0.294X3,其中X1为有肺癌相关症状,X2为血清CEA≥5.0 μg/L,X3为SUVmax。
| 表 2 进展期肺腺癌一般资料、原发灶PET/CT参数的单因素及多因素logistic分析 |
 |
2.3 PET/CT参数及logistic回归模型预测进展期肺腺癌的ROC曲线分析
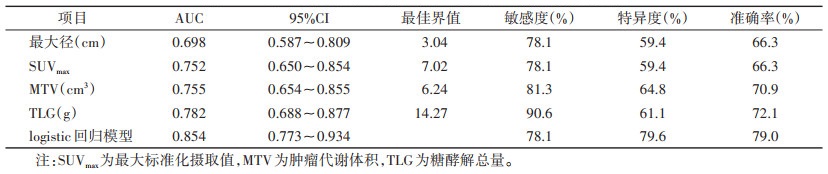
ROC曲线分析显示,原发灶最大径、SUVmax、MTV及TLG诊断进展期肺腺癌的AUC分别为0.698、0.752、0.755、0.782。其中以TLG的AUC最大,最佳界值为14.27 g,敏感度为90.6%,特异度为61.1%,准确率为72.1%。logistic回归模型诊断进展期肺腺癌的AUC为0.854(95%CI 0.773~0.934),敏感度、特异度和准确率分别为78.1%、79.6% 和79.0%(图 3,表 3)。
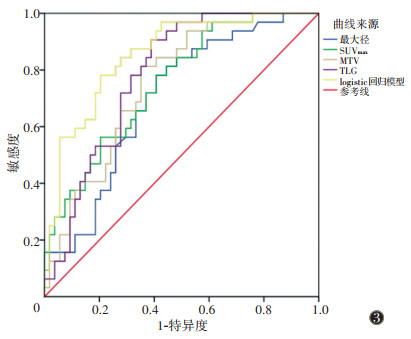 |
| 注:SUVmax为最大标准化摄取值,MTV为肿瘤代谢体积,TLG为糖酵解总量 图 3 PET/CT参数及logistic回归模型诊断进展期肺腺癌的ROC曲线 |
| 表 3 PET/CT参数及logistic回归模型对进展期肺腺癌的诊断效能 |
 |
3 讨论
对较小的肺癌原发灶,穿刺活检只能获取少量组织且准确性较低,不能对肺癌进行准确分期。目前对肺癌的分期主要基于影像学,18F-FDG PET/CT能同时行形态和功能显像,反映病灶代谢活性,在肺癌的分期中起着重要作用。
SUVmax是临床最常用的半定量参数,代表ROI内所有体素中葡萄糖代谢的最大值;MTV代表有代谢活性的肿瘤体积,反映肿瘤细胞克隆形成的细胞数量;TLG定义为SUVmean与MTV的乘积,能同时反映肿瘤大小及代谢活性。研究表明,葡萄糖转运蛋白1(glucose transporter 1,GLUT1)的表达与肺癌分期相关,原发灶FDG摄取越高,肿瘤GLUT1的表达越高,表明肿瘤侵袭性也越高[10-11]。翁绳和等[12]将83例肺腺癌患者分为Ⅰ~ⅢA期和ⅢB~Ⅳ期;ROC曲线分析显示SUVmax对ⅢB~Ⅳ期肺癌具有良好的预测效能,以9.16为界值,AUC为0.808,敏感度为77.55%,特异度为79.41%,且联合血清CEA能提高诊断价值。Hu等[4]基于PET/CT代谢参数对97例NSCLC患者分析发现,MTV和TLG均与肺癌临床分期呈正相关(r=0.316,0.206;P=0.002,0.043)。王慧春等[13]回顾性分析97例肺癌患者的临床资料,结果显示腺癌组Ⅰ~ⅢA期和Ⅲ B~Ⅳ期的原发灶最大径、MTV、TLG差异均有统计学意义(均P < 0.05)。Miao等[14]研究表明,原发灶及肺门淋巴结SUVmax均对纵隔淋巴结转移具有良好的预测效能(AUC=0.764,0.730);多因素分析显示,两者均为纵隔淋巴结转移的独立危险因素(OR=4.51,6.66;均P < 0.01)。本研究结果表明,原发灶PET/CT各代谢参数对进展期肺腺癌患者均有良好的预测效能,以TLG的AUC最大,为0.782,单因素分析表明PET/CT各参数均为进展期肺腺癌的危险因素(均P < 0.05),多因素分析显示SUVmax是独立危险因素,提示PET/CT在肺癌临床分期有重要价值。
SUVmax仅代表单个体素,并不代表整个肿瘤的代谢情况,当肿瘤体积较小时,由于部分容积效应,SUVmax会被低估,而体积代谢参数(MTV和TLG)能全面反映肿瘤的代谢负荷。Yamanaka等[15]对45例肺癌患者行延迟PET/CT扫描并测量原发灶SUVmax、MTV和TLG,发现三者AUC分别为0.943、0.929和0.957,对淋巴结转移均有良好的诊断效能。郭成茂等[5]将171例肺癌患者分为远处转移组和无远处转移组,多因素logistic回归分析显示MTV是远处转移的独立危险因素(OR=1.142,P=0.013),而SUVmax和TLG不是。史云梅等[16]回顾性分析了183例经病理证实的NSCLC患者,ROC曲线分析显示SUVmax(AUC为0.789,敏感度为92.0%,特异度为60.8%)和TLG(AUC为0.707,敏感度为64.0%,特异度为80.4%)均对隐匿性淋巴结转移有良好的预测效能,而多因素分析显示两者均不是隐匿性淋巴结转移的独立预测因子。本研究结果显示,SUVmax是进展期肺腺癌的独立预测因素,而MTV和TLG不是。与文献报道不同的原因可能是:各研究入选对象不同,既往大部分研究未按照不同病理类型对肺癌进行分层分析,而本研究仅纳入腺癌患者;对原发灶ROI的勾画方法尚无统一标准,当肿瘤周围合并炎症/肺不张,或当肿瘤靠近纵隔时,勾画会包含血管、淋巴结等其他组织结构,导致MTV偏高。
临床实践中,在分析肺癌时需结合临床特征。Polanco等[17]对267例肺癌患者进行前瞻性研究,与有症状的患者相比,无症状患者的临床分期多为早期,Cox回归分析表明无症状是预后的独立预测因子(HR=2.53,P < 0.001)。本研究多因素logistic回归分析表明,有肺癌相关症状是腺癌患者进展期的独立危险因素,分析原因可能是腺癌细胞更易浸润性生长,穿透血管壁,发生、发展较快,较早发生血行转移,出现相应的临床症状,提示肺癌早期诊断具有重大意义。既往研究也发现,血清CEA水平与肺癌临床分期相关,Ⅰ~ⅢA期和ⅢB~Ⅳ期的血清CEA水平差异有统计学意义(9.05 μg/L vs. 190.94 μg/L,P < 0.01)[13]。与上述研究相似,本研究表明血清CEA≥5.00 μg/L是进展期肺腺癌的独立危险因素[OR=4.650(95%CI 1.338~16.158),P=0.016],分析原因可能为CEA是一种存在于癌细胞表面的结构蛋白,当肿瘤侵袭性增加时,肿瘤负荷升高,分泌入周围体液的CEA增多。He等[18]以CT结合临床病理特征分析了478例NSCLC患者隐匿性淋巴结转移的情况,结果显示CEA > 5.00 μg/L、腺癌、无血管集束征及Ⅱ型胸膜凹陷征是隐匿性淋巴结转移的独立危险因素;ROC曲线分析显示,该模型的AUC为0.796,敏感度、特异度和准确率分别为68.32%、78.55% 和75.10%。本研究显示,logistic回归模型诊断进展期肺腺癌的AUC为0.854(95%CI 0.773~0.934),敏感度、特异度和准确率分别为78.1%、79.6% 和79.0%,优于单一参数,提示影像学(SUVmax)结合临床特征(有肺癌相关症状、血清CEA≥5.00 μg/L)能提高对肺腺癌临床分期的诊断效能。
本研究存在的局限性:①为单中心研究,样本量相对较小,可能存在纳入偏倚;②PET/CT机器本身衰减校正、本底代谢不一致、扫描及重建参数等因素导致测量代谢参数可能产生偏差,需进一步行大样本研究。
综上所述,18F-FDG PET/CT原发灶代谢参数对进展期肺腺癌具有良好的预测效能,联合临床特征能提高对肺腺癌临床分期的诊断效能,为临床提供指导。
| [1] |
BASHIR U, KAWA B, SIDDIQUE M, et al. Non-invasive classification of non-small cell lung cancer: a comparison between random forest models utilising radiomic and semantic features[J]. Br J Radiol, 2019, 92(1099): 20190159. DOI:10.1259/bjr.20190159 |
| [2] |
DUMA N, SANTANA-DAVILA R, MOLINA J R. Non-Small cell lung cancer: epidemiology, screening, diagnosis, and treatment[J]. Mayo Clin Proc, 2019, 94(8): 1623-1640. DOI:10.1016/j.mayocp.2019.01.013 |
| [3] |
DETTERBECK F C, MAROM E M, ARENBERG D A, et al. The IASLC lung cancer staging project: background data and proposals for the application of TNM staging rules to lung cancer presenting as multiple nodules with ground glass or lepidic features or a pneumonic type of involvement in the forthcoming eighth edition of the TNM classification[J]. J Thorac Oncol, 2016, 11(5): 666-680. DOI:10.1016/j.jtho.2015.12.113 |
| [4] |
HU W D, WANG H C, WANG Y B, et al. Correlation study on 18F-FDG PET/CT metabolic characteristics of primary lesion with clinical stage in lung cancer[J]. Q J Nucl Med Mol Imaging, 2021, 65(2): 172-177. |
| [5] |
郭成茂, 王东, 黄世桑, 等. 18F-FDG PET/CT在预测非小细胞肺癌远处转移的价值研究[J]. 临床放射学杂志, 2021, 40(10): 1920-1924. |
| [6] |
GUO D, JIN F, JING W, et al. Incorporation of the SUVmax measured from FDG PET and neutrophil-to-lymphocyte ratio improves prediction of clinical outcomes in patients with locally advanced non-small-cell lung cancer[J]. Clin Lung Cancer, 2019, 20(6): 412-419. DOI:10.1016/j.cllc.2019.06.008 |
| [7] |
PARK S Y, YOON J K, PARK K J, et al. Prediction of occult lymph node metastasis using volume-based PET parameters in small-sized peripheral non-small cell lung cancer[J]. Cancer Imaging, 2015, 15: 21. DOI:10.1186/s40644-015-0058-9 |
| [8] |
JI Y, QIU Q, FU J, et al. Stage-Specific PET radiomic prediction model for the histological subtype classification of non-small-cell lung cancer[J]. Cancer Manag Res, 2021, 13: 307-317. DOI:10.2147/CMAR.S287128 |
| [9] |
PI C, XU C R, ZHANG M F, et al. EGFR mutations in early-stage and advanced-stage lung adenocarcinoma: analysis based on large-scale data from China[J]. Thorac Cancer, 2018, 9(7): 814-819. DOI:10.1111/1759-7714.12651 |
| [10] |
ZHANG B, XIE Z, LI B. The clinicopathologic impacts and prognostic significance of GLUT1 expression in patients with lung cancer: a meta-analysis[J]. Gene, 2019, 689: 76-83. DOI:10.1016/j.gene.2018.12.006 |
| [11] |
胡文倩, 王雪芹. 肺癌PET-CT的最大标准摄取值与肿瘤微淋巴管密度及微血管密度的相关性研究[J]. 中国中西医结合影像学杂志, 2020, 18(5): 481-485. DOI:10.3969/j.issn.1672-0512.2020.05.014 |
| [12] |
翁绳和, 孙祎繁, 徐雪, 等. 18F-FDG PET联合血清肿瘤标志物对肺腺癌分期的应用价值[J]. 临床放射学杂志, 2020, 39(4): 800-804. |
| [13] |
王慧春, 王玉斌, 崔兰兰, 等. 肺癌18F-FDG PET/CT代谢特征与肿瘤标志物的相关性[J]. 中国医学影像学杂志, 2020, 28(5): 343-348. DOI:10.3969/j.issn.1005-5185.2020.05.005 |
| [14] |
MIAO H, SHAOLEI L, NAN L, et al. Occult mediastinal lymph node metastasis in FDG-PET/CT nodenegative lung adenocarcinoma patients: risk factors and histopathological study[J]. Thorac Cancer, 2019, 10(6): 1453-1460. DOI:10.1111/1759-7714.13093 |
| [15] |
YAMANAKA M, SHINYA T, OTOMI Y, et al. Semiquantitative assessment of fluorodeoxyglucose uptake in primary tumours on dynamic PET/computed tomography for lymph node metastasis evaluation in patients with lung cancer: a prospective study[J]. Nucl Med Commun, 2020, 41(11): 1189-1198. DOI:10.1097/MNM.0000000000001271 |
| [16] |
史云梅, 牛荣, 王跃涛, 等. 18F-FDG PET/CT原发灶代谢参数对非小细胞肺癌隐匿性淋巴结转移的预测价值[J]. 中华核医学与分子影像杂志, 2021, 41(6): 327-333. DOI:10.3760/cma.j.cn321828-20200221-00061 |
| [17] |
POLANCO D, PINILLA L, GRACIA-LAVEDAN E, et al. Prognostic value of symptoms at lung cancer diagnosis: a three-year observational study[J]. J Thorac Dis, 2021, 13(3): 1485-1494. DOI:10.21037/jtd-20-3075 |
| [18] |
HE X Q, LUO T Y, LI X, et al. Clinicopathological and computed tomographic features associated with occult lymph node metastasis in patients with peripheral solid non-small cell lung cancer[J]. Eur J Radiol, 2021, 144: 109981. DOI:10.1016/j.ejrad.2021.109981 |
 2024, Vol. 22
2024, Vol. 22


