| 动态对比增强磁共振成像定量参数在直肠癌分化程度与血管侵犯评估中的价值 |
《全球癌症统计报告》显示,2020年全球新增1 929万癌症病例,其中结直肠癌发病率和死亡率分别排第3位和第2位。在结直肠恶性肿瘤中,直肠癌占1/3[1]。MRI软组织分辨力较高,在直肠癌的诊断、分期、放化疗效果评估等方面具有非常重要的作用。
动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)作为一种定量技术,通过在静脉注射对比剂前后连续动态采集图像,对对比剂的吸收、分布、代谢等药代动力学过程进行监测,从而评估组织或靶器官的微血管通透性及血流灌注变化[2]。本研究旨在探讨DCE-MRI定量参数在直肠癌分化程度和血管侵犯评估中的价值。
1 资料与方法 1.1 一般资料前瞻性收集我院2019年12月至2021年12月经内镜下活检病理诊断的直肠腺癌患者43例,均行直肠常规高分辨MRI及DCE-MRI扫描。其中,男20例,女23例;年龄35~82岁,平均(63.63±11.74)岁。43例中,高分化腺癌12例,中分化20例,低分化11例。本研究已通过医院伦理委员会批准(2019-750-105-01),患者均签署知情同意书。
纳入标准:年龄18~85岁;经直肠指诊、肠镜、CT或MRI检查发现直肠占位性病变;无远处转移,能手术切除;术前无法行新辅助放化疗;无全身性疾病,肝肾功能正常;无心脏瓣膜等起搏器,未行人工植入手术;无幽闭恐惧症;MRI检查与手术间隔≤1周。
1.2 仪器与方法采用Siemens Magnetom Skyra 3.0 T智能MRI成像仪和18通道体部相控阵表面线圈。检查前排空大小便。扫描范围覆盖直肠全段。扫描方案:DCE序列与矢状位定位扫描,在肿瘤层面设计与直肠壁垂直的正交轴位图像,冠状面图像定位垂直于横断面。常规MRI扫描序列与参数:横断位T2WI;高分辨正交轴位T2WI、矢状位T2WI、冠状位T2WI、正交轴位T1WI。DEC-MRI使用对比剂特酸葡胺注射液,经肘正中静脉注射,剂量0.2 mL/kg体质量,流率2 mL/s。扫描序列与参数:采用2D VIBE T1WI动态灌注序列,TR/TE 4.87 ms/1.87 ms,视野200 mm×200 mm,层厚2 mm,体素1.3 mm×1.3 mm×2.0 mm,翻转角2°和15°,扫描48个时相。扫描时间303 s。
1.3 图像分析使用软件PMI 0.4(Platform for Research in Medicine Imaging,IDL 6.4)、Tofts药代动力学模型。在直肠癌浸润最深平面勾画ROI,避开出血、坏死的囊性区域、肠内容物和肠系膜,ROI面积≥1 cm2。分析血管内至血管外间隙转运系数(Ktrans)、血管外间隙返回至血管内速率常数(Kep)和血管外细胞外间隙容积分数(Ve)等定量参数。观察直肠癌壁外血管侵犯情况。
1.4 统计学分析应用SPSS 19.0软件行数据分析。DCE-MRI参数行方差齐性检验和Kolmogorov-Smirnov检验,均符合正态分布且方差齐。不同分化程度直肠癌的DEC-MRI参数比较行单因素方差分析,DCE-MRI参数与壁外血管的关系行独立样本t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 高、中、低分化组的DEC-MRI参数比较(表 1)| 表 1 高、中、低分化组DCE-MRI参数比较(x±s) |
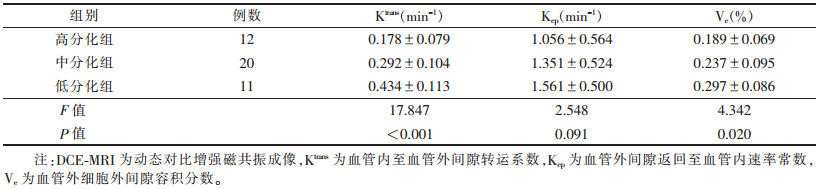 |
高、中、低分化组的Ktrans和Ve差异均有统计学意义(均P<0.05),Kep差异无统计学意义(P >0.05)。直肠癌患者DCE-MRI及其后处理图像和病理图片见图 1。
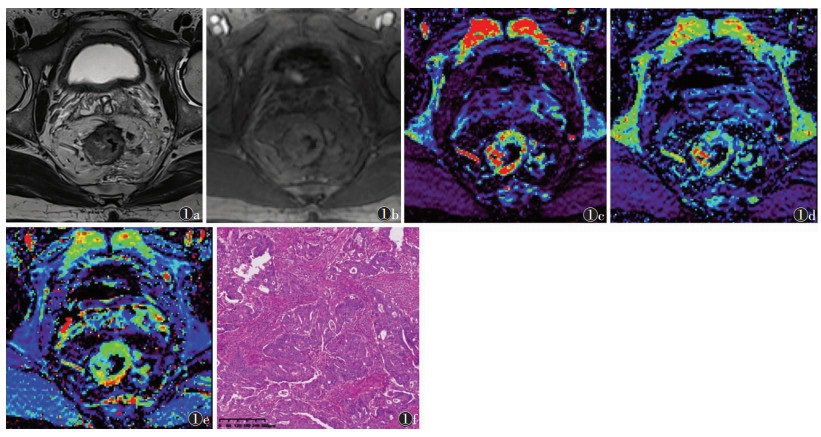 |
| 注:患者,男,54岁,T3期中分化直肠腺癌。图 1a为高分辨T2WI,示直肠肠壁浸润型肿块;图 1b为DCE-MRI,示肿块呈明显不均匀强化;图 1c为血管内至血管外间隙转运系数(Ktrans)伪彩图,病灶显示为红色区域,Ktrans为0.405 min-1;图 1d为血管外间隙返回至血管内速率常数(Kep)伪彩图,病灶显示为红至黄色区域,Kep为2.036 min-1;图 1e为血管外细胞外间隙容积分数(Ve)伪彩图,病灶显示为黄色至蓝色区域,Ve为0.199%;图 1f为病理图片,肿瘤腺体排①e ①f列不规则,细胞核大深染(HE染色,高倍放大) 图 1 直肠癌患者动态对比增强磁共振成像(DCE-MRI)及其后处理图像和病理图片 |
2.2 有无血管侵犯直肠癌的DEC-MRI参数比较(表 2)
| 表 2 直肠癌壁外有无血管侵犯组DCE-MRI参数比较(x±s) |
 |
43例中,血管侵犯13例,无血管侵犯30例。2组的Kep差异有统计学意义(P<0.05),Ktrans及Ve差异均无统计学意义(均P>0.05)。
3 讨论DCE-MRI连续、重复、快速地扫描组织可获得对比剂注射前后的图像,利用对比剂缩短组织T1值的特性,增加固有的图像对比,观察不同时间点信号的变化,融合动脉输入功能和药物动力学模型,定量组织参数。这些参数主要包括Ktrans、Kep和Ve,其中Ktrans代表对比剂从血管至血管外间隙的转移率,Kep代表对比剂从血管外间隙至血管的转移率,Ve代表血管外细胞外间隙容积分数。这些参数可反映组织灌注、毛细血管数量和通透性等[2]。因此,DCE-MRI可用于评估肿瘤血管化程度,以及肿瘤侵袭性、血管生成程度与分期[3]。以往研究发现,直肠癌的微血管密度与肿瘤高Ktrans区域的Kep呈正相关[4]。DCE-MRI还可用于监测直肠癌对新辅助放化疗的治疗反应[5]。En等[6]发现,新辅助放化疗后肿瘤体积、Ktrans值,以及两者的相对变化均可预测病理反应,其中相对Ktrans是最能预测病理反应的参数。然而,直肠癌的病理特征与DCE-MRI定量参数之间的关系尚不清楚。
肿瘤需更严格的营养和供氧,对代谢废物和二氧化碳的清除能力也较正常组织强,因此需生成更多新的血管[7]。这个过程被称为血管新生,是指从原有的血管中形成新的血管,即形成数量众多、不规则、曲折、脆弱、高渗透性的血管。Li等[8]发现,原位导管癌和浸润性导管癌中的Ktrans和Kep均比乳腺导管发育不良明显增高,认为癌组织中,血液易快速从血管中漏出,导致Ktrans增加;同时其还可导致血液快速流入血管,最终导致Kep增加。Jung等[9]发现,Ktrans是区分高级别与低级别胶质瘤的最显著参数。另一项研究发现,组织学分级高的乳腺癌中Ktrans平均值高于组织学分级低的乳腺癌[10]。本研究发现,不同分化程度直肠癌的Ktrans值差异有统计学意义,高分化直肠癌的Ktrans高于低分化直肠癌。在评估直肠癌组织学分级中,本研究支持Ktrans是最重要的参数。随着直肠癌分化程度的增加,正常直肠壁层减少,微循环丧失,新生血管形成,大量新生血管管壁薄,通透性高,使得对比剂更易从血管内转移至血管外,从而导致Ktrans的增加。因此,应用DEC-MRI中Ktrans可评估直肠癌分化程度,进而预测直肠癌预后。Ve反映肿瘤组织血管外细胞外间隙中对比剂的浓度,与从血管中渗出到血管外的对比剂剂量有关,可间接反映肿瘤细胞的密度和渗透压。宋琼等[11]研究发现,在肝细胞肝癌中,Ve与分化级别呈负相关。本研究发现,不同分化程度直肠癌的Ve差异有统计学意义,分化程度差时,Ve较高,但Kep与直肠癌的分化并未发现相关性。在直肠癌中,分化程度变差,导致血管紊乱、新生血管通透性增加,从而使细胞外间隙内对比剂浓度增加,Ve增高。因此,Ve可能在识别组织学低分化直肠癌中具有较重要的临床价值。
壁外血管侵犯是指恶性肿瘤细胞存在于直肠癌固有肌层以外的血管中,约1/3的直肠癌患者存在壁外血管侵犯[12-13]。壁外血管侵犯是直肠癌复发和远处转移的主要危险因素与重要预后因素,也是新辅助治疗的重要依据[14]。张海平等[15]的研究表明,直肠癌壁外血管侵犯阳性组患者中,Ktrans和Ve均明显高于阴性组,2组Kep值差异无统计学意义;认为可能是肿瘤新生血管增多,血管壁破坏和缺陷导致对比剂外渗增加所致。Ao等[16]的研究发现,壁外血管侵犯阳性组Ktrans和Kep比阴性组明显增高;认为Kep增高可能表明血液系统回流增多。但本研究发现,壁外血管侵犯组Kep明显低于阴性组;且血管受到侵犯导致血管内肿瘤细胞增多,从而血管压力增加,使对比剂从血管外间隙转移至血管内的阻力增大,导致Kep降低。
体素内不相干运动成像也可反映直肠癌肿瘤微循环灌注情况,且无需使用对比剂[17-18]。与体素内不相干运动成像相比,DCE-MRI对组织血流灌注的评价更成熟、扫描序列参数和数据模型方面更完善,因此,其对直肠癌的诊断效能明显高于体素内不相干运动成像参数[19]。
综上所述,DCE-MRI定量参数与直肠癌的分化程度及对壁外血管有无侵犯相关,可为直肠癌术前评估提供依据。本研究的不足:样本量较小,应扩大样本量深入研究;组织学的取材与DCE图像的ROI勾画位置无法完全重合,两者的测定也可能存在一定误差。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global Cancer Statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
KHALIFA F, SOLIMAN A, EL-BAZ A, et al. Models and methods for analyzing DCE-MRI: a review[J]. Med Phys, 2014, 41(12): 124301. DOI:10.1118/1.4898202 |
| [3] |
DIJKHOFF R A P, BEETS-TAN R G H, LMBREGTS D M J, et al. Value of DCE-MRI for staging and response evaluation in rectal cancer: a systematic review[J]. Eur J Radiol, 2017, 95: 155-168. DOI:10.1016/j.ejrad.2017.08.009 |
| [4] |
YEO D M, OH S N, JUNG C K, et al. Correlation of dynamic contrast-enhanced MRI perfusion parameters with angiogenesis and biologic aggressiveness of rectal cancer: preliminary results[J]. J Magn Reson Imaging, 2015, 41: 474-480. DOI:10.1002/jmri.24541 |
| [5] |
FUSCO R, GRANATA V, SANSONE M, et al. Validation of the standardized index of shape tool to analyze DCE-MRI data in the assessment of neo-adjuvant therapy in locally advanced rectal cancer[J]. Radiol Med, 2021, 126: 1044-1054. DOI:10.1007/s11547-021-01369-1 |
| [6] |
EN M, REERINK O, PHILIPPENS M E. Dynamic contrast enhanced MR imaging for rectal cancer response assessment after neo-adjuvant chemoradiation[J]. J Magn Reson Imaging, 2015, 41(6): 1646-1653. DOI:10.1002/jmri.24718 |
| [7] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [8] |
LI L, WANG K, SUN X, et al. Parameters of dynamic contrast-enhanced MRI as imaging markers for angiogenesis and proliferation in human breast cancer[J]. Med Sci Monit, 2015, 21: 376-382. DOI:10.12659/MSM.892534 |
| [9] |
JUNG S C, YEOM J A, KIM J H, et al. Glioma: application of histogram analysis of pharmacokinetic parameters from T1-weighted dynamic contrast-enhanced MR imaging to tumor grading[J]. AJNR Am J Neuroradiol, 2014, 35(6): 1103-1110. DOI:10.3174/ajnr.A3825 |
| [10] |
SHIN J K, KIM J Y. Dynamic contrast-enhanced and diffusion-weighted MRI of estrogen receptor-positive invasive breast cancers: associations between quantitative MR parameters and Ki-67 proliferation status[J]. J Magn Reson Imaging, 2016, 45(1): 94-102. |
| [11] |
宋琼, 马静, 饶圣祥, 等. MR全肝增强灌注Tofts模型分析对肝癌微循环功能状态的影像生物学标记物的评价研究[J]. 放射学实践, 2013, 28(6): 662-665. |
| [12] |
VAN DEN BROEK J J, VAN DEN WOLF F S W, HEIJNEN L A, et al. The prognostic importance of MRI detected extramural vascular invasion (mrEMVI) in locally advanced rectal cancer[J]. Int J Colorectal Dis, 2020, 35(6): 1849-1854. |
| [13] |
谭春燕, 杨松华, 罗涛, 等. 直肠癌术前原发灶及淋巴结的MRI特征对壁外血管侵犯的补充诊断价值[J]. 中国中西医结合影像学杂志, 2020, 18(6): 544-547. |
| [14] |
ZHANG X Y, WANG S, LI X T, et al. MRI of extramural venous invasion in locally advanced rectal cancer: relationship to tumor recurrence and overall survival[J]. Radiology, 2018, 289(3): 677-685. DOI:10.1148/radiol.2018172889 |
| [15] |
张海平, 刘欣杰, 余翔玲, 等. 动态增强磁共振成像评价直肠癌壁外血管侵犯的价值[J]. 第三军医大学学报, 2019, 41(11): 7. |
| [16] |
AO W, ZHANG X, YAO X, et al. Preoperative prediction of extramural venous invasion in rectal cancer by dynamic contrast-enhanced and diffusion weighted MRI: a preliminary study[J]. BMC Med Imaging, 2022, 22(1): 1-12. DOI:10.1186/s12880-021-00730-0 |
| [17] |
ZHOU B, ZHOU Y, TANG Y, et al. Intravoxel incoherent motion MRI for rectal cancer: correlation of diffusion and perfusion characteristics with clinical-pathologic factors[J]. Acta Radiol, 2023, 64(3): 898-906. DOI:10.1177/02841851221100081 |
| [18] |
杨聪, 田荣华, 康嗣如, 等. PI-RADS v2.1中DWI评分和ADC值与前列腺癌Gleason分级分组的相关性[J]. 中国中西医结合影像学杂志, 2023, 21(1): 48-52. |
| [19] |
LI M, XU X, XIA K, et al. Comparison of diagnostic performance between perfusion-related intravoxel incoherent motion DWI and dynamic contrast-enhanced MRI in rectal cancer[J]. Comput Math Methods Med, 2021, 5095940. |
 2023, Vol. 21
2023, Vol. 21


