| 肺泡蛋白沉着症的CT诊断与鉴别诊断 |
2. 山东省日照市人民医院呼吸科,山东 日照 276800;
3. 山东省日照市中医医院胸外科,山东 日照 276800
肺泡蛋白沉着症(pulmonary alveolar proteinosis,PAP)是一种少见的、病因未明的,以肺泡及终末呼吸性细支气管内富含磷脂蛋白样表面活性物质沉积、缓慢发展为特征的弥漫性间质性肺疾病,过碘酸雪夫(pedodic acid Schiff,PAS)染色阳性。该病于1958年由病理学家Rosen等[1]首次提出,1965年国内首次报道[2-3]。因其发病率低,病因及发病机制不明,临床表现轻,CT表现重,临床表现与CT表现不符,且多种疾病与其CT表现相似,基层临床医师对其认识不足,诊断和鉴别诊断较困难,易延误治疗时机。现收集2003年1月至2015年12月经日照市中心医院、日照市人民医院、日照市中医院经临床及病理证实的PAP患者26例,报道如下。
1 资料与方法 1.1 一般资料26例中,男17例,女9例,男女比例2:1;年龄26~69岁,平均39.16岁;病程1个月~6年。其中无任何接触史16例,1例有饲养家禽史,6例有吸烟史,1例为油漆工人,1例为厨师,1例有粉尘接触史。咳嗽15例,以干咳为主;咳痰7例;合并感染发热3例;胸闷、活动后气促8例;无症状11例。双肺呼吸音减低11例;闻及细湿啰音6例;口唇发绀3例;杵状指1例;无阳性体征15例。
1.2 仪器与方法26例中15例行常规CT平扫,11例行HRCT扫描。应用Somatom PLUS 4、GE Ligh- tspeed 16 CT及Somatom Definition Flash双源CT扫描机。扫描参数:120 kV,150~185 mAs,层厚5.0 ~10 mm,层距5.0~10 mm,矩阵512×512,螺距1.2 ~1.375。扫描范围从肺尖至肋膈角水平。以肺窗(窗宽/窗位1 000~1 500 HU/-700~-650 HU,骨算法)和纵隔窗(窗宽/窗位400 HU/40 HU,软组织算法)观察。
1.3 临床分析对患者临床表现、CT征象及复查情况等进行比较分析。13例在确诊前1个月~6年的治疗复查中无明显变化,缓慢进展;13例首诊确诊;3例肺灌洗后,磨玻璃样密度灶变淡,边界更清晰。
2 结果 2.1 CT表现 2.1.1 病变分布两肺对称分布16例;不对称散在分布10例,其中呈“多岛样”分布5例(图 1);“蝶翼样”分布3例;周围性边缘分布2例;广泛性浸润4例。以上叶为主8例,以下叶为主6例。无叶段分布特点。
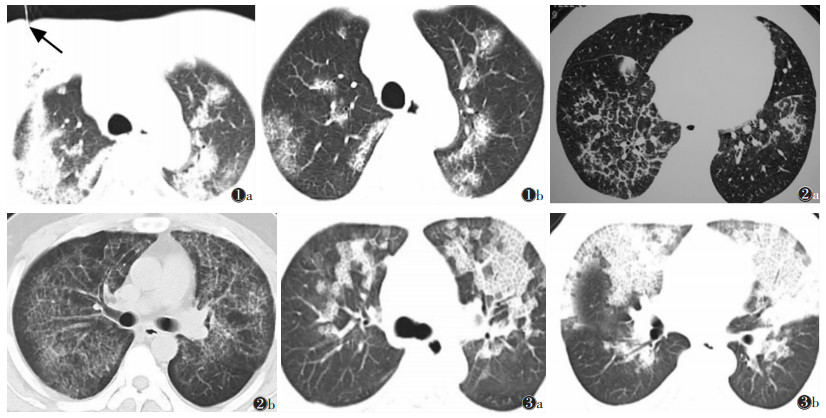 |
| 图 1 男,37岁,肺泡蛋白沉着症,无临床症状,查体发现图 1a CT引导下经皮肺穿刺,黑箭头所指穿刺针图 1b双肺见散在斑片状磨玻璃样高密度灶,呈“地图样”、“多岛样”分布,见“铺路石征” 图 2男,38岁,肺泡蛋白沉着症,无临床症状,2003年1月17日查体发现图 2a双肺片状磨玻璃样高密度灶,见“铺路石征”、“地图样”分布图 2b2005年12月28日复查,无临床症状,双肺弥漫分布磨玻璃样高密度灶,内见小叶间隔增厚,呈“铺路石征”,较3年前有进展图 3女,50岁,肺水肿图 3a双肺CT平扫见片状磨玻璃样高密度灶、“铺路石征”及“地图样”改变,“蝶翼样”分布图 3b病变内见实变区;治疗2 d后,双肺病变消失 |
2.1.2 病变形态
弥漫性7例,结节状3例,斑片状或大片状16例,结节状与斑片状共同存在3例,形态各异、不规则。
2.1.3 病变边缘边界清楚呈“地图样”改变20例(图 1,2),边界较模糊6例。
2.1.4 密度改变26例均为磨玻璃样高密度、欠均匀,小叶间隔增厚较光滑,肺结构无扭曲、破坏,小叶无变形,呈“铺路石征”(图 1,2);3例病变中央实变,其中2例合并感染,1例病程较长。
2.1.5 伴随征象2例可见病变内少量泡状透光区,1例可见支气管充气征,1例伴肺门淋巴结肿大,1例纵隔淋巴结肿大。
2.2 病理学表现6例经纤支镜肺活检确诊,17例经CT引导下经皮肺穿刺活检确诊(图 1),3例经肺泡灌洗液确诊。穿刺区取材物中见肺泡腔充满粉染颗粒状或云絮状无定形蛋白性物质,其间有针状裂隙及脱落退化的上皮细胞影,部分肺泡壁增厚,少量纤维组织轻度增生,间质血管扩张、充血;肺泡灌洗液为混浊乳白色液体,静置后沉淀分层;肺活检组织与肺泡灌洗液PAS染色均呈阳性。
3 讨论PAP是一种少见疾病,可发生于任何年龄,以30~50岁多见,男性多于女性,男女比例约2:1,病因及发病机制尚不明确。目前研究[4]表明其发病可能与抗粒细胞巨噬细胞集落刺激因子(GM-CSF)中和性抗体阻断GM-CSF的生物活性,阻碍肺泡巨噬细胞成熟,导致肺泡巨噬细胞功能缺陷,肺泡表面活性物质的清除障碍有关[4-5];或为组织对外界理化刺激的非特异性异常反应[6]。临床表现无特异性,发病多隐袭,逐渐出现咳嗽、咳痰、活动后气促和进行性呼吸困难等症状,约2/5患者无任何临床症状;1/2体格检查无阳性体征,2/5双肺呼吸音减低,1/5闻及细湿啰音,少数重者可出现发绀和杵状指[2]。PAP患者易并发肺部感染,合并感染或病期较长、病变广泛实变者,肺功能可出现限制性通气功能障碍和弥散功能障碍,也可出现低氧血症。继发感染是导致患者死亡的重要原因,因而早期诊断对PAP的治疗具有重要临床意义。
3.1 PAP的影像学表现X线胸片可发现病变,但不能清楚显示肺间质改变,鉴别诊断困难,常误诊为肺炎、肺水肿及转移瘤等[6]。胸部CT是显示和评价肺部病变最好的方法,也是PAP最具诊断价值的影像学检查方法,尤其是HRCT可清楚反映病变的范围、密度及间质改变[6-7],能够提供更多解剖细节,包括次级肺小叶结构和有关病变信息,且能作为患者随访复查及判断治疗效果的常用检查方法,是影像学检查的“金标准”。胸部CT表现为弥漫性或斑片状磨玻璃样密度灶伴小叶间隔增厚,“铺路石征”和“地图样”为主要改变,密度欠均匀、间隔增厚常见、纤维化少见、实变不常见[8-9],可散在或弥漫性、对称或不对称分布,对称性分布相对多见[10],可跨段、跨叶,无叶段分布特点。“岛样”或“多岛样”改变多见于早期病例。合并感染或病程较长、病变较广泛者可出现不同程度实变。CT表现的程度和临床症状、体征的严重程度不成正比[11],CT改变较重而临床症状相对较轻。部分合并肺部感染患者胸部CT表现与临床表现呈正相关,CT表现与临床症状,特别是与胸闷气促表现平行。文献[12-14]报道典型的“地图样”和“铺路石样”改变是PAP的特征性CT表现。“铺路石征”首先由Murch等[15]发现存在于PAP的CT图像上,后发现多种不同疾病均有该特征[16-18],但PAP与其他疾病相比,出现该特征的概率更高、范围更广。本组均出现“铺路石征”,76.92%(20/26)出现“地图样”改变及2种表现同时存在。上述2个影像表现并非PAP独有,需与肺部感染、外源性类脂性肺炎、细支气管肺泡癌、心源性肺水肿、肺泡出血等鉴别[19]。
3.2 PAP诊断要点① 仔细观察两肺,辨认所有异常征象,确定病变的一般特征、内部特征及病灶周围影像特征,再结合其他征象提出若干可能的疾病。②明确病变是以外周性分布或中央性分布、下叶分布或中上叶分布、对称分布或不对称分布、弥漫分布或小叶中心分布或淋巴道分布。③观察病变变化规律:与以前的相关影像学检查比较或动态随访观察病变的变化。④结合临床表现和病史及相关的实验室检查。
3.3 鉴别诊断需与以下疾病鉴别:①肺泡性肺水肿,常呈“蝶翼状”分布,常见大小不等的实变区,病灶动态变化快,1~2 d内可有显著变化(图 3),多有心肾疾病,左心功能不全,常有心脏增大、胸腔积液、Kerley B线。②特发性肺间质纤维化,多呈两下肺或边缘性分布,分布在肺外围、胸膜下;小叶间隔不规则增厚、粗糙、扭曲,可见胸膜下弧线影,常伴“蜂窝状”间质性改变,常见牵拉性支扩。③细菌性肺炎,病灶多位于双肺中内区,多呈小叶、肺段或肺叶影像,沿支气管血管束走行分布,病灶边缘模糊,与正常肺组织分界不清,经抗生素治疗病灶可在1~2周内有较明显吸收。④过敏性肺炎,因对某种物质过敏引起,分布弥漫,以两肺中下肺野或肺外区显著,呈不规则斑片状边缘模糊影,也可表现为粟粒状病灶,病变呈游走性;发病与工作和生活环境有一定的关系,过敏源接触史是诊断的重要依据,脱离发病环境临床症状消失。⑤肺泡出血,分布无规律性,一般不按肺叶、肺段分布,可呈局限性、弥漫性分布,无“地图样”或“铺路石征”表现,临床上有咯血症状,影像表现与临床症状一致,当咯血停止,病灶可短期内明显吸收。⑥浸润性黏液腺癌,病变多位于肺野外周或胸膜下,侵及1个以上肺段或肺叶或多个肺叶,以肺叶或肺段分布,常有支气管充气征,支气管壁不规则、凸凹不平、僵硬、扭曲,呈“枯树枝状”,病程发展迅速,不断增大、增多,常见纵隔、肺门淋巴结肿大。
病理检查是PAP确诊的金标准,也可经纤维支气管镜、CT引导下经皮肺穿刺、胸腔镜、开胸肺活检或肺泡灌洗液PAS染色以确诊。纤维支气管镜肺活检获得的标本较小,标本挤压后易变形,有时会影响病理诊断的结果[20],且胸腔镜及开胸肺活检创伤大、风险大、费用高。CT引导下经皮肺穿刺活检具有定位准确、操作简便易行、确诊率高、费用低、并发症少、临床医师认可度高和患者依从性好等优点,值得临床推广应用。
总之,胸部CT呈“地图样”改变及“铺路石征”在PAP诊断中具有一定特征性。当出现其中一种表现特别是“铺路石征”时需考虑本病;当2种表现同时存在,且无实变、无肺结构扭曲、无小叶变形、无牵拉性支扩,结合临床表现及随访观察病变动态变化,诊断准确率较高。
| [1] |
Rosen SH, Castleman B, Liebow AA, et al. Pulmonary alveolar proteinosis[J]. N Eng J Med, 1958, 258: 1123-1142. DOI:10.1056/NEJM195806052582301 |
| [2] |
陈灏珠. 实用内科学:下册[M]. 北京: 人民卫生出版社, 2005, 1741-1742.
|
| [3] |
谢敏, 熊维宁, 熊盛道, 等. 全肺灌洗术治疗肺泡蛋白沉积症1例并文献复习[J]. 临床肺科杂志, 2010, 15(9): 1276-1277. |
| [4] |
Inoue Y, Trapnell BC, Tazawa R, et al. Characteristics of a large cohort of patients with autoimmune pulmonary alveolar proteino-sis in Japan[J]. Am J Respire Crit Care Med, 2008, 177: 752-762. DOI:10.1164/rccm.200708-1271OC |
| [5] |
Tazawa R, Trapnell BC, Inoue Y, et al. Inhaled granulocyte/macr-ophage-colony stimulating factor as therapy for pulmonary alveo-lar proteinosis[J]. Am J Respire Crit Care Med, 2010, 181: 1345-1354. DOI:10.1164/rccm.200906-0978OC |
| [6] |
李松年, 唐光建. 现代全身CT诊断学[M]. 2版.北京: 中国医药科技出版社, 2007, 661-662.
|
| [7] |
陈一平. 肺泡蛋白沉积症HRCT表现分析[J]. 现代中西医结合杂志, 2008, 17(13): 2042-2043. DOI:10.3969/j.issn.1008-8849.2008.13.085 |
| [8] |
蔡祖龙, 高元桂. 胸部CT与MRI诊断学[M]. 北京: 人民军医出版社, 2005, 368-371.
|
| [9] |
杨连发, 何敬, 雷亿成, 等. 肺泡蛋白沉积症影像学诊断[J]. 中国中西医结合影像学杂志, 2010, 8(2): 114-116. |
| [10] |
Ishii H, Trapnell BC, Tazawa R, et al. Comparative study of hi-gh-resolution CT findings between autoimmune and secondary pulmonary alveolar proteinosis[J]. Chest, 2009, 136: 1348-1355. DOI:10.1378/chest.09-0097 |
| [11] |
李至, 高艾东, 韩洪民. 肺泡沉积症的HRCT诊断[J]. 中国医学影像学杂志, 2007, 15(1): 202-231. |
| [12] |
Xiao SK, Zhu YH, Cai HS. High resolution CT diagnosis of pu-lmonary alveolar proteinosi[J]. J Pract Radiol, 2011, 27: 883-885. |
| [13] |
Luo J, Yang D, Zhou S, et al. Crazy paving pattern caused by pulmonaryalveolar prateinosis:CT findings and the pathologic ba-sis[J]. J Cent South Univ, 2014, 39: 924-929. |
| [14] |
陈佩荣, 蔡后荣. 肺泡蛋白沉积症的影像诊断与鉴别诊断[J]. 临床肺科杂志, 2005, 10(3): 313-314. |
| [15] |
Murch CR, Carr DH. Computed tomography appearances of pu-lmonary alveolar proteinosis[J]. Clin Radiol, 1989, 40: 240-243. DOI:10.1016/S0009-9260(89)80180-1 |
| [16] |
Johkoh T, Itoh H, Muller NL, et al. Crazy-paving appearance at thinsection CT:spectrum of disease and pathologic findings[J]. Radiology, 1999, 211: 155-160. DOI:10.1148/radiology.211.1.r99ap10155 |
| [17] |
Rossi SE, Erasmus JJ, Volpacchio M, et al. "Crazy-paving" pat-tern at thin-section CT of the lungs:radiologic-pathologic overv-iew[J]. Radiographics, 2003, 23: 1509-1519. DOI:10.1148/rg.236035101 |
| [18] |
Lee CH. The crazy-paving sign[J]. Radiology, 2007, 243: 905-906. DOI:10.1148/radiol.2433041835 |
| [19] |
Johkoh T, Itlh H, Muller NL, et al. Crazy-paving appearance at thinsection CT:spectrum of disease and pathologic findings[J]. Radiology, 1999, 77: 155-160. |
| [20] |
姜静波, 吴宏成, 汤耀东, 等. 肺泡蛋白沉积症的临床分析和诊治的探讨[J]. 临床肺科杂志, 2008, 13(1): 41-44. |
 2018, Vol. 16
2018, Vol. 16


