| 卵巢子宫内膜样癌与高级别浆液性癌临床及MRI特征的对照分析 |
卵巢癌是世界上第7位最常见的癌症,也是女性癌症相关死亡的第5大原因[1]。在病理上卵巢癌通常由一组不同种类的肿瘤组成,包括上皮肿瘤、性索间质肿瘤和生殖细胞来源的肿瘤。在这些类型中,卵巢上皮癌是最主要的病理学亚型,由浆液性癌、黏液腺癌、子宫内膜样癌(ovarian endometrioid carcinoma,OEC)及透明细胞癌等主要亚型构成[2]。浆液性癌分为高级别浆液性癌(high-grade serous carcinoma,HGSC)和低级别浆液性癌(low-grade serous carcinoma,LGSC),其中HGSC占大多数。OEC和HGSC在病因、发病机制、危险因素、形态特征和预后方面存在差异[3]。HGSC是卵巢癌中最常见的组织学类型,具有卵巢上皮性肿瘤的典型特征,对化疗敏感度高[4],临床发现时多为晚期。约50%的OEC在较早期发现,组织学分级较低,对化疗反应良好,复发率较低,预后相对较好[5]。此外,虽卵巢肿瘤手术中保留生育能力的成功率较低,但对Ⅰ期上皮性卵巢癌患者相对安全,总生存率与根治性手术相比,并无差异[6]。相比之下,HGSC患者需行根治性手术分期和细胞减灭术[7]。因此,区分OEC和HGSC对手术计划的制订至关重要,特别是对有保留生育能力和内分泌功能要求的Ⅰ期患者。上皮源性卵巢肿瘤在临床及影像特征方面有一定重叠,有效诊断和治疗较困难。MRI广泛应用于卵巢恶性肿瘤的鉴别诊断及预后评价中。本研究比较分析OEC与HGSC的临床及MRI特征,旨在提高MRI对OEC与HGSC鉴别诊断水平。
1 资料与方法 1.1 一般资料收集2016年1月至2021年3月我院经手术病理证实的OEC及HGSC患者的临床及影像资料。纳入标准:①经术后病理学检查证实为OEC或HGSC,且临床资料完整;②术前行盆腔MRI平扫及增强扫描,图像清晰;③MRI检查前未经手术及放化疗等治疗。排除标准:①MRI图像质量差或病灶难以识别;②病灶为肿瘤复发及转移者;③合并其他类型卵巢肿瘤。
最终纳入OEC患者12例(OEC组)及HGSC患者22例(HGSC组)。记录2组的临床资料,包括患者年龄、体征、是否绝经、实验室检查、国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)分期及是否合并子宫内膜异位症等。
1.2 仪器与方法采用Siemens Skyra 3.0 T MRI扫描仪及正交线圈。平扫序列与参数:横断面脂肪抑制和非脂肪抑制SE T1WI,TR/TE 600 ms/10 ms;横断面、冠状面、矢状面T2WI,TR/TE 3 500 ms/96 ms;冠状面STIR,TR/TE 6 000 ms/70 ms;矩阵512×512,NEX 2~4,平均NEX 3,层厚、层距均为4 mm,视野380 mm×380 mm。DWI采用单次激发平面回波序列行横轴面扫描,TR 3 200 ms,TE 80 ms,b值分别为800、1 000 s/mm2,层厚5 mm,矩阵512×512,视野250 mm×250 mm。多期动态增强扫描,TR/TE 4 600 ms/60 ms,视野380 mm×380 mm,层厚5.0 mm。动态增强扫描在采集2次基线扫描后,用高压注射器以3.0 mL/s的注射流率静脉注射Gd-DTPA,剂量0.2 mmol/kg体质量,后注入20 mL生理盐水冲洗导管,行横断面脂肪抑制T1WI扫描(3D Vibe,TR 3.23 ms,TE 1.22 ms,层厚2 mm,无间隔),共采集40个相位的图像,时间分辨率7 s,翻转角12°。
1.3 统计学处理采用SPSS 23.0软件进行统计学分析。正态分布数据以x±s描述,分类资料之间的比较行χ2检验及Fisher精确概率检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组临床资料比较(表 1)| 表 1 2组的临床资料对比 |
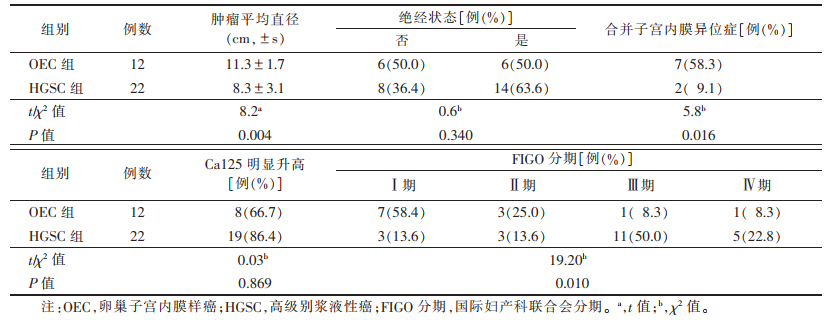 |
OEC组患者发病年龄平均(47.0±5.6)岁,HGSC组平均(55.0±8.5)岁。2组在肿瘤平均直径、是否合并子宫内膜异位症及FIGO分期方面差异均有统计学意义(均P<0.05)。OEC组肿瘤平均直径相对较大,合并子宫内膜异位症发生率更高。OEC组FIGO分期多为Ⅰ、Ⅱ期(10/12,83.3%);而HGSC组以Ⅲ期多见(11/22,50.0%)。OEC早期CA125数值相对偏低,当发生腹膜种植转移时,CA125在2组中均有较明显升高,但差异无统计学意义(P=0.869)。
2.2 2组MRI表现比较(表 2)| 表 2 2组卵巢恶性肿瘤的MRI特征对比 |
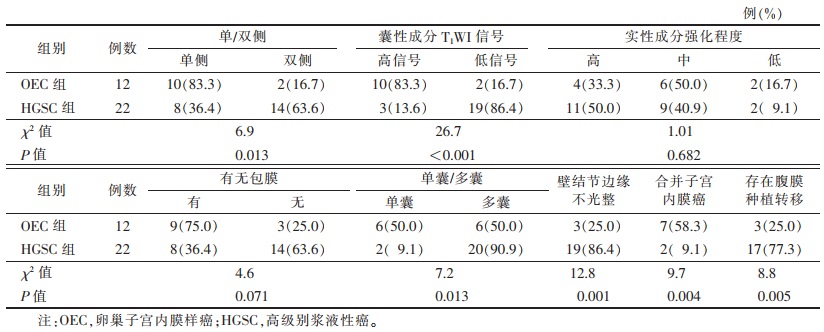 |
OEC组12例共14个卵巢肿瘤(图 1,2),HGSC组22例共36个卵巢肿瘤(图 3)。OEC病灶单侧多见,而HGSC双侧发生率较高(P=0.013)。OEC相对于HGSC病灶形态较规则、囊壁光滑、光整,75.0%(9/12)的病灶具有包膜,边界相对清晰。OEC壁结节及乳头突起较光整,形态相对规则(P=0.001)。尤其在囊性成分表现中,OEC囊性成分内出现T1WI高信号的概率大于HGSC(P<0.001),有时囊性成分与实质肿块在T2WI信号分界不清,但增强扫描囊性成分与实质肿块间分界较清晰。另外,OEC病灶合并子宫内膜癌的发生率远高于HGSC(P=0.004)。因发现OEC时病灶大多分期较早,FIGO分期多在Ⅰ、Ⅱ期,HGSC分期常较晚,大量腹水及腹膜种植转移情况均较OEC多见,两者差异均有统计学意义(均P<0.05)。
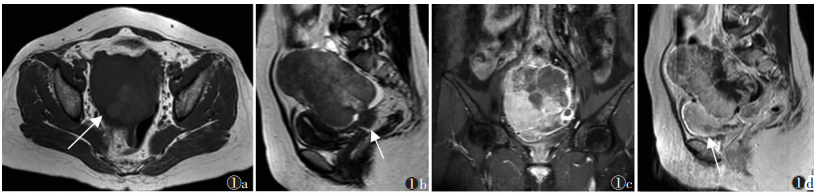 |
| 注:患者,女,43岁,腹胀1个月入院,CA125 103.7 U/mL,右卵巢肿瘤大小12 cm×10 cm×8 cm。图1a为横断面T1WI,示盆腔较大卵圆形病灶,肿块内可见类圆形T1WI稍高信号灶(白箭);图1b为矢状面T2WI,示病灶呈稍高、较高混杂信号影,囊实分界区欠清,其外周可见低信号包膜,境界清晰,边缘光整,后穹窿处可见深部浸润子宫内膜异位灶,子宫下段内膜信号不均(白箭);图1c为冠状面脂肪抑制T1WI增强扫描,示病灶增强扫描后,囊实性交界区变清晰,囊性成分无强化,实性成分明显强化;图1d为矢状面T1WI增强扫描,示子宫下段内膜可见低强化区域(白箭)。术后病理证实合并子宫内膜癌 图 1 卵巢子宫内膜样癌(OEC)伴子宫内膜癌的MRI图像 |
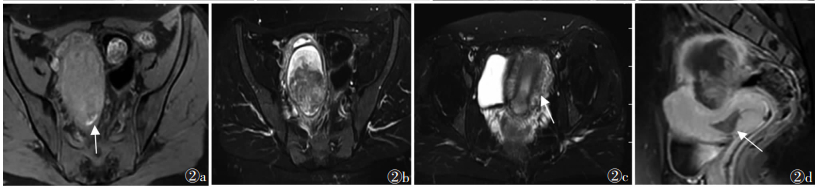 |
| 注:患者,女,32岁,不规则阴道流血1周,右卵巢肿瘤大小6.2 cm×6.0 cm×5.6 cm。图2a为横断面脂肪抑制T1WI,可见右侧卵巢囊实性病灶,其底部弧形高信号灶(白箭),提示出血;图2b为横断面脂肪抑制T2WI,示病灶呈囊实性成分,实性成分呈不均匀等及稍高混杂信号,囊性成分以高信号为主,单囊,病灶边界清晰,边缘光整,可见低信号包膜;图2c为横断面脂肪抑制T2WI,可见子宫内膜增厚,最厚处约21 mm,T2WI呈稍高信号(白箭),术后病理证实为子宫内膜癌;图2d为矢状面脂肪抑制T1WI增强扫描,可见子宫内膜癌灶低强化(白箭),呈典型双发癌特征 图 2 卵巢OEC伴子宫内膜癌的MRI图像 |
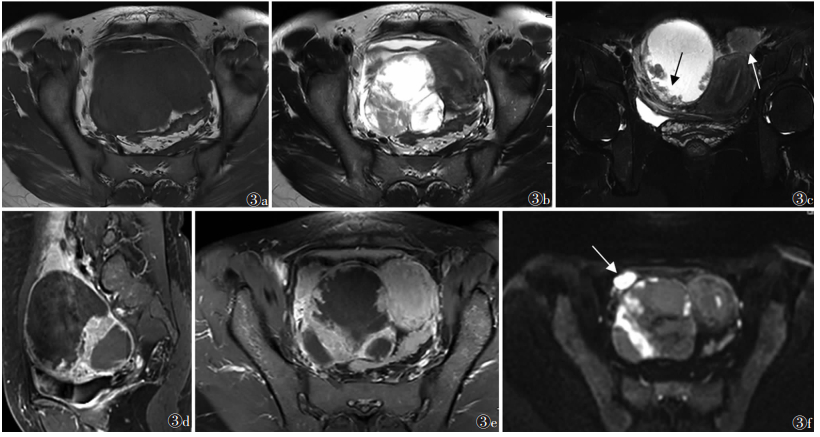 |
| 注:患者,女,47岁,发现盆腔包块3个月,CA125 306.9 U/mL,国际妇产科联合会(FIGO)分期Ⅲc期。图3a为横断面T1WI,示盆腔肿块呈均匀低信号改变,信号较均匀;图3b为横断面T2WI,示右侧卵巢囊实性肿块,实性成分形态不规则,边界不清,呈等、稍高混杂信号,囊性成分高信号,可见多发壁结节及乳头突起,囊间隔粗细不均;图3c为横断面脂肪抑制T2WI,可见多发壁结节,形态不规则(黑箭),左侧髂窝可见转移结节灶(白箭);图3d,3e分别为矢状面及横断面T1WI增强扫描,肿块实性成分明显强化,间隔混杂,强化程度达到子宫肌层强化水平;图3f为横断面DWI,示肿块实性部分明显弥散受限,病灶右前缘可见转移结节灶(白箭) 图 3 卵巢高级别浆液性癌(HGSC)的MRI图像 |
3 讨论
HGSC是卵巢癌最常见的亚型,目前认为其来源于输卵管远端的分泌上皮细胞,一种单一、未固定的扁平至立方上皮,源于体腔中胚层,其涉及P53突变,少有复发性驱动突变。HGSC早期几乎没有预警信号和非特异性症状,临床诊断较困难,是卵巢癌中最致命的一种[7]。OEC属于卵巢上皮-间质来源肿瘤,占上皮来源肿瘤的10%[8],与浆液性癌同属卵巢较常见的2种上皮来源肿瘤。既往认为,OEC是一种组织学特征类似于子宫内膜癌的卵巢原发肿瘤,可能来源于子宫内膜腺上皮分泌细胞,具有雌、孕激素受体[9]。其组织学起源有2种学说,一种认为卵巢生发上皮向子宫内膜方向分化,一种认为可能是发生于子宫内膜异位灶的恶变[10]。其组织学分型有:卵巢单纯OEC、复合型、混合型、卵巢嗜酸性OEC及卵巢OEC似性索间质类肿瘤,故常可见肿瘤内合并黏液腺癌、浆液性癌、透明细胞癌等成分,有时也可见性索间质成分[3]。OEC病理上大体标本大部分呈囊实性,少数呈实性,囊液暗红色,囊腔内可见大小不等结节状突起,实性成分呈灰褐色,质较脆。镜下显示肿瘤细胞呈乳头状或不规则腺样排列,部分区域呈筛孔状,浸润性生长,肿瘤细胞核大,核仁明显,有异型性。若出现异型子宫内膜样腺体有助于确诊[3]。OEC多发生于50~60岁,本组年龄最小仅32岁。临床表现为阴道不规则流血,月经量增多,月经紊乱;腹腔、盆腔包块,可伴不同程度腹胀、腹痛症状;晚期伴周围浸润改变,可出现尿路及肠道症状。
OEC常表现为圆形、类圆形、椭圆形或分叶状肿块,体积较大,多为囊实性,单侧多见。OEC的实性成分相对浆液性癌的实性成分规则,可见具体形态,极少见混杂间隔及广泛不规则壁结节,增强扫描肿块强化程度呈中等或明显强化,肿块内无钙化特征;浆液性癌有时出现不规则沙砾样钙化灶[1],且浆液性癌双侧发生概率居多。组织病理学已证实非典型子宫内膜异位症是OEC的前驱病变,20%~40%的患者发现OEC与子宫内膜异位症相关;病灶的囊性成分常合并不同时期出血及黏液混合物,故其囊性部分T1WI呈高信号,T2WI呈等、稍高及高低不等混杂信号,而浆液性癌的囊性部分呈较清澈均匀的T2WI高信号[11-12],这对两者亦有一定鉴别诊断价值。本组OEC囊性成分T1WI高信号出现率为83.3%,高于上述文献报道,提示本组伴发较高比率的子宫内膜异位症。Choi等[13]报道,这种T1WI高信号可能是区分OEC和HGSC的一个要点。文献报道,约86%的HGSC的囊性成分呈等或低信号,类似于骨盆肌肉或等同于尿液[14]。另外,浆液性癌不规则、分支状、分层堆积成簇的附壁小结节及小乳头突起往往比OEC表现出更高的恶性特质,早期常伴大量的盆腔积液和盆腔腹膜的种植转移等改变,而OEC出现转移较晚,这可能与OEC病灶体积较大易被早期发现有关。OEC病灶壁结节及乳头状突起相对光整光滑,乳头突起认为是上皮源性肿瘤的最佳预测因子,且与肿瘤的侵袭性相关[15];组织学上,乳头状突起代表生长在基质核心上的上皮增生褶皱,有助于区分良性肿瘤和交界性/恶性肿瘤[16],本组75.0%(9/12)的OEC病灶中乳头突起较光整光滑,与既往文献报道一致。OEC与HGSC肿瘤实性成分均呈中度至明显强化,囊腔无强化,两者无明显差异。但OEC增强扫描囊实性分界区显示更清晰。在目前研究中,约10%的卵巢癌患者同时患有子宫内膜癌,约5%的子宫内膜癌患者患有卵巢癌[17]。文献报道,OEC与子宫内膜癌的同步发生率为50%~70%[18],本组为58.3%(7/12),与文献报道一致。双发癌为OEC的一个重要特点,主要因为OEC与子宫内膜癌的组织学起源类似,非典型的子宫内膜增生及子宫内膜异位囊肿均被认为是OEC的癌前病变[19]。
本研究亦存在一些不足:①数据来自于单中心,样本量不足,且为回顾性分析,取样可能存在偏差;②对实验室检查指标分析相对较少;③主要分析常规MRI特征,功能MRI的特点未能进一步阐述;④未行MRI特征与病理的相关性分析。
总之,当围绝经期女性出现腹盆腔肿块时,如为囊性、囊实性病灶,形态较规则,单侧发病,囊内结节及乳头突起较光整,实性成分强化明显,FIGO分期多为Ⅰ、Ⅱ期,囊性成分出现T1WI高信号与子宫内膜异位症相关,合并双发癌等特点,多提示OEC;而肿瘤形态极不规则,无明显偏侧性,FIGO分期以Ⅲ期及以上多见,与子宫内膜异位症无关,囊性灶以多囊为主,囊间隔混杂,囊内结节形态不规则,实性成分较明显强化,出现腹膜种植转移及腹盆腔积液时,多提示HGSC。
| [1] |
MCCLUGGAGE W G. Morphological subtypes of ovarian carcinoma: a review with emphasis on new developments and pathogenesis[J]. Pathology, 2011, 43(5): 420-432. DOI:10.1097/PAT.0b013e328348a6e7 |
| [2] |
MORIOKA S, KAWAGUCHI R, YAMADA Y, et al. Magnetic resonance imaging findings for discriminating clear cell carcinoma and endometrioid carcinoma of the ovary[J]. J Ovarian Res, 2019, 12(1): 20. DOI:10.1186/s13048-019-0497-1 |
| [3] |
SAMARTZIS E P, LABIDI-GALY S I, MOSCHETTA M, et al. Endometriosis-associated ovarian carcinomas: insights into pathogenesis, diagnostics, and therapeutic targets-a narrative review[J]. Ann Transl Med, 2020, 8(24): 1712. DOI:10.21037/atm-20-3022a |
| [4] |
ZEPPERNICK F, MEINHOLD-HEERLEIN I, SHIH IEM. Precursors of ovarian cancer in the fallopian tube: serous tubal intraepithelial carcinoma--an update[J]. J Obstet Gynaecol Res, 2015, 41(1): 6-11. DOI:10.1111/jog.12550 |
| [5] |
WANG S, QIU L, LANG J H, SHEN K, et al. Prognostic analysis of endometrioid epithelial ovarian cancer with or without endometriosis: a 12-year cohort study of Chinese patients[J]. Am J Obstet Gynecol, 2013, 209(3): 241. |
| [6] |
KAJIYAMA H, MIZUNO M, SHIBATA K, et al. Recurrence-predicting prognostic factors for patients with early-stage epithelial ovarian cancer undergoing fertility-sparing surgery: a multi-institutional study[J]. Eur J Obstet Gynecol Reprod Biol, 2014, 175: 97-102. DOI:10.1016/j.ejogrb.2014.01.014 |
| [7] |
LISIO M A, FU L, GOYENECHE A, GAO Z H, et al. Highgrade serous ovarian cancer: basic sciences, clinical and therapeutic standpoints[J]. Int J Mol Sci, 2019, 20(4): 952. DOI:10.3390/ijms20040952 |
| [8] |
ONO T, KISHIMOTO K, TAJIMA S, et al. Apparent diffusion coefficient (ADC) values of serous, endometrioid, and clear cell carcinoma of the ovary: pathological correlation[J]. Acta Radiol, 2020, 61(7): 992-1000. DOI:10.1177/0284185119883392 |
| [9] |
WENDEL J R H, WANG X, HAWKINS S M. The endometriotic tumor microenvironment in ovarian cancer[J]. Cancers (Basel), 2018, 10(8): 261. DOI:10.3390/cancers10080261 |
| [10] |
相世峰. 卵巢子宫内膜样癌的MRI诊断与分期[J]. 医学影像学杂志, 2016, 26(11): 2051-2053, 2060. |
| [11] |
MURAKAMI K, KOTANI Y, NAKAI H, et al. Endometriosis-associated ovarian cancer: the origin and targeted therapy[J]. Cancers (Basel), 2020, 12(6): 1676. DOI:10.3390/cancers12061676 |
| [12] |
STEWART C J, WALSH M D, BUDGEON C A. Immunophenotypic analysis of ovarian endometrioid adenocarcinoma: correlation with KRAS mutation and the presence of endometriosis[J]. Pathology, 2013, 45(6): 559-566. DOI:10.1097/PAT.0b013e3283650ad7 |
| [13] |
CHOI H J, LEE J H, SEOK LEE J, et al. CT findings of clear cell carcinoma of the ovary[J]. J Comput Assist Tomogr, 2006, 30(6): 875-879. DOI:10.1097/01.rct.0000220795.45782.1d |
| [14] |
LISIO M A, FU L, GOYENECHE A, et al. High-grade serous ovarian cancer: basic sciences, clinical and therapeutic standpoints[J]. Int J Mol Sci, 2019, 20(4): 952. DOI:10.3390/ijms20040952 |
| [15] |
HASSEN K, GHOSSAIN M A, ROUSSET P, et al. Characterization of papillary projections in benign versus borderline and malignant ovarian masses on conventional and color Doppler ultrasound[J]. AJR Am J Roentgenol, 2011, 196(6): 1444-1449. DOI:10.2214/AJR.10.5014 |
| [16] |
SAINI A, DINA R, MCINDOE G A, et al. Characterization of adnexal masses with MRI[J]. AJR Am J Roentgenol, 2005, 184(3): 1004-1009. DOI:10.2214/ajr.184.3.01841004 |
| [17] |
SOLIMAN P T, SLOMOVITZ B M, BROADDUS R R, et al. Synchronous primary cancers of the endometrium and ovary: a single institution review of 84 cases[J]. Gynecol Oncol, 2004, 94: 456-462. DOI:10.1016/j.ygyno.2004.05.006 |
| [18] |
TONG S Y, LEE Y S, PARK J S, et al. Clinical analysis of synchronous primary neoplasms of the female reproductive tract[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 136(1): 78-82. DOI:10.1016/j.ejogrb.2006.09.010 |
| [19] |
LI H M, QIANG J W, XIA G L, et al. MRI for differentiating ovarian endometrioid adenocarcinoma from highgrade serous adenocarcinoma[J]. J Ovarian Res, 2015, 8(1): 26. DOI:10.1186/s13048-015-0154-2 |
 2023, Vol. 21
2023, Vol. 21


