| 女性盆腔恶性生殖细胞肿瘤的临床及CT表现 |
2. 山东省精神卫生中心放射科,山东 济南 250014;
3. 山东省淄博市第一医院放射科,山东 淄博 255200;
4. 山东大学齐鲁医院放射科,山东 济南 250014
女性盆腔生殖细胞肿瘤多为卵巢起源, 少数位于骶尾部、骶前及阴道等部位。卵巢肿瘤根据起源分为上皮性肿瘤、生殖细胞肿瘤、性索间质肿瘤及其他种类肿瘤。卵巢生殖细胞肿瘤源于胚胎性腺原始生殖细胞, 占所有卵巢肿瘤的20%~25%, 其中95%为成熟囊性畸胎瘤, 多含脂肪、钙化, 影像特征明显, 易于诊断。恶性生殖细胞肿瘤仅占卵巢生殖细胞肿瘤的5%[1-2], 无性细胞瘤、未成熟畸胎瘤、卵黄囊瘤及混合性生殖细胞瘤相对常见, 胚胎性癌、绒毛膜癌及恶性卵巢甲状腺肿等少见或罕见[3]。女性盆腔恶性生殖细胞肿瘤病理类型较多, 临床及影像表现复杂多样, 术前误诊率较高。回顾性分析30例女性盆腔恶性生殖细胞肿瘤的CT特征, 并结合发病年龄、临床症状及肿瘤标记物水平综合分析, 以提高诊断水平。
1 资料与方法 1.1 一般资料收集2014年12月至2018年7月山东大学齐鲁医院经手术病理证实的30例女性盆腔恶性生殖细胞肿瘤患者; 年龄11个月~65岁, 平均20.7岁, < 18岁18例(60.0%)。其中, 8例腹胀, 13例腹痛, 13例盆部包块, 3例恶心、呕吐, 3例发热, 1例停经, 2例不规则阴道流血, 1例尿频、排便困难。1例17岁, 染色体核型为(46, XY), 无月经来潮, 性腺发育不全, 临床诊断为XY单纯性腺发育不全综合征(又称Swyer综合征); 1例22岁, 计算力下降, 行为异常, 抗N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)抗体阳性, 临床诊断为畸胎瘤相关性副肿瘤边缘叶脑炎。4例为查体偶然发现。30例(共30个肿瘤)均为盆腔单发肿瘤, 27例行手术切除, 3例行穿刺活检。其中卵黄囊瘤10例, 无性细胞瘤8例, 未成熟畸胎瘤5例, 混合性生殖细胞肿瘤3例(卵黄囊瘤与成熟畸胎瘤2例、胚胎性癌与卵黄囊瘤混合1例), 卵巢甲状腺肿2例(1例增殖活跃, 1例合并局部类癌), 类癌1例, 胚胎性癌1例。
1.2 仪器与方法16例行CT平扫+增强扫描, 12例仅行CT增强扫描, 2例仅行CT平扫。采用Philips Brilliance 256层螺旋CT机, 扫描范围从膈肌至耻骨联合, 扫描参数:120 kV, 200 mAs, 层厚5 mm, 螺距1, 重组图像层厚、层距均为5 mm。增强扫描使用高压注射器经肘静脉注射优维显(300 mgI/mL, 德国拜耳医药公司), 剂量1.5 mL/kg体质量, 流率3.0 mL/s, 注射对比剂后延迟60 s行增强扫描。
1.3 图像分析分析内容包括:肿瘤最大径、发病部位、成分(实性为主:实性比例>50%;囊性为主:囊性比例>50%)、边缘分叶; 瘤内脂肪、钙化情况; 增强扫描强化程度、瘤内“亮点征”、纤维血管隔; 盆腔积液(超出盆腔为大量)。
2 结果 2.1 不同类型盆腔恶性生殖细胞肿瘤的患者年龄、发生部位不同类型肿瘤患者年龄分布见表 1, 不同类型肿瘤部位见表 2。
| 表 1 不同类型盆腔恶性生殖细胞肿瘤患者年龄分布 |
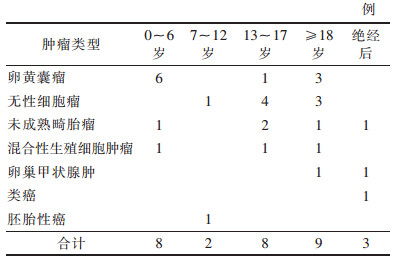 |
| 表 2 不同类型盆腔恶性生殖细胞肿瘤部位 |
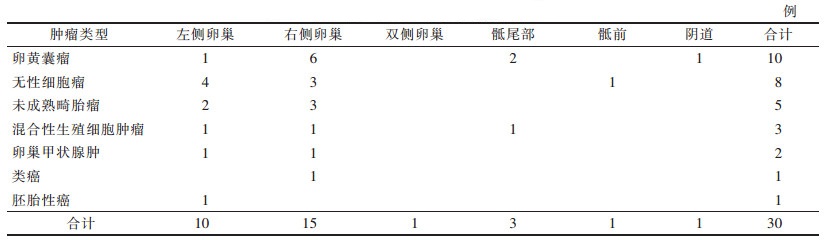 |
25例位于卵巢, 左侧10例, 右侧15例。盆腔非卵巢来源肿瘤5例, 包括骶尾部卵黄囊瘤2例, 阴道卵黄囊瘤1例, 骶前无性细胞瘤1例, 骶尾部混合性生殖细胞瘤1例。
2.2 肿瘤标记物30例中, 25例术前行肿瘤标记物检测, 甲胎蛋白(AFP)水平升高14例(包括8例卵黄囊瘤、3例混合性生殖细胞肿瘤、2例未成熟畸胎瘤及1例胚胎性癌); 人绒毛膜促性腺激素(hCG)水平升高2例(1例无性细胞瘤、1例胚胎性癌); 1例胚胎性癌AFP及hCG水平同时升高; CA125水平升高3例(1例卵黄囊瘤明显升高, 1例混合性生殖细胞肿瘤和1例胚胎性癌轻度升高); CA19-9水平升高3例(1例增殖活跃的卵巢甲状腺肿明显升高, 1例混合性生殖细胞瘤及1例胚胎性癌略高)。不同类型恶性生殖细胞肿瘤的肿瘤标记物水平见表 3。
| 表 3 不同类型盆腔恶性生殖细胞肿瘤的肿瘤标记物水平 |
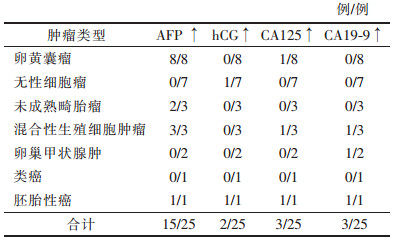 |
2.3 CT表现(表 4)
| 表 4 不同类型盆恶性生殖细胞肿瘤的主要CT特征(n=30) |
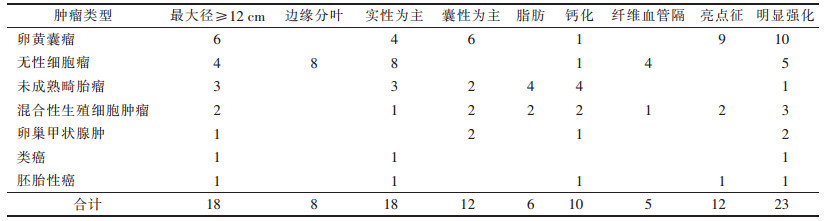 |
肿瘤最大径4~23 cm, 平均12.4 cm, 18例肿瘤最大径≥12 cm。8例无性细胞瘤中, 6例边缘深分叶, 2例浅分叶(图 1)。18例肿瘤以实性成分为主(图 2), 12例呈囊性或以囊性为主; 肿瘤内含脂肪6例; 其中4例未成熟畸胎瘤, 2例混合性生殖细胞瘤(卵黄囊瘤与成熟畸胎瘤)。肿瘤内钙化10例, 未成熟畸胎瘤4例, 混合性生殖细胞瘤(卵黄囊瘤与成熟畸胎瘤)2例(图 3), 卵黄囊瘤、胚胎性癌、无性细胞瘤和卵巢甲状腺肿各1例。大量盆腔积液5例, 其中1例卵黄囊瘤成分为主的混合性生殖细胞肿瘤破裂、盆腔积血, 其他患者少量盆腔积液或未见积液。腹膜增厚6例; 盆腔淋巴结肿大9例; 1例性腺发育不全表现为子宫发育小, 左侧卵巢软组织肿块。所有患者均未见盆腔外转移。
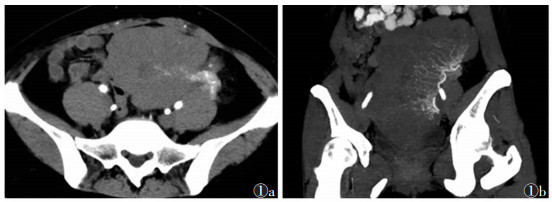 |
| 图 1 女, 30岁, 左侧卵巢无性细胞瘤 图1a, 1b 增强扫描及MIP图像, 盆腔实性软组织肿块, 边缘分叶, 血供丰富, 见纤维血管隔自左侧附件区向病变中央走行, 呈扇形分布 |
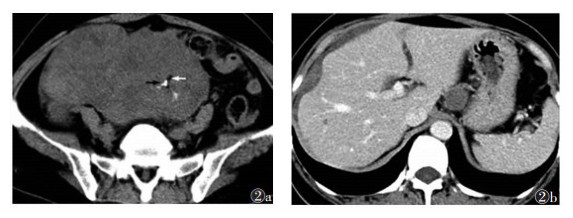 |
| 图 2 女, 3岁, 右侧卵巢未成熟畸胎瘤 图2a, 2b CT平扫和增强扫描不同层面图像, 腹盆腔软组织肿块, 实性为主, 内见细小脂肪(图 2a白箭)及钙化灶(图 2a黑箭)。肝脏周围腹膜增厚, 肝胃间腹膜结节, 与原发肿瘤密度一致 |
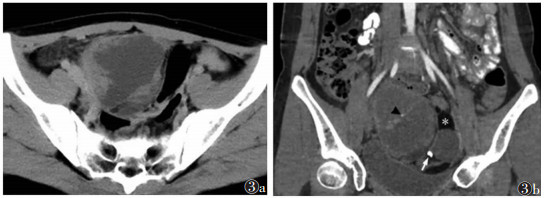 |
| 图 3 女, 17岁, 右侧卵巢混合性生殖细胞肿瘤 图3a, 3b 增强扫描轴位和冠状位重组图像, 盆腔混杂密度肿块, 左侧部为成熟畸胎瘤, 内见脂肪(图 3b白星)、钙化(图 3b白箭); 右侧部为卵黄囊瘤, 呈囊实性, 实性部分明显强化, 见“亮点征”(图 3b黑箭头) |
CT增强扫描示纤维血管隔5例; 其中4例无性细胞瘤, 1例混合性生殖细胞瘤。肿瘤中血管断面明显强化呈“亮点征”12例, 其中9例卵黄囊瘤(图 4), 3例含卵黄囊瘤成分的混合性生殖细胞瘤。17例肿瘤实性部分或分隔明显强化, 包括9例卵黄囊瘤, 3例以卵黄囊瘤成分为主的混合性生殖细胞瘤, 2例卵巢甲状腺肿, 1例未成熟畸胎瘤及1例类癌、1例胚胎性癌。6例显示肿瘤血管束周围明显强化, 其中5例无性细胞瘤, 1例混合性生殖细胞瘤。
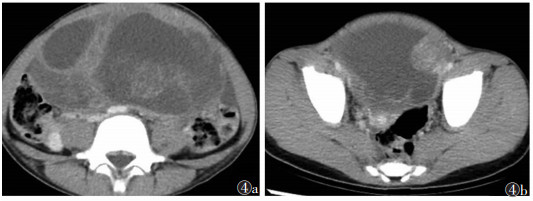 |
| 图 4 女, 6岁, 左侧卵巢卵黄囊瘤 图4a, 4b 增强扫描不同层面图像盆腔囊实性肿块, 实性部分不规则, 明显强化 |
3 讨论
女性盆腔恶性生殖细胞肿瘤多见于青少年[4]。本研究中0~6岁8例, 占26.7%, < 18岁18例, 占60.0%, 绝经后患者仅3例, 占10.0%。患者就诊时肿瘤多已较大, 进展快, 且多为单侧发病, 有腹痛、包块等, 约10%的患者出现由肿瘤扭转、出血或破裂所致的急腹症[1]。腹胀、发热和阴道流血等较少见[4]。肿瘤细胞可产生激素, 引起内分泌症状, 如月经不规律及性早熟等。部分肿瘤伴血浆肿瘤标记物水平升高, 因此, 发现女性盆腔包块时需检测肿瘤标记物水平。肿瘤标记物异常取决于肿瘤组成成分, AFP水平升高提示含有卵黄囊瘤成分, hCG水平升高提示含绒毛膜癌成分[5]。
3.1 卵巢无性细胞瘤卵巢无性细胞瘤是最常见的恶性生殖细胞肿瘤, 约占恶性生殖细胞肿瘤的32.8%~37.5%, 占原发卵巢肿瘤的1%~2%[6], 多见于青春期和成年期初期, 临床多表现为腹痛、腹胀和月经紊乱。成分单一的无性细胞瘤不分泌激素, 5%的无性细胞瘤含合胞体滋养层, 可分泌hCG[6]。血浆乳酸脱氢酶和碱性磷酸酶多非特异性升高。肿瘤平均直径15 cm, 边界较清楚。除少数患者外, 无性细胞瘤均为纯实性肿块, 边缘分叶, 内部纤维血管隔将肿瘤分隔成不同的小叶, 肿瘤内部可见出血、坏死及斑点状钙化。纤维血管隔病理为纤维结缔组织及明显血管, T2WI呈等或低信号, 增强扫描纤维血管隔强化, 诊断卵巢无性细胞瘤具有特征性[7]。46-XY单纯性腺发育不全综合征患者无性细胞瘤发病率增加[8]。本研究中1例17岁患者, 染色体核型为(46, XY), 未见月经来潮, 外阴发育未见异常, CT示子宫发育小, 右侧卵巢未见显示, 左侧卵巢软组织肿块, 边缘分叶, 增强扫描强化较明显, 为无性细胞瘤。
3.2 未成熟畸胎瘤该病发病率居卵巢恶性生殖细胞肿瘤的第2位(35.6%~36.2%), 峰值发病年龄15~19岁, 很少发生在绝经后[6]。大多含卵黄囊瘤成分的未成熟畸胎瘤AFP水平明显升高, 不含卵黄囊瘤成分的未成熟畸胎瘤AFP水平略高。肿瘤直径14~25 cm[6]。CT示实性为主肿块, 多有包膜, 内部出血、坏死较常见, 内见脂肪、不规则钙化及大小不等的囊, 脂肪及钙化灶小而不规则, 散布于肿瘤内。需与成熟畸胎瘤鉴别, 后者肿瘤内脂肪组织呈大块状, 钙化粗大, 如“牙齿样”, 位于囊壁或壁结节处[9]。本研究中1例22岁患者计算力下降, 行为异常, 抗NMDAR抗体阳性, 临床诊断为畸胎瘤相关性副肿瘤边缘叶脑炎, 盆腔内见软组织肿块, 内见细小脂肪和钙化灶, 为典型未成熟畸胎瘤, 但颅脑MRI未见阳性发现。
3.3 卵黄囊瘤该病多见于10~30岁女性, 40岁以上少见, 占盆腔恶性生殖细胞肿瘤的14.5%~16.0%, 占卵巢恶性肿瘤的1%, 在卵巢恶性生殖细胞肿瘤中占第3位, 少于5%的患者双侧发病, 约10%的患者对侧卵巢见皮样囊肿; 所有含卵黄囊瘤成分的肿瘤AFP水平升高; 肿瘤平均直径15 cm[10]。发生在卵巢的卵黄囊瘤CT多呈单侧囊实性肿块, 外缘光滑, 囊大小从数毫米到2 cm, 弥散分布于肿瘤内部, 呈“蜂窝样”; 内部可见出血、坏死。卵黄囊瘤血供丰富, 增强扫描常见“亮点征”, 表现为囊壁或实性部分强化的结节, 主要为扩张的小血管或小血管的动脉瘤。但“亮点征”并非卵黄囊瘤的特异表现, 其他生殖细胞肿瘤也可出现[11]。肿瘤生长快, 囊壁可发生破裂, 但该征象也可见于成熟囊性畸胎瘤, 需综合分析影像表现。本组3例卵巢外卵黄囊瘤均见于婴幼儿, 肿瘤为实性或以实性为主, 增强扫描明显强化。
3.4 混合性生殖细胞肿瘤包含1种以上生殖细胞成分, 主要成分为无性细胞瘤、成熟畸胎瘤和卵黄囊瘤, 其他成分也可出现[1]。影像表现取决于其主要成分。本组3例混合性生殖细胞肿瘤分别为卵黄囊瘤与成熟畸胎瘤混合2例、胚胎性癌与卵黄囊瘤混合1例; 前2例卵黄囊瘤成分所占比例分别为50%、95%, 可见卵黄囊瘤和成熟畸胎瘤的典型表现; 后者表现为实性为主肿块, 明显强化。
3.4 卵巢甲状腺肿指肿瘤完全或主要由甲状腺组织组成, 5%~10%为恶性, 通常无转移或其他恶性征象。约5%的患者可出现甲状腺亢进。CT平扫为多房囊性肿块, 边缘光滑, 内部可见钙化, 实性部分为高密度, 增强扫描明显强化[12]。本研究中1例卵巢甲状腺肿增殖活跃, 1例合并局部类癌, 影像表现非特异, 诊断依赖于组织病理学。原发性卵巢类癌是单胚层畸胎瘤, 占所有类癌的0.5%和卵巢恶性肿瘤的0.1%;多为单侧发病, 大小自数毫米至20 cm。CT表现为多房囊性肿块, 有实性成分, 增强扫描可见强化, 呈“海绵样”[13]。本研究中1例卵巢类癌以实性成分为主, 明显强化。胚胎性癌能产生AFP和hCG。肿瘤体积较大, 平均直径17 cm。外缘光滑, 实性为主, 内部可见出血、坏死。
综上所述, 女性盆腔恶性生殖细胞肿瘤多见于儿童和青少年, 多数肿瘤体积较大。无性细胞瘤CT多表现为实性肿块, 边缘分叶, 纤维血管隔多见, 明显强化。未成熟畸胎瘤为实性肿块, 内见散在灶性脂肪和钙化。卵黄囊瘤为囊实混合性肿块, 常见“亮点征”。非卵巢恶性生殖细胞肿瘤以实性为主, 明显强化。其他恶性生殖细胞肿瘤CT表现无特异性, 诊断依靠组织病理学。盆腔恶性生殖细胞肿瘤CT表现复杂, 结合患者年龄和肿瘤标记物有助于提高诊断水平。
| [1] |
Talerman A, Vang R. Germ Cell Tumors of the Ovary[M]//Kurman RJ. Blaustein's pathology of the female genital tract. 6th edition, New York: Springer, 2011: 847-907.
|
| [2] |
Quirk JT, Natarajan N. Ovarian cancer incidence in the United States:1992-1999[J]. Gynecol Oncol, 2005, 97: 519-523. DOI:10.1016/j.ygyno.2005.02.007 |
| [3] |
Smith HO, Berwick M, Verschraegen CF, et al. Incidence and survival rates for female malignant germ cell tumors[J]. Obstet Gynecol, 2006, 107: 1075-1085. DOI:10.1097/01.AOG.0000216004.22588.ce |
| [4] |
Norris HJ, Jensen RD. Relative frequency of ovarian neoplasms in children and adolescents[J]. Cancer, 1972, 30: 713-719. DOI:10.1002/(ISSN)1097-0142 |
| [5] |
Heifetz SA, Cushing B, Giller R, et al. Immature teratomas in children:pathologic considerations——a report from the combined Pediatric Oncology Group/Children's Cancer Group[J]. Am J Surg Pathol, 1998, 22: 1115-1124. DOI:10.1097/00000478-199809000-00011 |
| [6] |
Pauniaho SL, Salonen J, Helminen M, et al. The incidences of malignant gonadal and extragonadal germ cell tumors in males and females:a population-based study covering over 40 years in Finland[J]. Cancer Causes Control, 2012, 23: 1921-1927. DOI:10.1007/s10552-012-0069-9 |
| [7] |
郑力文, 邓先琴, 郭裕华, 等. 卵巢单纯型无性细胞瘤的影像学表现[J]. 中国CT和MRI杂志, 2018, 16(2): 26-30. DOI:10.3969/j.issn.1672-5131.2018.02.009 |
| [8] |
Capito C, Arnaud A, Hameury F, et al. Dysgerminoma and gonadal dysgenesis:the need for a new diagnosis tree for suspected ovarian tumours[J]. J Pediatr Urol, 2011, 7: 367-372. DOI:10.1016/j.jpurol.2011.02.021 |
| [9] |
Yamaoka T, Togashi K, Koyama T, et al. Immature teratoma of the ovary:correlation of MR imaging and pathologic findings[J]. Eur Radiol, 2003, 13: 313-319. |
| [10] |
Kurman RJ, Norris HJ. Endodermal sinus tumor of the ovary:a clinical and pathologic analysis of 71 cases[J]. Cancer, 1976, 38: 2404-2419. DOI:10.1002/(ISSN)1097-0142 |
| [11] |
McCarthy S, Schwartz PE. CT scan detects linear tear in ovari an yolk sac tumor[J]. Eur J Radiol Extra, 2010, 73: 73-75. DOI:10.1016/j.ejrex.2009.10.003 |
| [12] |
Shen J, Xia X, Lin Y, et al. Diagnosis of Struma ovarii with me dical imaging[J]. Abdom Imaging, 2011, 36: 627-631. DOI:10.1007/s00261-010-9664-y |
| [13] |
Takeuchi M, Matsuzaki K, Uehara H. Primary carcinoid tumor of the ovary:MR imaging characteristics with pathologic correl ation[J]. Magn Reson Med Sci, 2011, 10: 205-209. DOI:10.2463/mrms.10.205 |
 2019, Vol. 17
2019, Vol. 17


