| 胰腺导管内乳头状黏液性肿瘤术前恶性风险列线图预测模型的建立 |
2. 南京大学医学院附属鼓楼医院胆胰外科,江苏 南京 210000
胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)起源于主胰管或分支胰管,是一种伴黏液分泌并具有恶性潜能的囊性病变,约占胰腺囊性肿瘤的20%[1-3]。近年来,随着体检的普及和影像技术的发展,IPMN的检出率不断提高[4-5]。IPMN可根据病灶与胰管之间的关系分为3型:主胰管型、分支胰管型和混合型。研究表明,分支胰管型的恶变率较高,而主胰管型和混合型的恶变率相对较低,判断其恶性转化风险是手术与否的决定性因素[6-8]。虽然IPMN整体进展缓慢,部分患者可长期随访,但仍有约70.6%和13.9%的患者在5年内会出现疾病进展或恶变倾向需手术治疗[9]。目前对于IPMN的生物学行为、手术指征及术后管理仍存在认识不足及争议,易导致过度治疗或治疗不及时,因此尽早识别IPMN恶变有助于临床决策及改善患者预后。笔者从临床影像资料入手,结合术后病理,探讨IPMN恶变的高危因素,建立Logistic回归预测模型并绘制列线图,旨在为术前临床决策提供参考。
1 资料与方法 1.1 一般资料回顾性分析我院收治的经术后病理证实的72例IPMN患者的临床及影像学资料,其中男60例,女12例;年龄50~87岁,平均(65.8±8.3)岁。纳入标准:①初诊患者术后病理证实为IPMN并有明确的组织学分级;②具有完整的临床及影像学资料,包括现病史、既往史、实验室检查、影像学检查、术后病理切片结果等。排除标准:①影像学检查与手术间隔时间 > 2周;②既往有胰腺相关手术史;③有恶性肿瘤病史、放化疗史。
根据术后病理结果,将72例分为良性组49例(68.1%)和恶性组23例(31.9%)。良性IPMN为低级别异型增生49例(68.1%),恶性IPMN为高度异型增生7例(9.7%)或伴浸润性癌16例(22.2%)。
1.2 仪器与方法所有患者均行CT检查,60例行MRI检查。CT检查为平扫加胰腺动态增强扫描,采用GE Lightspeed 64排螺旋CT扫描仪。检查前禁食8 h,患者取仰卧位,扫描范围从膈肌顶部至双肾下极。扫描参数:120 kV,200~250 mAs,层厚5 mm,层距5 mm。平扫后,经肘正中静脉注射对比剂(欧乃派克),剂量1.5 mL/kg体质量,流率3.5 mL/s,间隔30、60、180 s行动脉期、静脉期及延迟期3期动态增强扫描。
MRI检查包括平扫和MRCP,使用Philips Ingenia 3.0 T MRI扫描仪,32通道dStream体线圈。扫描范围从右侧膈肌至肾门水平。扫描序列及参数:T1WI 3D涡轮场回波(TFE)序列和多回波Dixon脂肪-水分离技术,TR 3.7 ms,TE 1.32 ms、2.4 ms,矩阵268×236,层厚5 mm,重建层厚2.5 mm,视野400 mm×352 mm,翻转角10°,激励次数1。扫描完成后,将数据传至图像处理工作站,进行图像后处理。
1.3 图像分析由2位具有5年以上腹部影像诊断经验的影像科医师回顾性判读影像学资料,主要记录肿瘤最大径、胰管扩张、增强壁结节、多灶性、IPMN分型情况等。其中多灶者肿瘤最大径为多个直径累计之和;胰管扩张为主胰管直径于胰头部≥5 mm,胰体部≥4 mm,胰尾部≥3 mm;增强壁结节为CT增强扫描时最大径 > 5 mm的胰管附壁结节。当判读结果不一致时,经讨论达成一致。
1.4 统计学方法采用SPSS 22.0软件进行统计学分析。分类变量采用例(%)描述,连续变量采用M(QR)描述。NLR、LMR、PLR的最佳临界值通过绘制ROC曲线,在约登指数最大时取得。将肿瘤良恶性作为因变量,对临床与影像指标行单因素分析,分类变量2组间比较行χ2检验或Fisher确切概率法检验,连续变量2组间比较行Mann-Whitney U检验。以P<0.05为差异有统计学意义。将差异有统计学意义的因素行Logistic多因素回归分析发现IPMN恶变的独立危险因素,并建立IPMN恶性风险预测模型,绘制ROC曲线,计算AUC值以评估模型的预测效能。
采用R语言软件(版本号4.1.2)构建列线图并对其进行评估。依据Logistic回归结果评估IPMN恶变的独立危险因素,建立列线图,整合后的各预测指标转化为0~100分刻度值表示,100分表示该预测指标的危险性最高。使用Hosmer-Lemeshow拟合优度检验分析模型的预测值与实测值之间是否存在差异,并绘制校正曲线评估模型的校准度。
2 结果 2.1 临床与影像特征72例中,男60例,占83.3%。17例(23.6%)无明显临床症状,体检时偶然发现;51例(70.8%)首发症状为腹痛。47例(65.3%)肿瘤原发于胰头钩突,41例(56.9%)采用胰十二指肠切除术。20例(27.8%)CA19-9升高,2例(2.8%)癌胚抗原(CEA)升高。术前中性粒细胞淋巴细胞比值(NLR)、淋巴细胞单核细胞比值(LMR)和血小板淋巴细胞比值(PLR)的中位数分别为1.70、4.52和109.9。
术前CT和MRI检查提示,主胰管型占比最高(43.0%,31/72),其次为分支胰管型(38.9%,28/72)(图 1)和混合型(18.1%,13/72)(图 2)。肿瘤最大径中位数为25 mm,胰管扩张31例(43.1%),多灶性7例(9.7%),15例(20.8%)增强扫描示壁结节 > 5 mm。
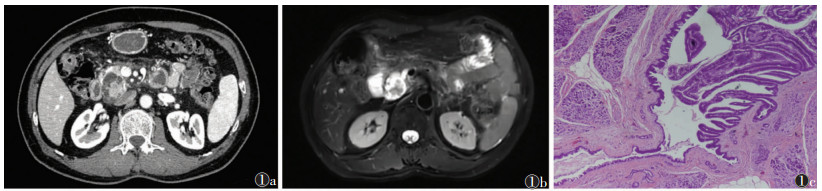 |
| 图 1 男,69岁,分支胰管型胰腺导管内乳头状黏液性肿瘤(IPMN),术后病理证实为IPMN伴腺上皮重度异型增生,局部见微小间质浸润 图 1a CT增强扫描轴位示胰头钩突部囊实性病灶 图 1b MRI轴位T2WI示胰头混杂信号影,与胰管相通 图 1c 病理图像示肿瘤性腺管组织与主胰管相通(HE,低倍放大) |
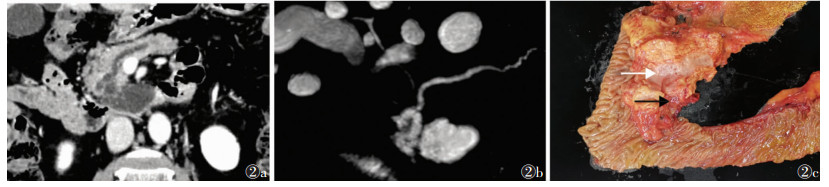 |
| 图 2 女,71岁,混合型IPMN,术后病理证实为IPMN伴低度异型增生 图 2a CT增强扫描冠状位示胰头钩突部囊性病灶,主胰管扩张 图 2b MRCP示病灶与主胰管相通 图 2c 术后大体标本示胰头部扩张的胰管(白箭)和病灶(黑箭) |
2.2 IPMN恶性风险的单因素分析(表 1)
| 表 1 IPMN恶性风险的单因素分析 |
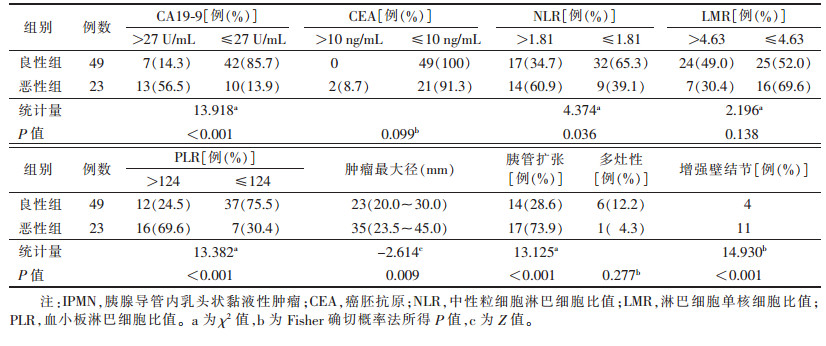 |
分别以NLR、LMR和PLR作为检验变量,以良恶性作为状态变量绘制ROC曲线,约登指数取最大,最终得到NLR的最佳临界值为1.81,此时AUC为0.657,对应的特异度和敏感度为67.35%和60.87%;LMR的最佳临界值为4.63,此时AUC为0.579,对应的特异度和敏感度为48.98%和69.57%;PLR的最佳临界值为124,此时AUC为0.752,对应的特异度和敏感度为69.57%和75.51%。通过单因素分析发现,CA19-9 > 27 U/mL、NLR > 1.81、PLR > 124、肿瘤最大径、胰管扩张及增强壁结节与恶性IPMN的发生均显著相关(均P<0.05)。此外,良恶性IPMN在CEA、LMR、多灶性方面的差异均无统计学意义(均P > 0.05)。
2.3 IPMN恶性风险的多因素分析(表 2)| 表 2 IPMN恶性风险的多因素分析 |
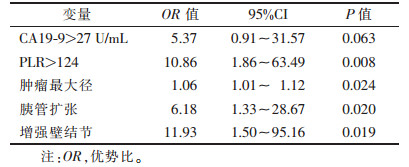 |
将单因素分析筛选出的因素纳入二元Logistic回归分析,最终确定CA19-9 > 27 U/mL、PLR > 124、肿瘤最大径、胰管扩张和增强壁结节是恶性IPMN发生的独立危险因素(均P<0.05)。
2.4 ROC曲线分析及列线图的建立与评估将5个独立预测因子及模型预测值作为检验变量,IPMN的良恶性病理结果作为状态变量绘制ROC曲线(图 3)。该预测模型的AUC值为0.928,敏感度100.00%,特异度79.59%。基于CA19-9、PLR、肿瘤最大径、胰管扩张和增强壁结节5个特征构建列线图预测IPMN的恶性风险(图 4)。在该列线图中,肿瘤最大径是预测IPMN恶变的最大贡献因子(100分),其次为增强壁结节(50分)、PLR(49分)、胰管扩张(37分)和CA19-9(34分),总分0~240分,预测概率为0.1~0.9。根据Hosmer-Lemeshow检验结果,该模型具有较好的拟合度(χ2=5.816,P=0.668),绘制校正曲线发现,预测模型的模型预测值与实际观测值一致性好,具有较高的预测效能(图 5)。
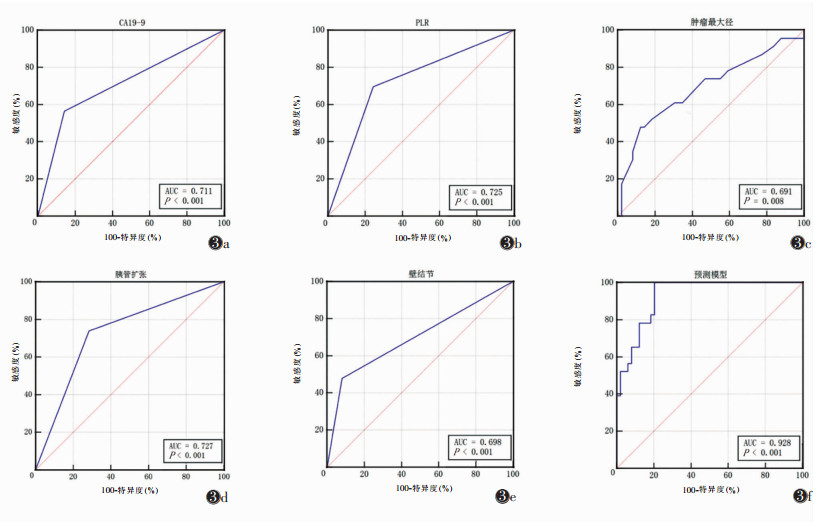 |
| 图 3 IPMN恶性风险因素及预测模型的ROC曲线 图 3a~3e 分别为CA19-9、血小板淋巴细胞比值(PLR)、肿瘤最大径、胰管扩张、增强壁结节的ROC曲线 图 3f IPMN恶性风险预测模型的ROC曲线 |
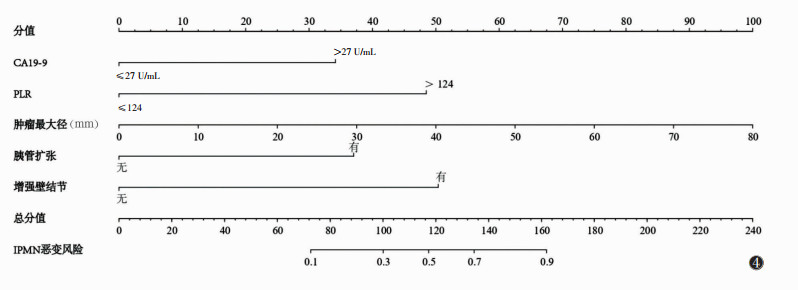 |
| 图 4 IPMN恶性风险预测模型的列线图 |
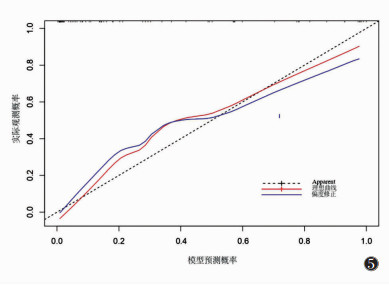 |
| 图 5 IPMN恶性风险列线图预测模型的校正曲线 |
3 讨论
由于IPMN发病率逐年上升且具有潜在的恶变风险,仅靠单一的临床指标或医师的临床经验术前很难判断其恶性风险,亟需一种在术前准确判断其恶性风险的方法,以评估手术风险和患者治疗收益。
血清CA19-9作为一种肿瘤相关的糖蛋白,在胰腺癌的诊疗及随访中起着重要作用,而近期越来越多的证据表明,CA19-9水平在鉴别胰腺囊性肿瘤的良恶性方面也发挥了重要作用[10]。Fritz等[11]的研究提示,非侵袭性及侵袭性IPMN血清CA19-9/CEA水平升高的比例分别为18%和80%,且CA19-9/CEA水平升高与侵袭性IPMN的淋巴结转移显著相关。本研究显示,术前27.8%(20/72)的患者CA19-9升高;单因素分析发现,CA19-9升高与IPMN恶变显著相关并纳入最终的恶性风险预测模型,这也与IPMN的欧洲临床指南[12]意见一致。而2组CEA水平差异无统计学意义(P > 0.05)。
有证据表明,炎症在肿瘤微环境中可促进肿瘤生长,炎症反应被认为是肿瘤进展的重要组成部分[13]。胰腺癌发生的风险或进展也与炎症及炎性环境密切相关[14]。一些基于血液循环的炎症指标(NLR、LMR、PLR)可便捷地反映全身性炎症状态。最近有研究显示,炎性指标在预测胰腺囊性肿瘤良恶性方面也具有重要作用[15]。本研究对NLR、PLR、LMR行单因素分析发现,NLR、PLR与恶性程度显著相关,NLR、LMR、PLR的最佳临界值通过绘制ROC曲线,在约登指数最大时取得,NLR、PLR的最佳临界值分别为1.81、124,与既往研究[16]大致相符。通过Logistic回归分析确定PLR > 124为恶性IPMN的独立危险因素。
目前,关于IPMN的临床指南有日本的福冈指南[17]、欧洲指南[12]、美国指南[4],但在应用中均存在指标难评估、不够客观等实际问题,且准确率欠佳:①增强壁结节。各指南均认为最大径 > 5 mm的增强壁结节为手术的绝对适应证,本研究也发现增强壁结节是IPMN恶变的高危因素,并将其纳入了最终术前恶性风险的预测模型中。②胰管扩张。福冈指南认为主胰管 > 10 mm为IPMN恶变的高危因素;欧洲指南认为的主胰管扩张 > 5 mm需行手术切除;本研究对胰管扩张的定义更细致,对主胰管的胰头、胰体、胰尾分别定义(胰头部≥5 mm,胰体部≥4 mm,胰尾部≥3 mm)并纳入最终模型。③肿瘤大小。福冈指南认为肿瘤 > 3 cm是“令人担忧的”特征之一;美国指南和欧洲指南分别认为肿瘤 > 3 cm、> 4 cm与癌变风险增加有关;本研究将该特征采取连续变量的形式,最终纳入预测模型,其在模型的贡献程度最高。
列线图又称诺模图,是建立在Logistic多元回归模型的基础上,根据回归模型中各个影响因素对结局变量的贡献程度将各个独立危险因素对模型预测值的贡献值可视化[18]。本研究确定CA19-9 > 27 U/mL、PLR > 124、肿瘤最大径、胰管扩张及增强壁结节5个特征作为预测IPMN恶性风险的独立危险因素并构建了列线图预测模型,按比例绘制具有刻度表示的计算图表,通过评估显示该预测模型具有较高的区分度和准确性,为临床决策提供了方便快捷的可视化途径。
本研究存在的局限性:为单中心回顾性分析,仅纳入术后病理明确诊断为IPMN的患者,可能存在一定的选择偏倚;由于纳入的样本量有限,预测模型效能的验证仍需进一步扩充样本量。总之,对于临床医师而言,应在术前综合分析恶性风险因素,准确评估手术或保守治疗方式能否为IPMN患者带来最大收益。
| [1] |
TOBALY D, SANTINHA J, SARTORIS R, et al. CT-based radiomics analysis to predict malignancy in patients with intraductal papillary mucinous neoplasm (IPMN) of the pancreas[J]. Cancers (Basel), 2020, 12(11): 3089. DOI:10.3390/cancers12113089 |
| [2] |
FERNANDEZ-CASTANER E, VILA-CASADESUS M, VILA-NAVARRO E, et al. MicroRNAs deregulated in intraductal papillary mucinous neoplasm converge on actin cytoskeleton-related pathways that are maintained in pancreatic ductal adenocarcinoma[J]. Cancers (Basel), 2021, 13(10): 2369. DOI:10.3390/cancers13102369 |
| [3] |
孙勤学, 陈振东, 赵亦军, 等. 胰腺导管内乳头状黏液性肿瘤恶变的影像表现[J]. 临床放射学杂志, 2020, 39(1): 81-85. |
| [4] |
VEGE S S, ZIRING B, JAIN R, et al. American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts[J]. Gastroenterology, 2015, 148(4): 819-822. DOI:10.1053/j.gastro.2015.01.015 |
| [5] |
ELTA G H, ENESTVEDT B K, SAUER B G, et al. ACG clinical guideline: diagnosis and management of pancreatic cysts[J]. Am J Gastroenterol, 2018, 113(4): 464-479. DOI:10.1038/ajg.2018.14 |
| [6] |
FONG Z V, FERRONE C R, LILLEMOE K D, et al. Intraductal papillary mucinous neoplasm of the pancreas: current state of the art and ongoing controversies[J]. Ann Surg, 2016, 263(5): 908-917. DOI:10.1097/SLA.0000000000001567 |
| [7] |
SALVIA R, FERNANDEZ-DEL CASTILLO C, BASSI C, et al. Main-duct intraductal papillary mucinous neoplasms of the pancreas: clinical predictors of malignancy and long-term survival following resection[J]. Ann Surg, 2004, 239(5): 678-685. DOI:10.1097/01.sla.0000124386.54496.15 |
| [8] |
SALVIA R, CRIPPA S, FALCONI M, et al. Branch-duct intraductal papillary mucinous neoplasms of the pancreas: to operate or not to operate?[J]. Gut, 2007, 56(8): 1086-1090. DOI:10.1136/gut.2006.100628 |
| [9] |
DEL CHIARO M, ATEEB Z, HANSSON M R, et al. Survival analysis and risk for progression of intraductal papillary mucinous neoplasia of the pancreas (IPMN) under surveillance: a single-institution experience[J]. Ann Surg Oncol, 2017, 24(4): 1120-1126. DOI:10.1245/s10434-016-5661-x |
| [10] |
梁廷波, 白雪莉, 马涛. 胰腺囊性肿瘤诊治的困惑与对策[J]. 中国实用外科杂志, 2018, 38(1): 48-52. |
| [11] |
FRITZ S, HACKERT T, HINZ U, et al. Role of serum carbohydrate antigen 19-9 and carcinoembryonic antigen in distinguishing between benign and invasive intraductal papillary mucinous neoplasm of the pancreas[J]. Br J Surg, 2011, 98(1): 104-110. |
| [12] |
关富, 胡菊香, 汪福群, 等. 《2018年欧洲循证指南: 胰腺囊性肿瘤》摘译[J]. 临床肝胆病杂志, 2018, 34(6): 1193-1197. DOI:10.3969/j.issn.1001-5256.2018.06.013 |
| [13] |
LIU L, LI W, LI Z, et al. Sublytic complement protects prostate cancer cells from tumour necrosis factor-alpha-induced cell death[J]. Clin Exp Immunol, 2012, 169(2): 100-108. DOI:10.1111/j.1365-2249.2012.04596.x |
| [14] |
BABIC A, SCHNURE N, NEUPANE N P, et al. Plasma inflammatory cytokines and survival of pancreatic cancer patients[J]. Clin Transl Gastroenterol, 2018, 9(4): 145. DOI:10.1038/s41424-018-0008-5 |
| [15] |
GOH B K, TAN D M, CHAN C Y, et al. Are preoperative blood neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios useful in predicting malignancy in surgically-treated mucin-producing pancreatic cystic neoplasms?[J]. J Surg Oncol, 2015, 112(4): 366-371. DOI:10.1002/jso.23997 |
| [16] |
ZHOU W, RONG Y, KUANG T, et al. The value of systemic inflammatory markers in identifying malignancy in mucinous pancreatic cystic neoplasms[J]. Oncotarget, 2017, 8(70): 115561-115569. |
| [17] |
TANAKA M, FERNANDEZ-DEL CASTILLO C, KAMISAWA T, et al. Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas[J]. Pancreatology, 2017, 17(5): 738-753. |
| [18] |
韩云, 张东友. 浸润性乳腺癌淋巴管侵犯的诺模图预测模型的建立[J]. 中国中西医结合影像学杂志, 2020, 18(4): 369-373. |
 2022, Vol. 20
2022, Vol. 20


