| 原发性肺浸润性黏液腺癌的CT征象与临床病理表现分析 |
2. 山东第一医科大学附属省立医院/山东省立医院医学影像科, 山东 济南 250021;
3. 山东中医药大学附属医院放射科, 山东 济南 250014;
4. 山东第一医科大学附属肿瘤医院/山东省肿瘤医院/山东省肿瘤防治研究院影像科, 山东 济南 250117;
5. 青岛大学附属医院放射科, 山东 青岛 266000;
6. 山东大学齐鲁医院放射科, 山东 济南 250012
原发性肺浸润性黏液腺癌(pulmonary invasive mucinous adenocarcinoma,PIMA)是非小细胞肺癌(non-small cell lung cancer,NSCLC)中腺癌的一种少见特殊亚型[1],按CT图像中的形态学表现可将其分为结节肿块型与肺炎型[2]。PIMA是一种侵袭性较低的恶性肿瘤,其生物学行为、预后、治疗方案与肺非黏液腺癌截然不同[3]。手术切除是PIMA最重要的治疗方法之一,但由于其发病率仅为肺腺癌的5%[4],且症状、体征、CT征象缺乏特异性,与肺炎、肺淋巴瘤等肺部良恶性病变难以鉴别,易误诊,常导致患者预后不佳。因此,本研究旨在探讨PIMA的CT征象及其临床病理特征,为临床诊疗提供影像学依据,加深对PIMA的认识,提高诊断准确率。
1 资料与方法 1.1 一般资料回顾性收集2018年1月至2022年2月在山东省立医院、山东大学齐鲁医院、山东中医药大学附属医院、山东省肿瘤医院、青岛大学附属医院行CT检查并经穿刺活检或手术病理证实的PIMA患者300例,其中结节肿块型194例(结节肿块型组),男75例,女119例,年龄27~77岁,平均(58.32±9.04)岁,咯血8例,胸痛12例,体质量下降10例,有吸烟史48例,有肿瘤家族史31例,白细胞计数异常37例,C反应蛋白水平异常42例;肺炎型106例(肺炎型组),男47例,女59例,年龄28~72岁,平均(62.27±10.58)岁,咯血7例,胸痛10例,体质量下降12例,有吸烟史33例,有肿瘤家族史15例,白细胞计数异常23例,C反应蛋白水平异常31例。
纳入标准:①CT图像与临床病理资料完整;②经穿刺活检或手术病理证实为肺浸润性黏液腺癌;③CT检查前未经放疗、化疗、手术等治疗。排除标准:①有肺部或其他恶性肿瘤病史;②CT图像质量欠佳。
1.2 仪器与方法采用Siemens Somatom Force、Siemens Somatom Definition AS、GE Optima CT670和Philips Brilliance iCT行胸部CT扫描。患者行呼吸训练后,取仰卧位,双臂上举,头先进,于吸气末屏气后扫描。扫描范围自肺尖至膈下水平。扫描参数:120 kV,250~400 mA(自动管电流调整技术),层厚、层距均为5 mm,螺距0.8~1.0 mm,矩阵512×512,并行层厚、层距均为1.0 mm的薄层重建。增强扫描采用高压注射器经肘前静脉注射非离子型碘对比剂碘海醇,剂量1.5~2 mL/kg体质量,流率3.0~3.5 mL/s,分别延迟20~25 s、50~60 s行动脉期及静脉期扫描。
1.3 图像分析由2名具有10年以上工作经验的胸部影像诊断医师独立阅片,意见不一致时,经协商后达成一致或由另一位高年资胸部影像诊断医师会诊后判定。依据病变的CT形态学表现,将其分为结节肿块型与肺炎型2种类型:肺炎型CT表现为无定型的局限或弥漫分布的大片状或斑片状实变;结节肿块型表现为具有一定形状的单发或多发结节或肿块样改变[5]。
观察分析的CT征象包含:最大径,在CT肺窗图像上(窗宽1 500 HU,窗位-400 HU)测量主病灶最长径线;病灶分布;分叶征;毛刺征;含气腔隙(有记录为1,无记录为0);空气支气管征[6];肿瘤边界;胸膜牵拉;磨玻璃征;叶间裂膨隆;卫星灶;淋巴结肿大;胸膜相贴;胸腔积液;胸膜增厚。CT增强扫描征象包括血管造影征;无强化低密度区;以及强化程度。CT平扫与增强扫描图像均于轴位纵隔窗(窗宽400 HU,窗位40 HU)选取病灶最大层面的实性成分,并测量3个大小相同的ROI,至少包含该层面实性成分的3/4且避开空洞、支气管、钙化、坏死囊变区及血管,重复测量3次后取平均值。强化程度定义:轻度强化,CT净增值<20 HU;中度强化,20 HU≤CT净增值<40 HU;明显强化,CT净增值≥40 HU[7]。
1.4 统计学方法采用SPSS 26.0统计软件对数据进行分析。定量资料采用Shapiro-Wilk(S-W)检验行正态性分布检验,符合正态分布者以x±s表示,2组间比较行独立样本t检验;不符合正态分布者以M(QL,QU)表示,2组间比较行Mann-Whitney U检验。分类资料的比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果 2.1 2组临床特征比较2组性别、年龄、咯血、胸痛、体质量下降、吸烟史、白细胞水平、C反应蛋白水平、肿瘤家族史比较,差异均无统计学意义(均P > 0.05)。肺炎型组咳嗽、咳痰、发热症状分别占比73.58%(78/106)、66.98%(71/106)、13.21%(14/106),结节肿块型组分别占比28.35%(55/194)、21.13%(41/194)、1.03%(2/194),肺炎型组均高于结节肿块型组,差异均有统计学意义(χ2=56.833,61.585,20.130;均P<0.001)。
2.2 2组CT平扫征象比较300例中,198例主病灶位于双肺下叶,102例位于其他各肺叶;中央型9例,周围型291例。肺炎型组病灶呈多肺叶分布占比高于结节肿块型组,差异有统计学意义(P<0.001)。肺炎型组肿瘤最大径大于结节肿块型组,差异有统计学意义(P<0.001)。肺炎型组边界模糊、含气腔隙、磨玻璃征、叶间裂膨隆、卫星灶、淋巴结肿大、胸膜相贴、胸腔积液、胸膜增厚占比均高于结节肿块型组,肺炎差异均有统计学意义(均P<0.05)。肺炎型组空气支气管征出现率较结节肿块型组高,且差异有统计学意义(P<0.001)。2组毛刺征、胸膜牵拉比较,差异均无统计学意义(均P > 0.05)(表 1,图 1)。
| 表 1 2组CT平扫征象比较 |
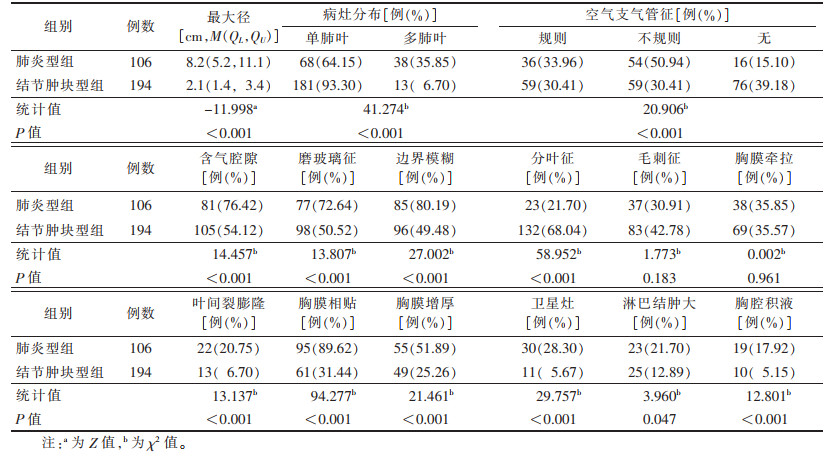 |
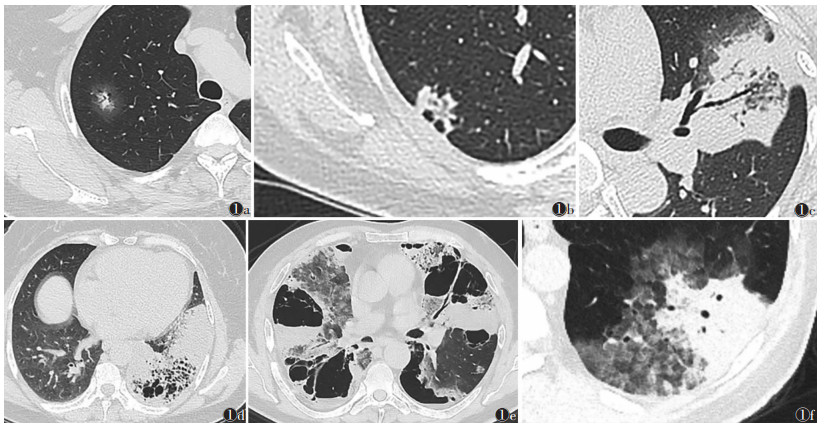 |
| 注:图 1a为孤立性结节灶,内见空泡征及规则的空气支气管征,周边见磨玻璃征,边界模糊;图 1b为右肺下叶胸膜下结节灶,局部与胸膜相贴,边缘见空泡;图 1c为左肺上叶肺炎型PIMA,内见枯枝征及多发空泡,局部见叶间胸膜膨隆,边界模糊;图 1d为左肺下叶肺炎型病灶,内见蜂窝征;图 1e为肺炎型PIMA肺内广泛播散,病灶局部见假空洞、水田样磨玻璃征及卫星灶;图 1f为左肺下叶肺炎型病灶,可见水田样磨玻璃征 图 1 原发性肺浸润性黏液腺癌(PIMA)的CT平扫征象 |
2.3 2组CT增强扫描征象比较
肺炎型组中59例行CT增强扫描,结节肿块型组中150例行CT增强扫描。肺炎型组中无强化低密度区及血管造影征的出现率均高于结节肿块型组,差异均有统计学意义(均P<0.001)。2组强化程度比较,差异有统计学意义(P<0.05)(表 2,图 2)。
| 表 2 2组CT增强扫描征象比较 |
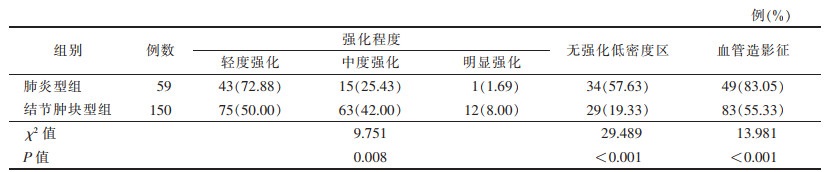 |
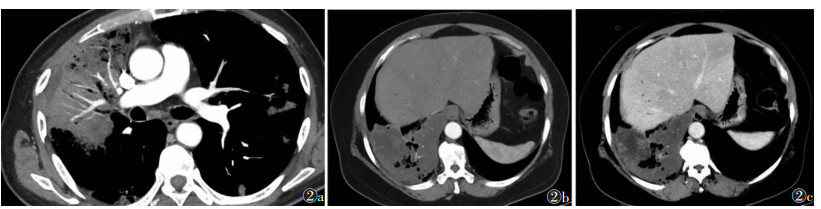 |
| 注:图 2a为MIP,示动脉期肺炎型病灶内明显强化肺血管分支走行,主干血管走行自然、规则,末端血管毛糙、破坏、中断;图 2b,2c分别为增强扫描动脉期、静脉期,示主病灶整体呈轻度强化,低密度富黏液区均未见强化,无强化低密度区边界欠清 图 2 原发性肺浸润性黏液腺癌(PIMA)的CT增强扫描征象 |
2.4 病理学表现
大体病理表现为灰白色或灰褐色肿物,质韧或质软,部分病灶局部表现为半透明灰黄胶冻样改变。镜下示杯状或柱状肿瘤细胞内及肺泡腔充满大量黏液,细胞核位于基底部,异型性较低,多沿支气管壁及肺泡壁呈附壁样生长(图 3)。
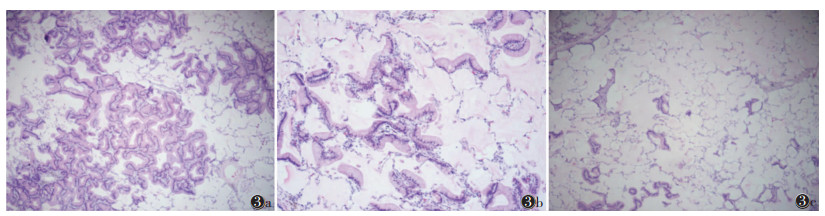 |
| 注:图 3a,3b示贴壁样生长方式为主的肿瘤细胞呈柱状、高柱状,胞质内充满黏液,细胞核被推挤至一侧,周围肺泡腔内可见黏液(图 3a为HE染色,低倍放大;图 3b为HE染色,高倍放大);图 3c主病灶轮廓外可见黏液与肿瘤细胞散在排布,提示气腔播散(HE染色,低倍放大) 图 3 原发性肺浸润性黏液腺癌(PIMA)的病理图像 |
3 讨论 3.1 概述
根据2021年WHO提出的肺癌新分类方法,将黏液腺癌分为浸润性黏液腺癌与微浸润性黏液腺癌[8],原发性肺黏液腺癌以浸润性黏液腺癌最多见,微浸润性黏液腺癌较少见[9]。
PIMA以中老年人高发,其发病率与吸烟史、性别无明显关联,早期常无明显症状,中晚期患者可出现咳嗽、咳痰、发热等非特异性症状[10]。本研究肺炎型组咳嗽、咳痰、发热的患者均多于结节肿块型组,差异有统计学意义,这可能是因为肺炎型组患者病灶较大,其内杯状、柱状肿瘤细胞数量较多,且分泌大量黏液,较结节肿块型组更易阻塞、侵犯支气管。
3.2 病理学表现PIMA起源于杯状或柱状上皮细胞,具有分泌黏液的功能,KRAS突变较多见,但EGFR突变阳性率较低,因此使用一线靶向治疗药物酪氨酸激酶抑制剂(TKIs)治疗往往效果较差[1-2, 11]。肉眼观察肿瘤呈灰白色半透明胶冻状改变,因黏液成分与实质成分混合,边界往往不清,病灶呈瘢痕样皱缩[12]。镜下观察,杯状、柱状肿瘤细胞多沿肺泡壁附壁样不规则排列,部分可见乳头、微乳头、腺泡等异质性结构存在,且肿瘤细胞异型性较小,核分裂象少见,侵袭力较低。癌细胞在细胞内、外可生成大量黏液,使胞质内细胞核受压推挤至基底部、肺泡腔扩大形成“黏液湖”,当黏液生成过多时,可沿肺泡间孔溢出而向远处扩散。既往文献报道,甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)在肺腺癌的表达中具有高敏感性和高特异性,而在黏液腺癌中表达低或无表达,这些患者多EGFR无突变,预后不佳[13-15]。本研究行免疫组化染色117例中TTF-1阴性或弱阳性表达者占比较高(63.25%)。
3.3 CT表现在CT图像上PIMA按形态可分为结节肿块型与肺炎型,以前者多见。本研究300例PIMA中,198例主病灶位于双肺下叶,提示PIMA多发生于双肺下叶,这与Koo等[16]的研究一致,可能是由于下叶体积大,且因重力作用的原因使得清除功能强于其他肺叶,因此受到的刺激也较多,更易诱导杯状、柱状细胞增生、化生而导致癌变。卫星灶与多肺叶分布多见于肺炎型,CT表现为主病灶边缘以外呈多中心分布的结节状、班片状病灶,常沿支气管血管束、小叶中心分布,提示肿瘤细胞由黏液裹挟经气道进行气腔播散;在同侧肺内,肿瘤细胞可沿无裂区进行跨叶播散,此类患者常预后较差[1, 17]。结节肿块型病灶多单叶分布,卫星灶相对少见。本研究中,肺炎型较结节肿块型的胸膜相贴、胸膜增厚的占比较高,且与胸膜多呈宽基底相连,表现为均匀性胸膜增厚,提示PIMA对胸膜无明显侵犯[18],对PIMA具有一定的诊断意义。
结节肿块型PIMA多表现为不规则、类圆形结节,可呈单纯实性结节(96/194,49.48%),亦可为磨玻璃结节(98/194,50.52%)。磨玻璃征表现为病灶内或周围出现磨玻璃样改变,本研究98例出现磨玻璃征的结节肿块型PIMA均为混合磨玻璃密度灶。结节肿块型PIMA边界可清晰(98/194,50.52%),亦可模糊(96/194,49.48%),病理学基础可能是由于病变早期黏液分泌少,黏液结合致密,故边界常清晰;后期由于黏液分布多且不均匀,边界常模糊[19]。结节肿块型PIMA的含气腔隙以空泡征多见,空洞及假空洞多见于较大的结节或肿块;空气支气管征走行多规则,走行不规则的空气支气管征存在于较大的实性结节、肿块中。结节肿块型PIMA的毛刺征、胸膜牵拉等收缩性征象较少见,因病灶往往缺乏中心纤维化区,周围结缔组织反应较少见。胸腔积液、淋巴结肿大、叶间裂膨隆在结节肿块型中少见。
本研究中肺炎型PIMA病灶CT表现为不规则斑片状实变灶,病灶内或周围多伴边缘模糊的磨玻璃征(72.64%,77/106)。肺炎型磨玻璃征密度多不均,次级肺小叶间密度有差异而同一次级肺小叶内密度相近,呈水田样改变;病理基础为大量扩散的黏液与癌细胞、巨噬细胞共存,这可能是由于小叶间隔的阻挡和不同含量黏液介导的对空气不同程度的阻隔作用所导致的。肺炎型PIMA的含气腔隙较结节肿块型更多见,部分患者呈蜂窝样改变;其病理学基础可能为癌细胞侵袭性较弱,向终末呼吸单位生长时由于其管壁缺少软骨,气体不断进入肺泡腔,肺泡壁破裂、扩张,以及癌细胞与其产生的黏液不完全阻塞管腔而形成活瓣。本研究中肺炎型PIMA的空气支气管征更多见(84.91%,90/106),且多表现为不规则的空气支气管征,又称枯树枝征;这是由终末呼吸单位较易被肿瘤细胞及其分泌的黏液阻塞、侵犯所致[20]。与叶间胸膜相贴的病灶可出现叶间裂膨隆,原因为黏液分泌较多时在重力作用下叶间胸膜弹力纤维松弛,叶间胸膜对黏液进行了阻挡。肺炎型病灶边缘多模糊(80.19%,85/106),病理基础为癌细胞分泌的大量黏液沿肺泡间孔不均匀扩散所致。肺炎型与结节肿块型的胸膜牵拉等收缩性征象占比较低,而肺炎型的胸腔积液、淋巴结肿大占比稍高于结节肿块型,与部分研究[21]相似。
本研究中CT增强扫描显示,肺炎型PIMA病灶内无强化低密度区及血管造影征较结节肿块型多见,且多呈轻中度强化;这是由于肺炎型较结节肿块型病灶大,黏液分泌多,使得病灶整体强化程度减低,低强化背景下肺血管显影更明显。肺炎型PIMA的末梢血管多被破坏,发生机制为肿瘤细胞侵袭性较低,主干血管不易被破坏,这对肺炎型PIMA具有一定的诊断意义[7]。
3.4 本研究的创新性与局限性PIMA发病率较低,目前国内外对该病的相关研究中纳入例数较少,且对其临床、病理及CT表现的综合性诊断缺乏全面认识。本研究纳入多家医院经病理学证实的300例PIMA患者,样本量较大,更具说服力。本研究存在的不足:为回顾性多中心研究,因各医疗机构CT扫描仪的图像采集及重建协议不同,CT扫描征象的记录存在差异;部分对胸膜和淋巴结是否有转移的判断仅限于对CT扫描征象的判读,缺乏病理诊断依据。
综上所述,PIMA的影像学表现具有一定的特征性。PIMA多位于双肺下叶胸膜下,增强扫描常呈轻中度强化,通常不发生胸膜侵犯,很少出现淋巴结与胸膜转移。结节肿块型具有肺腺癌的一般表现,如分叶征、空泡征、含气囊腔、空气支气管征等,但毛刺征及胸膜牵拉等收缩性征象占比较低,边界可清晰或模糊;肺炎型呈不规则斑片状实变灶,多伴边界模糊、水田样磨玻璃征、较大的含气腔隙、枯树枝征、与胸膜相贴、血管造影征、无强化低密度区等征象。当患者有以上影像学表现,且出现咳嗽、咳痰、发热等症状,在排除身体其他部位黏液腺癌病史后,应高度考虑PIMA的可能性。影像学表现有助于PIMA的早期识别,但最终确诊仍应结合病理学检查。
| [1] |
NICHOLSON A G, TSAO M S, BEASLEY M B, et al. The 2021 WHO classification of lung tumors: impact of advances since 2015[J]. J Thorac Oncol, 2022, 17(3): 362-387. DOI:10.1016/j.jtho.2021.11.003 |
| [2] |
聂凯. 原发性肺浸润性黏液腺癌CT征象及病理相关性研究[D]. 上海: 中国人民解放军海军军医大学, 2018.
|
| [3] |
王铮, 苏丹柯, 赖少侣, 等. 原发性肺黏液腺癌CT表现及病理基础[J]. 临床放射学杂志, 2018, 37(4): 608-611. DOI:10.13437/j.cnki.jcr.2018.04.014 |
| [4] |
SAITO T, TSUTA K, HONDA O, et al. Prognostic impact of mucin spread, tumor cell spread, and invasive size in invasive mucinous adenocarcinoma of the lung[J]. Lung Cancer, 2020, 146(1): 50-57. |
| [5] |
BECK K S, SUNG Y E, LEE K Y, et al. Invasive mucinous adenocarcinoma of the lung: serial CT findings, clinical features, and treatment and survival outcomes[J]. Thorac Cancer, 2020, 11(12): 3463-3472. DOI:10.1111/1759-7714.13674 |
| [6] |
张国祯, 郑向鹏, 李铭. 微小肺癌: 影像诊断与应对策略[M]. 北京: 人民军医出版社, 2015: 82-89.
|
| [7] |
王庆宜, 李万湖, 张德贤, 等. 原发性肺浸润型黏液腺癌影像学表现及病理特点[J]. 中华肿瘤防治杂志, 2020, 27(8): 647-652, 657. DOI:10.16073/j.cnki.cjcpt.2020.08.11 |
| [8] |
邬小凤, 刘俊, 朱亚西, 等. WHO(2021)胸部肿瘤分类[J]. 诊断病理学杂志, 2021, 28(8): 690-692. DOI:10.3969/j.issn.1007-8096.2021.08.021 |
| [9] |
SHIMIZU K, OKITA R, SAISHO S, et al. Clinicopathological and immunohistochemical features of lung invasive mucinous adenocarcinoma based on computed tomography findings[J]. Onco Targets Ther, 2016, 10: 153-163. DOI:10.2147/OTT.S121059 |
| [10] |
英天舒, 张晓晔. 31例原发性肺黏液腺癌的CT表现与病理特点分析[J]. 实用癌症杂志, 2016, 31(4): 567-568, 571. DOI:10.3969/j.issn.1001-5930.2016.04.014 |
| [11] |
BOLAND J M, MALESZEWSKI J J, WAMPFLER J A, et al. Pulmonary invasive mucinous adenocarcinoma and mixed invasive mucinous/nonmucinous adenocarcinoma-a clinicopathological and molecular genetic study with survival analysis[J]. Hum Pathol, 2018, 71: 8-19. DOI:10.1016/j.humpath.2017.08.002 |
| [12] |
陈晓燕, 阙瑞华, 黎辉. 原发性肺粘液腺癌结合病理MSCT表现分析[J]. 中国医疗器械信息, 2017, 23(12): 25-26, 78. |
| [13] |
TANAKA I, DAYDE D, TAI M C, et al. SRGN-triggered aggressive and immunosuppressive phenotype in a subset of TTF-1-negative lung adenocarcinomas[J]. J Natl Cancer Inst, 2022, 114(2): 290-301. DOI:10.1093/jnci/djab183 |
| [14] |
BUETTNER R. Invasive mucinous adenocarcinoma: genetic insights into a lung cancer entity with distinct clinical behavior and genomic features[J]. Mod Pathol, 2022, 35(2): 138-139. DOI:10.1038/s41379-021-00945-0 |
| [15] |
金琳芳, 浦勇, 浦柯艳, 等. 原发性肺腺癌中Napsin A、TTF1及SPA蛋白的表达及其与EGFR基因突变的相关性[J]. 肿瘤防治研究, 2017, 44(9): 618-621. |
| [16] |
KOO H J, KIM M Y, KOO J H, et al. Computerized margin and texture analyses for differentiating bacterial pneumonia and invasive mucinous adenocarcinoma presenting as consolidation[J]. PLoS One, 2017, 12(5): e0177379. DOI:10.1371/journal.pone.0177379 |
| [17] |
LEE M A, KANG J, LEE H Y, et al. Spread through air spaces (STAS) in invasive mucinous adenocarcinoma of the lung: incidence, prognostic impact, and prediction based on clinicoradiologic factors[J]. Thorac Cancer, 2020, 11(11): 3145-3154. DOI:10.1111/1759-7714.13632 |
| [18] |
张文. 整个肺下叶粘液腺癌病理与临床观察[J]. 临床肺科杂志, 2008, 13(2): 169-169. DOI:10.3969/j.issn.1009-6663.2008.02.077 |
| [19] |
望云, 张正委, 范丽, 等. 原发性结节肿块型肺黏液腺癌的CT表现与病理基础[J/CD]. 中华肺部疾病杂志(电子版), 2022, 15(2): 151-156.
|
| [20] |
史晓光, 曹辉, 田成斌. 肺炎型原发性肺黏液腺癌的临床、CT及病理特点分析[J]. 临床肺科杂志, 2020, 25(2): 271-274. |
| [21] |
NIE K, NIE W, ZHANG Y X, et al. Comparing clinico-pathological features and prognosis of primary pulmonary invasive mucinous adenocarcinoma based on computed tomography findings[J]. Cancer Imaging, 2019, 19(1): 47. |
 2023, Vol. 21
2023, Vol. 21


