| 彩色多普勒超声在甲状腺功能正常桥本甲状腺炎诊断中的应用价值 |
桥本甲状腺炎(Hashimoto’s thyroiditis,HT)又称慢性淋巴细胞性甲状腺炎,是一种与抗甲状腺自身抗体有关并由其介导的自身免疫性疾病。HT的诊断基于实验室检查结果,HT患者的甲状腺抗体,即甲状腺球蛋白抗体(thyroglobulin antibodies,TgAb)和甲状腺过氧化物酶抗体(thyroperoxidase antibodies,TPOAb)升高。血清标志物对HT的诊断和其他自身免疫病的鉴别诊断是必需的。除临床和实验室检查外,超声对甲状腺病变的检出具有明显优势[1]。超声对典型HT的诊断符合率较高,对不典型HT认识有限,常见的超声表现有甲状腺弥漫性肿大、实质回声增粗、微小结节改变,CDFI可见血供丰富。本研究旨在探讨甲状腺功能正常的HT患者超声声像图表现,以提高对HT的超声诊断水平。
1 资料与方法 1.1 一般资料选取2015年1月至2017年12月我院收治的45例甲状腺功能正常的HT患者为HT组,男4例,女41例,年龄13~88岁。实验室检查显示游离三碘甲状腺原氨酸(FT3)及游离甲状腺素(FT4)水平正常,TPOAb水平升高(正常水平为0~12 U/mL)。排除标准:患有任何慢性疾病或急性炎症;服用可能改变甲状腺激素水平的药物;有甲状腺功能障碍史;有甲状腺切除术史;放射性碘治疗者及妊娠者。
对照组选取46例健康志愿者,男10例,女36例,年龄15~49岁。无任何慢性疾病或急性炎症,未使用任何药物。FT3和FT4水平正常、促甲状腺素(TSH)水平为0.5~5 μU/mL、无妊娠且甲状腺功能正常。
1.2 仪器与方法2组均行彩色多普勒超声检查。采用Philips IU22、Philips iE33、Esaote MyLabClass C等彩色多普勒超声诊断仪,探头频率5.0~12.0 MHz。患者取仰卧位,去枕头后仰,以充分暴露颈部。超声检查由具有多年临床经验的主治医师完成,采用二维超声测量两侧甲状腺和峡部厚度,观察甲状腺形态学特征,包括评估回声类型、结节(依据大小分为大结节、微结节或混合型结节,依据位置分为包膜下、实质内或两者皆有)、甲状腺边缘包膜的波动、腺体内分隔,以及甲状旁腺和气管前区的颈部淋巴结;CDFI观察甲状腺内血流分布情况。参照Kim等[2]的研究,鉴别甲状腺弥漫性疾病的异常超声特征。
1.3 统计学处理使用SPSS 19.0统计学软件分析。通过Kolmogorov-Smirnov检验评估变量分布。组间比较采用Mann-Whitney U检验。二分变量比较采用χ2检验。数据以x±s表示。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组甲状腺两侧叶及峡部厚度比较2组甲状腺两侧叶及峡部厚度比较,差异均有统计学意义(均P < 0.05)(表 1)。
| 表 1 2组甲状腺两侧叶和峡部的厚度比较(mm, x±s) |
 |
2.2 2组超声特征及诊断效能分析(表 2,3)
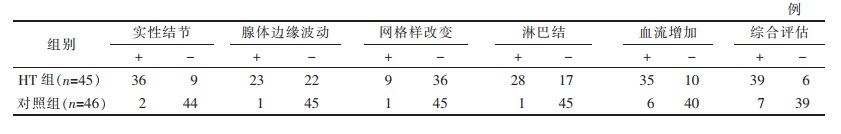
| 表 2 2组超声特征 |
 |
| 表 3 各超声特征鉴别HT的诊断效能 |
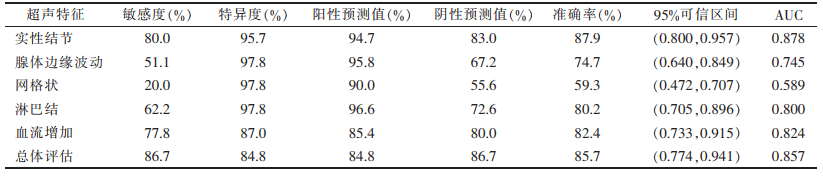 |
HT组中36例可见实性结节,27例为微小结节,9例为大结节或混合型结节;对照组中2例可见实性结节,1例为微小结节,1例为大结节。HT组中实性结节发生率(80.0%,36/45)明显高于对照组(4.3%,2/46)(P < 0.05),2组实性结节类型分布差异有统计学意义(P < 0.05)。2组腺体边缘波动、网格样改变、反应性淋巴结及血流分布增加情况差异均有统计学意义(均P < 0.05)。所有超声特征综合诊断HT的敏感度为86.7%,特异度为84.8%,阳性预测值84.8%,阴性预测值86.7%,准确率85.7%。部分HT患者的二维和彩色多普勒超声表现见图 1~5。
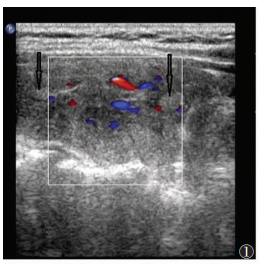 |
| 图 1 女,63岁,桥本甲状腺炎(HT)。甲状腺内多个微小结节(箭头) |
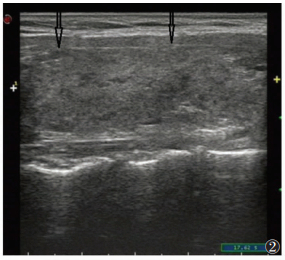 |
| 图 2 女,31岁,HT,体检发现甲状腺腺体边缘起伏,包膜下微小结节(箭头) |
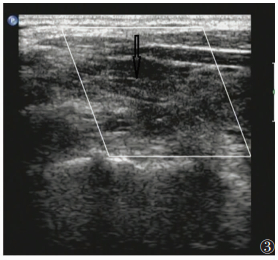 |
| 图 3 女,51岁,HT,甲状腺内呈网格样改变,见条索样回声(箭头) |
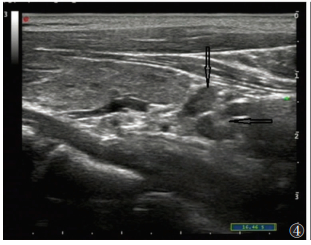 |
| 图 4 女,49岁,HT,体检发现甲状旁腺区反应性淋巴结(箭头) |
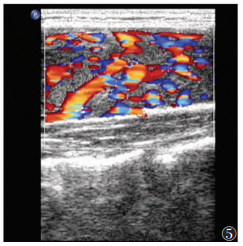 |
| 图 5 女,49岁,HT,体检发现甲状旁腺区反应性淋巴结(箭头) |
2.3 2组TPOAb水平比较
HT组TPOAb水平升高,为17.1~1 149.0 U/mL;对照组TPOAb水平正常,为0~12 U/mL。HT组中,超声表现为实性结节、腺体边缘波动、网格样改变、反应性淋巴结、血流增加患者的TPOAb水平分别为(342±298.25)、(329.42±280.09)、(884.68±233.43)、(285.01±266.55)、(343.01±303.91)U/mL;其中网格样改变TPOAb水平与其余各亚组之间比较差异均有统计学意义(均P < 0.01),其余亚组间比较差异无统计学意义(均P>0.05)。
3 讨论HT是一种自身免疫性甲状腺疾病,其特征是T细胞和B细胞浸润甲状腺,活化的B细胞分泌抗甲状腺自身抗体。细胞毒性T细胞主要负责甲状腺实质的破坏,导致最初的甲状腺毒症,随后甲状腺功能减退。HT临床可表现为无痛性弥漫性甲状腺肿,部分患者甲状腺大小无变化,常伴甲状腺功能减退症和自身抗体阳性。HT超声声像图随着疾病的动态发展而改变[3]。
研究[4]表明,HT患者中17%自身抗体可能为阴性,13%可能自身抗体水平较低;正常人群中2%~20%自身抗体阳性。因此,仅根据临床或血清学表现诊断HT会有漏诊,彩色多普勒超声可作为诊断HT的辅助工具。Acar等[5]报道在无任何症状或异常实验室结果的情况下,一个抗体阳性健康亚群也可表现出灰阶和彩色多普勒超声特征,类似于甲状腺功能减退状态的HT患者。Andeson等[4]报道超声结合临床及实验室检查,可提高HT诊断的敏感度和特异度。研究[6]表明,在HT中,甲状腺腺体回声降低,呈网格样改变和微结节形成。以上表现与甲状腺组织内数量不等的炎性细胞(以淋巴细胞为主)灶状或散在浸润,以及甲状腺间质内不同程度的纤维组织增生所致粗细不等的纤维间隔及玻璃样变性的病理改变相对应。研究[7]显示,HT患者的甲状腺炎症及组织破坏程度与TPOAb呈显著正相关。本研究发现网格样改变患者TPOAb水平较其他各组更高;提示网格样改变患者甲状腺滤泡的破坏以弥漫性为主,间质内出现不同程度的纤维组织增生,范围较大或程度较重,与上述研究一致。
甲状腺内广泛性或局灶性低回声结节形成是HT最常见的特征。薛利芳等[8]对31例HT的甲状腺声像图与核素显像及实验室检查结果进行比较分析,认为通过回声改变诊断HT的特异度(77.4%)及敏感度(100.0%)均优于核素显像(敏感度93.5%)及实验室检查(敏感度88.5%),与国外学者[9]报道一致。通常超声检测到的淋巴细胞性甲状腺炎边缘不清晰的低回声病变[10],实际上是假结节。Erdogan等[11]报道,结节形成(单发或多发)是HT最常见的超声表现,但体检显示其甲状腺结节发生率较低。这种差异可能与HT中假结节形成有关。微小结节通常为直径1~7 mm的结节[11]。Anderson等[4, 12]认为微小结节的存在可提高HT的诊断敏感度。据报道[13],超声诊断HT微小结节阳性预测值高达94.7%。在本研究中,实性结节也是HT的突出特征,特异度为95.7%,阳性预测值为94.7%,准确率为87.9%。
HT初始阶段,超声表现为局灶性低回声区域,边缘不规则,特别是包膜下区域,以及甲状腺中央区域形成低回声假结节。包膜下结节可造成甲状腺边缘的起伏,本研究HT组中23例(51.1%),对照组仅1例(2.2%),边缘波动诊断HT的特异度和阳性预测值分别为97.8%和95.8%。
甲状旁腺区和(或)气管旁区域的淋巴结受累与甲状腺的病理状况有关,因上述区域是甲状腺淋巴引流的优先部位[14]。Yamashiro等[14]报道的38例中28例(73.7%)存在Ⅵ区颈链淋巴结,均出现反应性增生(椭圆形、伴相对较窄的高回声中央淋巴门)。Brancato等[15]提示,颈部淋巴结反应性增生数量增加,特别是Ⅱ区(颈深上)、Ⅲ(颈深中)和Ⅳ(颈深下),是一种与慢性自身免疫性甲状腺炎相关的特征性超声表现。本研究HT组中,62.2%(28/45)超声发现颈部淋巴结,诊断HT的特异度为97.8%,阳性预测值为96.6%。
HT早期,CDFI可显示血流呈轻中度增多;后期,CDFI示甲状腺缩小,伴明显纤维化,血供甚至减少,本研究77.8%(35/45)的HT患者甲状腺血流分布增加。典型的HT以血流分布增多为主,但在不同阶段,其血流分布可改变。
综上所述,彩色多普勒超声是诊断甲状腺功能正常HT的有效检查,多种超声特征(微结节、回声纹理、腺体边缘波动、血流分布、淋巴结)综合评估,可提高HT的诊断敏感度和准确率。
| [1] |
Ruchala M, Szmyt K, Slawek S, et al. Ultrasound sonoelastography in the evaluation of thyroiditis and autoimmune thyroid disease[J]. Endokrynol Pol, 2014, 65: 520-531. |
| [2] |
Kim DW, Eun CK, In HS, et al. Sonographic differentiation of asymptomatic diffuse thyroid disease from normal thyroid:a prospective study[J]. AJNR Am J Neuroradiol, 2010, 31: 1956-1960. DOI:10.3174/ajnr.A2164 |
| [3] |
Wu H, Zhang B. Ultrasonographic appearance of focal Hashimoto's thyroiditis:A single institution experience[J]. Endocr J, 2015, 62: 655-663. DOI:10.1507/endocrj.EJ15-0083 |
| [4] |
Anderson L, Middleton WD, Teefey SA, et al. Hashimoto thyroiditis:Part 1, sonographic analysis of the nodular form of Hashimoto thyroiditis[J]. AJR Am J Roentgenol, 2010, 195: 208-215. DOI:10.2214/AJR.09.2459 |
| [5] |
Acar T, Ozbek SS, Erdogan M, et al. US findings in euthyroid patients with positive antithyroid autoantibody tests compared to normal and hypothyroid cases[J]. Diagn Interv Radiol, 2013, 19: 265-270. |
| [6] |
杨光华. 病理学[M]. 北京: 人民卫生出版社, 2001: 318-319.
|
| [7] |
Sinclair D. Clinical and laboratory aspects of thyroid autoantibodies[J]. Ann Clin Biochem, 2006, 43: 173-183. DOI:10.1258/000456306776865043 |
| [8] |
薛利芳, 秦淑玲, 凌广花, 等. 超声、核素显像对桥本病的诊断价值[J]. 中国医学影像学技术, 2001, 17(10): 966-968. |
| [9] |
Rago T, Chiovato L, Grasso L, et al. Thyroid ultrasonography as a tool for detecting thyroid autoimmune diseases and predicting thyroid dysfunction in apparent healthy subjects[J]. J Endocrinol Invest, 2001, 24: 763. DOI:10.1007/BF03343925 |
| [10] |
Langer JE, Khan A, Nisenbaum HL, et al. Sonographic appearance of focal thyroiditis[J]. AJR Am J Roentgenol, 2001, 176: 751-754. DOI:10.2214/ajr.176.3.1760751 |
| [11] |
Erdogan M, Erdem N, Cetinkalp S, et al. Demographic, clinical, laboratory, ultrasonographic, and cytological features of patients with Hashimoto's thyroiditis:results of a university hospital of 769 patients in Turkey[J]. Endocrine, 2009, 36: 486-490. DOI:10.1007/s12020-009-9258-z |
| [12] |
Yeh HC, Futterweit W, Gilbert P. Micronodulation:ultrasonographic sign of Hashimoto thyroiditis[J]. J Ultrasound Med, 1996, 15: 813-819. DOI:10.7863/jum.1996.15.12.813 |
| [13] |
张倩, 王建华, 王金锐. 桥本甲状腺炎背景下甲状腺结节的超声诊断进展[J]. 中国中西医结合影像学杂志, 2017, 15(2): 248-250. DOI:10.3969/j.issn.1672-0512.2017.02.041 |
| [14] |
Yamashiro I, Saito OC, Chammas MC, et al. Ultrasound findings in thyroiditis[J]. Radiol Bras, 2007, 40: 75-79. DOI:10.1590/S0100-39842007000200003 |
| [15] |
Brancato D, Citarrella R, Richiusa P, et al. Neck lymph nodes in chronic autoimmune thyroiditis:the sonographic pattern[J]. Thyroid, 2013, 23: 173-177. DOI:10.1089/thy.2012.0375 |
 2019, Vol. 17
2019, Vol. 17


