| CT平扫定量测量胰腺脂肪含量的临床应用价值 |
2. 山东省临沂市中医医院,康复科,山东 临沂 276000;
3. 山东省临沂市中医医院,超声科,山东 临沂 276000
非酒精性脂肪肝患者的脏器脂肪浸润可触发炎症反应[1]。多项研究[2-4]表明,胰腺脂肪蓄积是引起胰腺功能障碍,最终诱发糖尿病的原因之一。鉴于此,学者们[5-6]提出非酒精性胰腺脂肪浸润性疾病这一概念。脏器脂肪浸润在CT图像上表现为CT值降低。但在某些情况下,如锰蓄积,亦表现为胰腺CT值降低,从而造成胰腺脂肪浸润的假象[7]。因此,需进行CT定量测量胰腺脂肪含量,并与病理对照研究加以证实。目前,仅有少数胰腺脂肪量化的CT研究[6, 8-9],本研究旨在探讨CT测量指标与手术切除胰腺标本脂肪含量的相关性,并分析其应用于评价糖代谢异常的临床价值。
1 资料与方法 1.1 一般资料回顾性分析2014年1月至2016年12月在我院接受胰腺切除手术的患者共78例,其中男54例,女24例;年龄21~79岁,平均63.5岁。纳入标准:①术前1个月内行腹部CT平扫及增强扫描;②在CT图像上胰腺非肿瘤组织不同部位设置3个面积为1.0 cm2的ROI;③对手术病理切片进行观察,评估镜下是否有可测量的正常胰腺组织。胰腺切除的手术适应证分别为:胰腺癌24例,胆管癌7例,胰腺神经内分泌肿瘤10例,壶腹癌8例,胰腺导管内乳头状黏液性肿瘤8例,胰腺浆液性囊腺瘤5例,胰腺黏液性囊腺瘤8例,胰腺实性假乳头状瘤6例,胰腺假囊肿2例。
1.2 仪器与方法采用Siemens 128层CT扫描仪。扫描参数:120 kV,200 mAs,矩阵512×512,层厚2.5 mm。增强扫描时经肘静脉高压团注非离子型对比剂Ultravist 300(浓度300 mgI/mL),流率2.5 mL/s,剂量1.5 mL/kg体质量。使用动脉监测技术,当腹主动脉CT值升高至150 HU后,分别于25、60、120 s行行动脉期、静脉期及延迟期扫描。
1.3 CT图像分析由2位高年资放射科医师使用PACS阅片,根据手术记录和病理诊断报告标记肿瘤部位、大小及手术切除范围,然后参照此标记进行阅片并达成一致,复习CT增强扫描图像上显示的肿瘤部位、邻近血管和周围胰腺组织。在CT平扫图像上正常胰腺处设置3个面积1.0~2.0 cm2的ROI,尽量避开胰腺边缘以减小部分容积效应;同时在CT平扫图像上脾内不同位置设置3个与胰腺相同大小的ROI;取平均值作为最终测量值(图 1,2)。计算胰腺与脾CT值差值(P-S)及胰腺与脾CT值比值(P/S)。选择脐水平层面,测量腹腔内脏脂肪面积,以轴位图像上腹壁肌肉所围成区域内CT值在-250~-50 HU内的面积大小表示[10]。
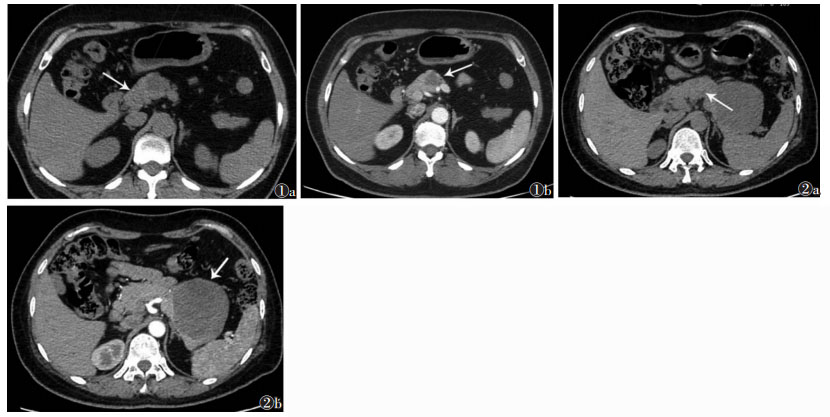 |
| 图 1 女,51岁,胰颈黏液性囊腺瘤 图 1a,1b 分别为CT平扫及增强扫描图像。平扫示胰颈稍低密度肿物,增强扫描图像确定肿物边界(图 1b箭头),并在平扫图像上设置一面积约1.26 cm2的ROI,测量肿物周围正常胰腺组织密度(图 1a箭头) 图 2 女,47岁,胰尾胰岛细胞瘤 图 2a,2b 分别为CT平扫及增强扫描图像。平扫示胰尾稍低密度肿物,增强扫描确定肿物边界(图 2b箭头),并在平扫图像上设置一面积约1.72 cm2的ROI,测量肿物周围正常胰腺组织密度(图 2a箭头) |
1.4 组织学胰腺脂肪含量测定
78例均行开腹手术,切除肿瘤组织经10%甲醛固定,常规石蜡包埋、切片,行HE染色,镜下观察。病理科医师在不知道患者临床和影像资料的情况下,选择3张镜下观察能够显示无胰腺脂肪坏死或急性胰腺炎的正常胰腺组织切片,计数视野内胰腺实质的脂肪面积和整个视野的面积,以视野中脂肪面积占整个视野面积百分比表示胰腺脂肪含量。
1.5 临床糖代谢情况评估由1名内分泌医师依据患者术前检验报告评估其糖代谢情况。78例分为2组,即糖代谢正常组和糖代谢异常组,后者包括糖尿病、糖耐量受损和空腹血糖异常。糖尿病定义为空腹血糖>7.0 mmol/L或口服75 g葡萄糖后2 h血糖>11.1 mmol/L。糖耐量受损定义为空腹血糖<7.0 mmol/L,口服75 g葡萄糖后2 h血糖为7.8 ~11.1 mmol/L。空腹血糖异常定义为空腹血糖水平在6.1~6.9 mmol/L,口服75 g葡萄糖后2 h血糖<7.8 mmol/L[11]。
1.6 统计学分析使用SPSS 17.0和MedCalc 9.30统计软件进行数据分析。采用Spearman相关分析判断CT测量指标、内脏脂肪面积与组织标本胰腺脂肪含量的相关性;采用多变量Logistic回归模型确定CT测量指标、年龄、性别、内脏脂肪含量与糖代谢异常(如糖耐量受损、空腹血糖异常或糖尿病)的相关性。检验显著性水准α=0.05,以P<0.05为差异有统计学意义。
2 结果组织标本胰腺脂肪含量为0~68.4%(中位数1.8%;四分位数间距0.5%~5.7%)。P-S范围-27.5~5.34 HU(中位数-3.9 HU;四分位数间距-7.7~-1.1 HU);P/S范围0.4~1.1(中位数0.9;四分位数间距0.8~1.0)。CT图像上腹腔内脏脂肪面积18.8~293.7 cm2(中位数113.1 cm2;四分位数间距72.4~153.9 cm2)。CT检查与胰腺切除手术平均间隔时间约13 d(2~24 d)。相关分析显示,组织标本胰腺脂肪含量与P-S、P/S呈显著负相关(r=-0.653,P<0.01;r=-0.646,P<0.01)。内脏脂肪面积与组织标本胰腺脂肪含量无显著相关性(r=0.101,P=0.52)。
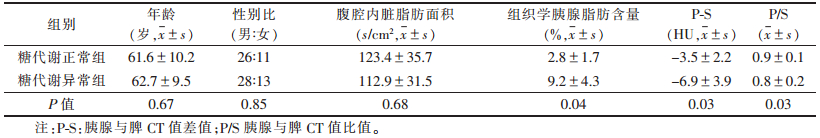
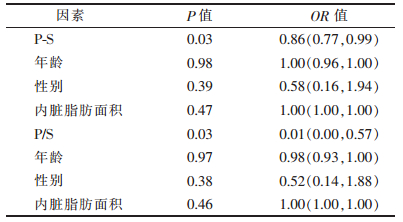
所有患者均接受空腹血糖和糖耐量试验,其与CT检查平均间隔时间为7 d(0 ~20 d),与胰腺切除手术平均间隔时间为10 d(8~23 d)。78例中36例无糖代谢异常,14例为糖耐量受损或空腹血糖异常,28例为糖尿病。糖代谢正常组与异常组各测量指标比较见表 1。糖代谢异常组组织标本胰腺脂肪含量高于糖代谢正常组(P=0.04);糖代谢异常组P-S和P/S均显著低于糖代谢正常组(P=0.03,0.03);而2组年龄、性别比、内脏脂肪面积差异均无统计学意义(P=0.67,0.85,0.68)。多变量Logistic回归分析得出,P-S和P/S差异有统计学意义,是预测糖代谢异常的独立影响因素(表 2)。
| 表 1 2组各观测指标比较分析 |
 |
| 表 2 多变量Logistic回归分析 |
 |
ROC曲线分析显示,P-S和P/S预测糖代谢异常的曲线下面积分别为0.632(95%置信区间0.500,0.751)和0.639(95%置信区间0.508,0.758),两者诊断效能差异无统计学意义(P=0.23)。P-S阈值为-1.8 HU时,预测糖代谢异常的敏感度和特异度分别为78.4%和44.1%;P/S阈值为0.9时,预测糖代谢异常的敏感度和特异度分别为69.3%和55.2%。
3 讨论脂代谢异常可引起内脏器官,包括心脏、肾脏、肝脏及胰腺脂肪浸润。由于氧化应激,脂肪细胞释放细胞因子,如肿瘤坏死因子、白细胞介素6和单核细胞趋化因子-1,导致局部炎症过程及器官功能障碍[12]。肝脏的脂肪浸润被称为脂肪肝,可导致脂肪性肝炎,甚至肝硬化、肝癌。Lee等[13]研究发现,脂肪胰和脂肪肝并存,96.9%脂肪肝患者具有脂肪胰,胰腺的脂肪浸润可使胰腺功能减退,出现胰岛功能抵抗,使该人群发生胰腺炎及胰腺癌的风险增加[14]。本研究表明,CT定量指标P-S和P/S均与组织病理学胰腺实质脂肪含量显著相关,相关系数与既往一项13例胰腺活检测定CT值与组织学胰腺脂肪含量相关性的研究[6]结果近似。
Tushuizen等[4]发现,2型糖尿病患者胰腺脂肪含量明显升高,胰腺细胞的脂质异位沉积引起胰岛细胞功能异常,损害胰腺细胞功能,并可能在2型糖尿病的发生中起重要作用。另一项2型糖尿病患者胰腺脂肪沉积的CT评估及与胰岛素抵抗的相关性研究[15]表明,2型糖尿病组的P-S较正常对照组明显增加,同时在2型糖尿病组内,脂肪胰组的P-S较非脂肪胰组明显增加。本研究显示,胰腺脂肪含量的CT指标与糖代谢异常密切相关,可在一定程度上预测患者糖代谢情况,此结果与多种影像学检查方法评估胰腺脂肪沉积与糖代谢水平的结果[3, 6, 10]相符。本研究中尽管P-S和P/S能很好区分糖代谢正常组与糖代谢异常组,但无法区分糖代谢正常组、糖耐量受损或空腹血糖异常组、糖尿病组间的差异,可能因本研究例数相对较少。
腹腔内脏脂肪面积在糖代谢正常组与异常组之间差异无统计学意义,且未发现内脏脂肪与胰腺脂肪含量之间的潜在关系。这一结果印证了肝脏或胰腺局限性脂肪沉积在相似体质量指数人群中可有很大差异的观点[16]。基因和环境因素亦可能是个体脂肪沉积和脏器脂肪增多症产生的影响因素[4]。
综上所述,CT定量指标P-S、P/S与组织病理学上胰腺脂肪含量显著相关,是预测糖代谢受损的显著性独立影响因素,提示利用CT值量化的胰腺脂肪含量可在一定程度上反映糖代谢异常情况。
| [1] |
Lee SS, Park SH. Radiologic evaluation of nonalcoholic fatty liv-er disease[J]. World J Gastroenterol, 2014, 20: 7392-7402. DOI:10.3748/wjg.v20.i23.7392 |
| [2] |
Pinnick KE, Collins SC, Londos C, et al. Pancreatic ectopic fat is characterized by adipocyte infiltration and altered lipid composi-tion[J]. Obesity(Silver Spring), 2008, 16: 522-530. |
| [3] |
Heni M, Machann J, Staiger H, et al. Pancreatic fat is negatively associated with insulin secretion in individuals with impaired fa-sting glucose and/or impaired glucose tolerance:a nuclear magn-etic resonance study[J]. Diabetes Metab Res Rev, 2010, 26: 200-205. DOI:10.1002/dmrr.v26:3 |
| [4] |
Tushuizen ME, Bunck MC, Pouwels PJ, et al. Pancreatic fat con-tent and beta-cell function in men with and without type 2 di-abetes[J]. Diabetes Care, 2007, 30: 2916-2921. DOI:10.2337/dc07-0326 |
| [5] |
Mathur A, Marine M, Lu D, et al. Nonalcoholic fatty pancreas di-sease[J]. HPB (Oxford), 2007, 9: 312-318. DOI:10.1080/13651820701504157 |
| [6] |
Navina S, Acharya C, DeLany JP, et al. Lipotoxicity causes mult-isystem organ failure and exacerbates acute pancreatitis in obes-ity[J]. Sci Transl Med, 2011, 3: 107-110. |
| [7] |
Ly JN, Miller FH. MR imaging of the pancreas:a practical app-roach[J]. Radiol Clin North Am, 2002, 40: 1289-1306. DOI:10.1016/S0033-8389(02)00056-8 |
| [8] |
Saisho Y, Butler AE, Meier JJ, et al. Pancreas volumes in huma-ns from birth to age one hundred taking into account sex, obes-ity, and presence of type-2 diabetes[J]. Clin Anat, 2007, 20: 933-942. DOI:10.1002/ca.v20:8 |
| [9] |
Gilbeau JP, Poncelet V, Libon E, et al. The density, contour, and thickness of the pancreas in diabetics:CT findings in 57 patie-nts[J]. AJR Am J Roentgenol, 1992, 159: 527-531. DOI:10.2214/ajr.159.3.1503017 |
| [10] |
Yoshizumi T, Nakamura T, Yamane M, et al. Abdominal fat:sta-ndardized technique for measurement at CT[J]. Radiology, 1999, 211: 283-286. DOI:10.1148/radiology.211.1.r99ap15283 |
| [11] |
Bergman M. Inadequacies of absolute threshold levels for diag-nosing prediabetes[J]. Diabetes Metab Res Rev, 2010, 26: 3-6. DOI:10.1002/dmrr.v26:1 |
| [12] |
Hui E, Xu A, Bo Yang H, et al. Obesity as the common soil of non-alcoholic fatty liver disease and diabetes:role of adipokin-es[J]. J Diabetes Investig, 2013, 4: 413-425. DOI:10.1111/jdi.12093 |
| [13] |
Lee JS, Kim SH, Jun DW, et al. Clinical implications of fatty pancreas:correlations between fatty pancreas and metabolic syn-drome[J]. World J Gastroenterol, 2009, 15: 1869-1875. DOI:10.3748/wjg.15.1869 |
| [14] |
Patel AV, Rodriguez C, Bernstein L, et al. Obesity, recreational physical activity, and risk of pancreatic cancer in a large U.S. Cohort[J]. Cancer Epidemiol Biomarkers Prev, 2005, 14: 459-466. DOI:10.1158/1055-9965.EPI-04-0583 |
| [15] |
姚慧, 康冬梅, 刘燕, 等. 2型糖尿病患者胰腺脂肪沉积的CT评估及与胰岛素抵抗的相关性[J]. 安徽医科大学学报, 2012, 47(5): 601-604. |
| [16] |
Tiikkainen M, Bergholm R, Vehkavaara S, et al. Effects of iden-tical weight loss on body composition and features of insulin resistance in obese women with high and low liver fat conte-nt[J]. Diabetes, 2003, 52: 701-707. DOI:10.2337/diabetes.52.3.701 |
 2018, Vol. 16
2018, Vol. 16


