| 陈旧性心肌梗死体积与左心功能相关性的MRI研究 |
2. 徐州医科大学附属医院影像科,江苏 徐州 221002
心肌梗死为常见病、多发病,死亡率较高。目前,随着静脉溶栓、冠状动脉介入治疗的广泛开展,临床迫切需要一种能够直接观察心肌损伤程度的影像学检查方法,以便于临床评价治疗方式和判断预后。心脏MRI技术的发展,为直接观察梗死心肌的形态、定量计算梗死心肌体积提供了一种有效的方法[1]。本研究旨在探讨MRI心肌灌注及电影成像技术在陈旧性心肌梗死及左心功能评价中的应用价值。
1 资料与方法 1.1 一般资料选取2014年3月至2017年3月在徐州医科大学附属医院收治的有明确陈旧性心肌梗死病史的患者。排除标准:房颤、重度心律失常、严重瓣膜性心脏病、先天性心脏病,以及严重心肾功能不全、心脏起搏器植入、金属置入、幽闭恐惧症等具有MRI禁忌证及出现严重呼吸运动伪影的患者。最终33例纳入本研究(病变组),其中男28例,女5例;年龄46~80岁,平均(65.5±12.4)岁;心率56~112次/min。所有患者均在入院后1周内行MRI检查。另选取平素体健、心脏MRI检查无异常发现的正常体检者25例作为对照组,其中男14例,女11例;年龄22~64岁,平均(40.5±15.4)岁。所有患者均签署知情同意书;扫描前均未使用倍他乐克等降低心率的药物。
1.2 仪器与方法采用Philips Achieva 1.5 T超导型MRI系统,心脏专用5单元相位阵列线圈、胸前导联心电向量触发及呼吸门控技术。扫描序列及参数①心肌灌注序列(TFE):TR 2.6 ms,TE 1.3 ms,层厚8 mm,层数4,矩阵256×256,反转角50°,扫描时间1 min 10 s。采用4层短轴+1层四腔心+1层二腔心切面组合。垂直四腔心及左室两腔心室长轴线,获得短轴面成像方向,每个心动周期同时采集4层心脏短轴面图像(自心底至心尖部),单次屏气扫描,高压注射器经肘静脉注射对比剂Gd-DTPA,流率3~5 mL/s,剂量0.2 mmol/kg体质量,扫描开始后约10 s注射对比剂,完成心肌灌注首过时相MRI采集。②对比剂延迟强化序列(PSIR-TFE):TR 6.1 ms,TE 3.0 ms,层厚8 mm,矩阵256×256,反转角15°。心肌灌注扫描结束即刻再以流率1~3 mL/s注入对比剂(剂量0.2 mmol/kg体质量),延迟10~15 min后行PSIR-TFE。③基于梯度回波的多时相电影序列(balanced-FFE):TR 2.9 ms,TE 1.5 ms,层厚8 mm,矩阵256×256,反转角60°。选取四腔心左心室二尖瓣中点至心尖连线,另分别在单层短轴位视图上定义平行于室间隔及垂直于室间隔的线,采用多次屏气节段采集获得心脏长轴位(包括四腔及两腔)和短轴位(两腔)的MRI电影数据,左室短轴位电影一般采集8~10层面。
1.3 MRI图像分析及测量全部图像由2位有丰富临床经验的放射科副主任医师行双盲独立观察分析,以意见一致为判断标准。①采用目测法确定心肌有无首过期灌注减低及延迟期增强。②MRI心功能测定应用Philips Achieva Extended MR Workspace 2.6.3.1工作站心脏软件包,进入MRI Cardiac Analysis对左室连续短轴位图像行心功能后处理分析。左心室功能分析流程:以电影回放形式观察左室短轴位各个心动周期容积变化,确定心室收缩末期和心室舒张末期。利用LV analysis后处理工具逐层手工描记左心室心内膜轮廓,覆盖从二尖瓣至左心室心尖部整个左心室腔,避开腱索和肌小梁等结构。整个左室舒张末期容积(end diastolic volume,EDV)及收缩末期容积(end systolic volume,ESV)由手工描记出的所有层的容积相加得到,并计算射血分数(ejection fraction,EF)、每搏输出量(stroke volume,SV)等相关参数。EF=(EDV-ESV)/EDV,SV=EDV-ESV。按左室室壁运动异常(wall motion abnormality,WMA)进行半定量评分:0分,正常;1分,运动减低;2分,无运动;3分,矛盾运动;4分,室壁瘤形成。本研究所用数据由1名熟练使用此软件的医师完成,各测量值取3次不同时间测量值的均值。利用计算机辅助测体积法,逐层手工描记延迟强化灶轮廓,计算机辅助计算出梗死心肌体积。
1.4 统计学方法采用SPSS 13.0软件分析。定量资料以x±s表示,定性资料以例数、百分比表示。首过期灌注减低及延迟期阳性率采用χ2检验。梗死心肌体积与WMA评分及左室功能参数的关系采用Pearson相关分析。病变组与对照组心脏形态与功能分析采用Mann-Whitney U检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 MRI首过期灌注及延迟期强化结果比较33例病变组中32例(97.0%)延迟期心肌可见高信号(延迟强化),其中20例(60.6%)首过期灌注减低(图 1),12例(36.4%)无灌注减低;1例(3.0%)首过期灌注减低且延迟期无心肌强化。延迟期心肌强化阳性率与首过期灌注减低率差异无统计学意义(χ2=0.589,P>0.05)。
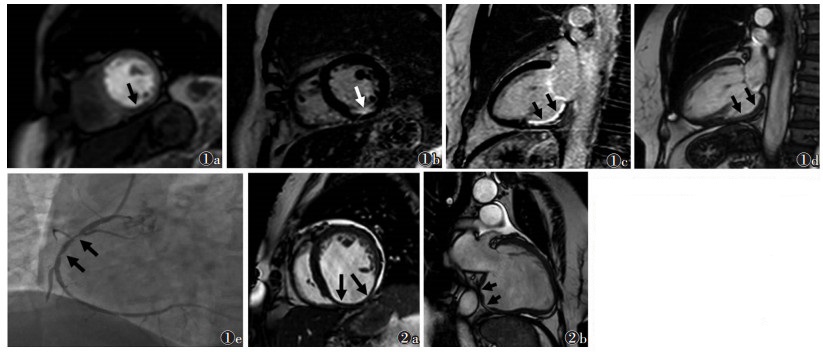 |
| 图 1 女,78岁,陈旧性心肌梗死图 1a首过灌注示左室下壁心内膜下灌注减低(箭) 图 1b,1c 延迟期短轴位及长轴位,可见相应节段出现延迟强化(箭) 图 1d 心肌灌注(TFE)电影序列示相应区域心肌变薄 图 1e DSA示右冠状动脉近段约80%狭窄(箭) 图 2 女,68岁,陈旧性心肌梗死 图 2a,2b TFE电影序列短轴位、长轴位均可见左室心肌局部薄弱,心腔变大,左室下壁运动度减低、局部向外膨隆(箭) |
2.2 梗死心肌体积与WMA评分及左室功能参数的关系
32例延迟强化阳性者梗死心肌体积为3.2~52.5 cm3,平均(22.1±12.3)cm3,梗死心肌体积与EF呈负相关(r=-0.78,P < 0.05),与WMA评分、EDV、ESV呈正相关(r=0.76、0.68、0.72,均P < 0.05),与SV无明显相关性(r=0.23,P>0.05)。
2.3 2组左心室形态及功能对比(表 1)| 表 1 组MRI示左心室形态及功能对比(x±s) |
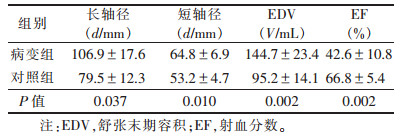 |
梗死心肌节段室壁运动异常,室壁变薄,3例室壁外凸形成室壁瘤(图 2)。病变组与对照组左室长轴径、短轴径、EDV、EF之间差异均有统计学意义(均P < 0.05)。
3 讨论缺血性心脏病是发病率和死亡率较高的疾病之一,冠状动脉粥样硬化性心脏病(冠心病)心肌梗死血运重建治疗的意义在于通过溶栓、介入治疗或手术搭桥使血管再通,挽救缺血损伤但仍具有活性的心肌,因此对确诊冠状动脉疾病和心室功能受损患者,临床需明确冠状动脉狭窄程度、血流情况、心肌功能等[2]。常用的冠状动脉造影虽能确定梗死相关动脉的狭窄位置和程度,但无法直接判断心肌的损害状况[3]。MRI心肌灌注及电影序列为评价心肌缺血及坏死的位置、程度提供了可能性。
心肌梗死的主要表现是心肌细胞结构破坏及微血管损害。心肌灌注MRI能够显示梗死心肌的原理是:梗死心肌细胞膜的通透性破坏使MRI对比剂(Gd-DTPA)滞留细胞间隙,这样就增加了Gd-DTPA在病变心肌细胞间的分配系数,使其在梗死心肌内的浓度增加且排出延迟,梗死区域即呈现延迟强化现象[4];延迟期增强的另一种原因可能是陈旧性心肌梗死,部分心肌发生程度不同的纤维化,其细胞外间隙较存活心肌大,对比剂的分布容积大[5]。心肌损伤时MRI表现为3种形式:首过灌注减低,延迟心肌增强;首过灌注正常,延迟心肌增强;首过灌注减低,无延迟增强。心肌梗死首过期灌注减低原因可能是心外膜下冠状动脉狭窄或阻塞,引起的心肌缺血或(和)梗死区功能性毛细血管的减少和广泛的微血管床的损伤,使对比剂无法或很少进入心肌梗死区,导致心肌梗死区心肌信号强度低于正常灌注心肌,即首过期灌注减低[6]。本组32例延迟期心肌可见高信号,其中20例首过灌注缺损,其范围小于延迟期心肌强化范围,可能原因为:①心肌缺血再灌注后,心内膜下微小血管损伤甚至闭塞,被称为“无复流”(no-reflow)现象[7-9],即在透壁型心肌梗死的基础上,无法全部恢复再灌注,其原因包括微循环障碍、心肌坏死或严重水肿压迫壁间血管所致,通常认为是不良左心室重构的预测因子。②再灌注治疗后,对比剂可通过冠状动脉大血管和侧支血管灌注并滞留于梗死心肌细胞和细胞间质内,形成累及心肌全层的延迟强化[10]。本研究中首过灌注缺损的发生率为63.6%(21/33),可能原因为静息状态下首过灌注扫描,难以发现应激状态下的血管异常扩张,如在腺苷负荷条件下,病变血管与正常血管间扩张程度的差异加剧,使首过灌注缺损出现率增加。灌注缺损区室壁运动度减低,心肌梗死节段心肌厚度变薄、出现脂肪变、心脏功能减低。本研究中,与对照组相比,心肌梗死患者室壁运动出现异常,导致左心室整体收缩功能下降。
MRI是目前心室功能评价最准确的手段之一[11]。心室功能主要通过对心室壁运动、EF等进行定性及定量分析,整体性地评估心室功能。左室EDV和ESV是评价心室形态功能最基本的指标,EDV增加和EF降低反映左心室功能逐渐失去代偿,是左心衰发生和预后欠佳的征兆。本研究病变组与对照组左室EDV差异有统计学意义(P < 0.05)。左室EDV增大,室壁厚度增加,张力加大,心肌耗氧量进一步增加,心肌缺血情况加剧,从而使急性心肌梗死的风险进一步增大[12]。临床应根据左室心肌质量的异常,应及早进行干预及治疗。左室EF对心功能改变的反映不如左室心肌质量和左室EDV敏感,但左室EF下降程度与急性心肌梗死的发生率和病死率密切相关。国外相关研究[13]提示左室EF与急性心肌梗死4年存活率呈正相关。本研究中病变组左室EF值较对照组明显下降。研究[14]表明,左室EF有助于冠心病预后的判断,特别对慢性冠心病心肌梗死的风险判断有较高的价值。
心肌梗死后,最早出现的是心肌节段性WMA[15],表现为狭窄冠状动脉支配区域心肌节段性运动减弱;其是临床诊断冠状动脉病变的主要依据,其程度与冠心病危险程度的预后密切相关[16-18]。依据病理学特点,真性室壁瘤又分为功能性室壁瘤及解剖性室壁瘤。两者影像学表现不同,功能性室壁瘤在舒张末期无局部的对外膨出,收缩期才出现局部室壁的无运动及矛盾运动。解剖学室壁瘤则在舒张期及收缩期都恒定的向外膨凸,呈明显的矛盾运动。本组3例出现真性室壁瘤,2例位于心尖部(1例累及前间隔段),1例位于前侧壁;本组例数少,未见假性室壁瘤。研究[19-20]表明,约85%的室壁瘤发生在心尖部及前间隔部位,仅5%~10%位于下后壁、心底部,可能与心肌解剖结构有关,心尖部3层心肌结构,而心底部有4层,且下壁常由右冠状动脉及左冠状动脉回旋支双重血供,有良好的侧支循环,可减少薄壁室壁瘤的形成。
本研究尚存在不足:①入组的陈旧性心肌梗死患者大部分为住院患者,病情相对严重,在一定程度上影响对心脏功能及心肌梗死程度的评价;②对于心肌首过灌注和延迟强化的分析均通过目测定性判别,采用定量或半定量的分析方法能够更加客观地对灌注及强化程度进行评价;③由于心脏不停的运动,首过灌注与延迟强化序列很难完全匹配,对梗死病变的分析会产生一定误差。
总之,MRI心肌灌注及电影序列可有效评价陈旧性心肌梗死程度和范围,而心肌梗死体积与WMA、左室功能具有一定相关性。
| [1] |
Hsu LY, Groves DW, Aletras AH, et al. A quantitative pixel-wise measurement of myocardial blood flow by contrast-enhanced firstpass CMR perfusion imaging microsphere validation in dogs and feasibility study in humans[J]. JACC Cardiovasc Imaging, 2012, 5: 154-166. DOI:10.1016/j.jcmg.2011.07.013 |
| [2] |
Taylor AJ, Al-Saadi N, Abdel-Aty H, et al. Detection of acutely impaired microvascular reperfusion after infarct angioplasty with magnetic resonance imaging[J]. Circulation, 2004, 109: 2080-2085. DOI:10.1161/01.CIR.0000127812.62277.50 |
| [3] |
Roes SD, Borleffs CJ, Van RJ, et al. Infarct tissue heterogeneity assessed with contrast-enhanced MRI predicts spontaneous ventricular arrhythmia in patients with ischemic cardiomyopathy and implantable cardioverter-defibrillator[J]. Circ Cardiovasc Imaging, 2009, 2: 183-190. DOI:10.1161/CIRCIMAGING.108.826529 |
| [4] |
Breton E, Kim D, Chung S, et al. Quantitative contrast-enhanced first-pass cardiac perfusion MRI at 3 tesla with accurate arterial input function and myocardial wall enhancement[J]. J Magn Reson Imaging, 2011, 34: 676-684. DOI:10.1002/jmri.22647 |
| [5] |
Bingham SE, Hachamovitch R. Incremental prognostic significance of combined cardiac magnetic resonance imaging, adenosine stress perfusion, delayed enhancement, and left ventricular function over preimaging information for the prediction of adverse events clinical perspective[J]. Circulation, 2011, 123: 1509-1518. DOI:10.1161/CIRCULATIONAHA.109.907659 |
| [6] |
Husso M, Sipola P, Kuittinen T, et al. Assessment of myocardial perfusion with MRI using a modified dual bolus method[J]. Physiol Meas, 2014, 35: 533-547. DOI:10.1088/0967-3334/35/4/533 |
| [7] |
Albert TS, Kim RJ, Judd RM. Assessment of no-reflow regions using cardiac MRI[J]. Basic Res Cardiol, 2006, 101: 383-390. DOI:10.1007/s00395-006-0617-0 |
| [8] |
Gao XM, Liu Y, White D, et al. Deletion of macrophage migration inhibitory factor protects the heart from severe ischemia-reperfusion injury:A predominant role of anti-inflammation[J]. J Mol Cell Cardiol, 2011, 50: 991-999. DOI:10.1016/j.yjmcc.2010.12.022 |
| [9] |
Jaffe R, Charron T, Puley G, et al. Microvascular obstruction and the no-reflow phenomenon after percutaneous coronary intervention[J]. Circulation, 2008, 117: 3152-3156. DOI:10.1161/CIRCULATIONAHA.107.742312 |
| [10] |
Friedrich MG, Abdel-Aty H, Taylor A, et al. The salvaged area at risk in reperfused acute myocardial infarction as visualized by cardiovascular magnetic resonance[J]. J Am Coll Cardiol, 2008, 51: 1581-1587. DOI:10.1016/j.jacc.2008.01.019 |
| [11] |
Li C, Gao B, Guo F, et al. Quantitative evaluation of left ventricular volume and function in middle-aged healthy chinese people with 3 Tesla MRI[J]. J Magn Reson Imaging, 2016, 44: 1143-1150. DOI:10.1002/jmri.25243 |
| [12] |
Wachtell K, Palmieri V, Gerdts E, et al. Prognostic significance of left ventricular diastolic dysfunction in patients with left ventricular hypertrophy and systemic hypertension(the LIFE Study)[J]. Am J Cardiol, 2010, 106: 999-1005. DOI:10.1016/j.amjcard.2010.05.032 |
| [13] |
Hibberd MG, Chuang ML, Beaudin RA, et al. Accuracy of threedimensional echocardiography with unrestricted selection of imaging planes for measurement of left ventricular volumes and ejection fraction[J]. Am Heart J, 2000, 140: 469-475. DOI:10.1067/mhj.2000.108513 |
| [14] |
杨栓锁, 汤磊, 陈晖, 等. 慢性完全冠状动脉堵塞患者侧枝血管、室壁运动和射血分数研究[J]. 上海交通大学学报(医学版), 2009, 29(9): 1088-1091. DOI:10.3969/j.issn.1674-8115.2009.09.018 |
| [15] |
Kidambi A, Motwani M, Uddin A, et al. Myocardial extracellular volume estimation by CMR predicts functional recovery following acute MI[J]. JACC Cardiovasc Imaging, 2016, 10: 989-999. |
| [16] |
Ganame J, Messalli G, Masci PG, et al. Time course of infarct healing and left ventricular remodelling in patients with reperfused ST segment elevation myocardial infarction using comprehensive magnetic resonance imaging[J]. Eur Radiol, 2011, 21: 693-701. |
| [17] |
Elhendy A, Van Domburg R, Bax J, et al. The grade of worsening of regional function during dobutamine stress echocardiography predicts the extent of myocardial perfusion abnormalities[J]. Heart, 2000, 83: 35-39. DOI:10.1136/heart.83.1.35 |
| [18] |
Sarwar A, Shapiro MD, Nasir K, et al. Evaluating global and regional left ventricular function in patients with reperfused acute myocardial infarction by 64-slice multidetector CT:a comparison to magnetic resonance imaging[J]. J Cardiovasc Comput Tomogr, 2009, 3: 170-177. DOI:10.1016/j.jcct.2009.05.002 |
| [19] |
Gerbode F, Banerjee S, Marcelletti C. Surgical treatment of left ventricular aneurysm[J]. J Cardiovasc Surg, 1994, 17: 490-493. |
| [20] |
Jahnke C, Foell D, Heinrichs G, et al. Three-dimensional echocardiography for quantitative analysis of left-ventricular aneurysm[J]. Echocardiography, 2010, 27: 64-68. DOI:10.1111/echo.2010.27.issue-1 |
 2019, Vol. 17
2019, Vol. 17


